文章信息
- 闫伟, 韩秀丽, 白淑兰, 邵东华.
- Yan Wei, Han Xiuli, Bai Shulan, Shao Donghua.
- 虎榛子几种菌根苗抗旱机制的研究
- Research on Drought Resistance Mechanism to Different Mycorrhizal Seedlings of Ostyopsis davidiana
- 林业科学, 2006, 42(12): 73-76.
- Scientia Silvae Sinicae, 2006, 42(12): 73-76.
-
文章历史
- 收稿日期:2005-09-01
-
作者相关文章
虎榛子(Ostryopsis davidiana)隶属于桦木科(Betulaceae)、虎榛子属(Ostryopsis),主要分布于华北、西北土石山地和黄土高原地区,耐旱、耐寒、耐贫瘠,是我国特有优良护土灌木。对内蒙古大青山退化生态系统的研究发现:在其他植被不断退化的同时,虎榛子的存活却比较稳定,由此推测虎榛子有其独特的适应机制。众所周知,菌根在生态系统重建与恢复中的研究已成为人们关注的焦点(Ruizlozano et al., 1995; van Der et al., 1998),与植物共生的外生菌根真菌能更有效地提高植物在干旱胁迫下的适应性(Cantrell et al., 2001; Muhsin et al., 2002)。通过对虎榛子人工接种5种外生菌根真菌(6个菌株),并在干旱胁迫下,对虎榛子菌根苗各项生理生化指标的测定,试图探明不同外生菌根真菌对虎榛子生长及抗旱性的作用机制,从而为大青山植被恢复与保护提供科学依据。
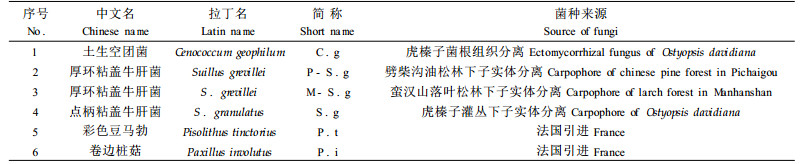
1 材料与方法 1.1 试验材料供试树种为虎榛子。供试菌种见表 1,这6个菌株是本研究小组合成筛选的,能与虎榛子形成菌根的菌株(白淑兰等, 2004;韩秀丽等, 2005)。
|
|
育苗基质选用蛭石和林地土(质量比为1:2),把准备好的基质混合后过3 mm筛,用自来水混拌使之含水量为50%。混匀后装入塑料袋内进行高温高压灭菌1.5 h,冷却后晾晒7 d备用。选择发育良好的虎榛子种子,温水浸泡24 h,无菌条件下用10%H2O2消毒30 min,再用无菌水冲洗3~4次,置于发芽箱内催芽。在育苗盆内放入灭菌基质,选发芽一致、健壮的芽苗播入其中,置于光照培养室内培养。
1.2.2 菌剂制备试验用固体菌剂。按花晓梅(1995)MMN固体培养基配方,配制一定量的营养液,然后称取蛭石混拌,固体培养基的含水量为70%,混匀后装入罐头瓶高温高压灭菌1 h。无菌条件下接入生长良好的平板菌种,同时做一定量未接种培养基(对照),放入24 ~25 ℃的暗培养室内培养,1个月后备用。
1.2.3 幼苗接种及培养试验使用120 mm×100 mm的育苗盆,先在盆底放约2 cm厚的灭菌基质,撒入5 g生长旺盛固体菌剂。选择在光照培养室内生长均匀的2个月虎榛子盆栽幼苗栽入其中,每盆栽1棵。注意把菌剂与苗根密接,以利于菌根的形成。定量覆土使每盆总质量为250 g,并设1个对照处理(接入5 g上述空白培养基),各接种处理与对照分别设50个重复,然后置于照度为1. 9万lx的光照培养室内培养。用天平称量及时补水,每2周浇1次稀释10倍的Hoagla nd营养液,每次每盆20 mL。
1.2.4 菌根感染率、生物量及生理生化指标的测定接种4个月后,采用划线交叉法统计苗木菌根感染率。然后给苗木浇水,使其达最大田间持水量,再进行自然干旱胁迫。当某个处理苗木第1片叶出现萎蔫时,随机抽取各处理苗木进行测定。生物量测定:沿茎基部将苗木剪断,地上、地下分别收获,在80 ℃烘箱内烘至恒重后测定,计算总生物量和根冠比;生理生化指标主要测定细胞膜透性、S O D活力、MDA含量、叶绿素含量、有效光合作用、植物组织水势、脯氨酸(Pro.)含量、叶片萎蔫及持续胁迫幼苗死亡时间等指标,每个处理各项指标均5次重复。生理生化指标测定方法参见文献(李合生,2000)。另外,对干旱胁迫后发生萎蔫的苗木每天随机抽取3盆进行复水处理,直到苗木不能复活为止,记录各处理苗木复水成活株数和持续时间。
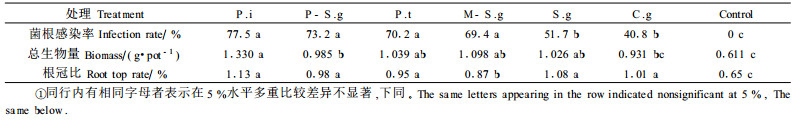
2 结果与分析 2.1 不同菌种对虎榛子幼苗菌根感染率、生物量及根冠比的影响研究表明:所有菌株与虎榛子均能形成菌根,菌根感染率均超过40.8%,而且总生物量和根冠比均显著高于对照。研究还表明:菌根感染率与苗木的总生物量、根冠比之间没有绝对的正相关性,即在各接种处理中P.i、P-S.g、P.t、M-S.g 4个处理的菌根感染率与S.g、C.g虽然有显著差异,但从总生物量分析,除P.i外,其余各处理之间无显著的差异,说明菌根的作用在一定感染率范围内具有相似的效应。P.i促生长效果最佳,总生物量是对照的2.1倍,当然这可能与其菌根感染率最高有一定的关系。而C.g虽然总生物量与对照无显著差异,但根冠比较对照高55.4%,仅次于P.i(表 2)。说明在干旱胁迫下C.g促使苗木把合成的有机物最大限度地运送到根部,使苗木形成发达的根系,从而有利于抗旱。
|
|
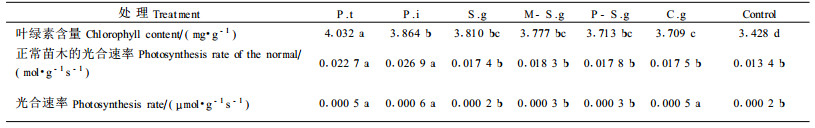
由表 3可知,在正常条件下菌根苗的叶绿素含量均与对照存在着显著差异。但光合速率只有P.t和P.i与对照存在显著差异。并分别为对照的2.0倍和1.7倍。但在干旱胁迫下除P. t、P.i菌根苗外,C.g菌根苗的光合速率与对照也存在显著的差异,为对照的2.5倍,从而表明C.g在干旱胁迫下对苗木光合速率的提高可能对苗木形成发达根系具有更重要的意义。
|
|
由表 4可知,菌根苗叶片组织水势均比对照高,其中C.g、P.t处理幼苗叶片水势最高,较对照提高了200%。菌根苗细胞膜的破坏程度比对照均降低,以C.g处理苗为最明显,比对照降低40.77%,其次是P-S.g、P.t。在干旱胁迫条件下,植株能保持较高的水势就可避免叶片过早脱水,膜的破坏程度就会降低,从而表现出较强的抗旱性。本研究表明:菌根苗细胞膜伤害率较低,导致萎蔫时间均比对照晚(见表 4),其中C.g出现萎蔫的时间较对照推迟了44 h,且临界致死时间也比对照推迟了60 h。说明C.g还可以通过提高植物体水势和降低膜的伤害程度来达到提高植物抗旱性的目的。
|
|
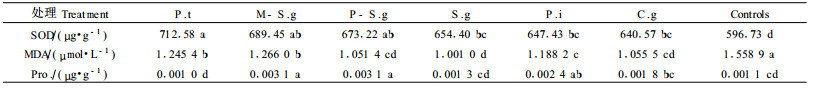
由表 5可见,菌根苗的SOD活性和MDA含量与对照差异显著。从不同菌根苗MDA含量分析,以P-S.g、S.g、P.i、C.g 4种菌根苗对MDA积累有显著的抑制作用。本试验还表明:P.i、P-S.g、M-S.g等菌根苗的脯氨酸含量均与对照差异显著。但其他菌根苗与对照差异不显著,这也许正是不同菌种对宿主植物的作用机制不同所致。
|
|
研究表明:菌根真菌的菌丝在获取光合产物、矿质营养及对环境的适应等方面存在着差异,从而不同菌种对宿主植物具有明显的功能多样性(Jakobsen et al., 1992; Michelsen et al., 1998; Lodge, 2000; Smith et al., 2000)。那么功能多样性必然决定于生理、生化途径的多样性。本研究表明:菌根感染率在某一范围内对苗木的作用效应相似。另外,虎榛子形成菌根后能显著提高其抗旱性,但不同菌株的抗旱机制似乎存在着一定的差异,这可能就是菌根真菌功能多样性所致。C.g和P.t通过提高植物体内的水势、SOD活性、降低膜伤害程度及M DA含量等机制来增强苗木的抗旱性,从而推迟苗木的萎蔫时间,并且复水后很容易复活,导致抗旱临界致死时间较长。试验结果还表明:菌根苗能显著促使苗木形成发达的根系,增大根冠比,尤其是C.g,虽然对苗木总生物量的提高不明显,但它会促使植物把有限的光合产物运送到根部,形成发达的根系。P-S.g、M-S.g等菌株通过提高苗木SOD活性和Pro.含量、降低MDA含量等机制来提高苗木的抗旱性。而P.i则是通过促进苗木健壮生长、降低苗木细胞膜伤害程度、提高SOD活性和Pro.浓度、降低MDA含量等多种机制提高苗木的抗旱性。
植物在逆境中生存,会造成氧自由基平衡失调,进而破坏膜结构的稳定,增大膜透性,加大逆境的伤害程度。SOD活性维持在一个较高水平时,能有效清除超氧自由基,降低膜质过氧化水平,减轻膜伤害程度,保证生物膜的能量转换、物质运输、信息传递和代谢调节等过程的正常进行,从而提高了苗木的抗旱性(王宝山,1988)。MDA是逆境下膜质过氧化产物之一,MDA含量越低,说明细胞膜质过氧化程度越弱,植物受害越轻。另外,植物的生长势与发达的根系对提高植物抗旱性也具有重要的作用,一般苗木生长势强,抵抗不良环境的能力也强;对于干旱胁迫而言,根冠比大,说明苗木具有发达的根系,能最大限度地吸收环境中的水分,从而提高植物的抗旱性。
白淑兰, 白玉娥, 方亮, 等. 2004. 土生空团菌与虎榛子形成的菌根及其对虎榛子生长的影响. 林业科学, 40(6): 194-196. DOI:10.3321/j.issn:1001-7488.2004.06.035 |
韩秀丽, 方亮, 周晶, 等. 2005. 虎榛子外生菌根合成与筛选的研究. 华北农学报, 20(2): 101-104. DOI:10.3321/j.issn:1000-7091.2005.02.026 |
花晓梅. 1995. 林木菌根研究. 北京: 中国科学技术出版社, 367-369.
|
李合生. 2000. 植物生理生化试验原理和技术. 北京: 高等教育出版社, 105-263.
|
王宝山. 1988. 生物自由基与植物膜脂伤害. 植物生理学通讯, 24(2): 12-16. |
Cantrell C, Linderman R G. 2001. Preinoculation of lettuce and onion with VA mycorrhizal fungi reduces deleterious effects of soil salinity. Plant and Soil, 233(2): 269-281. DOI:10.1023/A:1010564013601 |
Jakobsen I, Abbott L K, Robson A D. 1992. External hyphae of vesicular-arbuscular mycorrhizal fungi associated with Trifolium subterraneum L. I. Spread of hyphae and phosphorus inflow into roots. New Phytologist, 120: 371-380. |
Lodge D J. 2000. Ecto-orarbuscular mycorrhizas which are best?. New Phytologist, 146: 353-354. DOI:10.1046/j.1469-8137.2000.00668.x |
Michelsen A, Quarmby C, Sleep D, et al. 1998. Vascular plant 15N natural abundance in heath and forest tundra ecosystems is closely correlated with presence and type of mycorrhizal fungi in roots. Oecologia, 115: 406-418. DOI:10.1007/s004420050535 |
Muhsin T M, Zwiazek J J. 2002. Ectomycorrhizas increase apoplastic water transport and root hydraulic conductivity in Ulmus americana seedlings. New Phytologist, 153(1): 153-158. DOI:10.1046/j.0028-646X.2001.00297.x |
Ruizlozano J M, Azcon R. 1995. Hyphal contribution to water uptake in mycorrhizal plants as afected by the fungul species and water status. Physiologia Plantarum, 95(3): 427-478. |
Smith F A, Jakobsen I, Smith S E. 2000. Spatial differences in acquisition of soil phosphate between two arbuscular mycorrhizal fungi in symbiosis with Medicago truncatula. New Phytologist, 147: 357-366. DOI:10.1046/j.1469-8137.2000.00695.x |
van Der H, Klironomos J N, Ursic M, et al. 1998. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature, 396(5): 69-72. |
 2006, Vol. 42
2006, Vol. 42