文章信息
- 郝杰杰, 宋福强, 田兴军, 黄丰, 张鹏, 张智俊.
- Hao Jiejie, Song Fuqiang, Tian Xingjun, Huang Feng, Zhang Peng, Zhang Zhijun.
- 几株半知菌对马尾松落叶的分解——木质纤维素酶的活性动力学
- Decomposition of Pinus massoniana Needle Driven by Deuteromycetes——Dynamics of Lignocellulolytic Enzymes
- 林业科学, 2006, 42(11): 69-75.
- Scientia Silvae Sinicae, 2006, 42(11): 69-75.
-
文章历史
- 收稿日期:2005-06-06
-
作者相关文章
2. 黑龙江大学微生物重点实验室 哈尔滨 150080
2. Key Laboratory of Microbiology in Heilongjiang University Harbin 150080
光合作用产生的50 %~60 %生物量以木质纤维素形式储存在植物的组织中(Kirk, 1983)。在自然界中, 当植物体死亡或者组织凋落后, 有机碳, 即木质纤维素等落入土壤上层, 这些坚固的复合有机物质主要通过土壤中的微生物降解代谢, 才能够再生和维持地球的碳循环(Hammel, 1997)。用于纤维素降解的酶主要有羧甲基纤维素酶、滤纸糖酶等水解酶(Takashima et al., 1998); 但由于纤维素通常与木质素紧密链接(Lee, 1997), 只有脱木质化后的纤维素才能够被微生物降解(Boominathan et al., 1992)。在自然界的木质素降解过程中, 主要的降解酶以木质素过氧化物酶、锰过氧化物酶和漆酶为主(Sugiura et al., 2003)。
众所周知, 白腐菌是快速降解木质素的主要菌种(Falcon et al., 1995); 但地球上碳循环并不是单纯地归功于白腐菌, 富含木质纤维素以及木质素衍生复合物的土壤中也生存着大量的其他能够降解木质素、纤维素的微生物, 特别是一些放线菌、子囊菌和半知菌, 它们对地球碳循环同样起着不可替代的作用(Falcon et al., 1995)。Saito等(2003)已经从不同环境地点的土壤样品中分离到能够产生较高漆酶活性的半知菌菌株。有研究表明: Aspergillus niger和Penicillium sp.具有显著代谢降解有毒的木质素类多环芳烃的潜能(Thygesen et al., 2003)。目前, 国内外着眼于森林凋落物降解方面的研究基本从宏观或者底物化学成分变化2方面来进行, 关于降解过程中分解菌释放的起关键作用的木质纤维素酶报道却很少。在降解森林凋落物过程中, 正是由于微生物产生的分解酶的作用引起底物化学成分的变化, 实现凋落的分解和养分的释放(Burns, 1978)。
在前期工作基础上, 从马尾松(Pinus massoniana)林和栓皮栎(Quercus variabilis)林的有机凋落物层中分离到56株半知菌(Song et al., 2004), 并且研究了它们降解森林凋落叶片的能力(宋福强等, 2005)。本研究选择了其中的6株分解能力较强的半知菌, 来探讨半知菌在分解以马尾松凋落叶为底物的生物降解过程中, 所产生木质素酶和纤维素酶的动力学机制以及与底物降解速率的相互关系, 试图从酶学水平上进一步了解森林生态系统的分解机制; 同时, 也希望筛选出降解木质纤维素较快或者分泌木质纤维素酶较高的菌株。
1 材料与方法本试验在南京大学中心分析实验室和植物学实验室进行。试验中所用溶液和化学试剂均为分析纯。酶活性系采用U-3000紫外分光光度计(Hitachi Ltd., Tokyo, Japan)测定完成。
1.1 菌种选择和保藏依据前期研究结果(Song et al., 2004; 宋福强等, 2005), 从56种丝状菌株中选择了6种分解能力相对较快和出现频率较大的菌株: Aspergillus fumigatus, Alternaria sp., Penicillium sp., Pestalotia sp., Cephalosporium sp.和Tricherderma sp.。菌种在PDA斜面培养基上保存于4 ℃的冰箱中, 每隔30天复壮一次。使用前平板扩繁。
1.2 固体发酵试验中所用的马尾松针叶于2004年11月采自南京紫金山(32° 5′N, 118° 48′E)。试验前用蒸馏水将叶片表面清洗3次, 72 ℃烘干24 h。烘干的叶片用机械捣碎器碾成0.2~0.4 mm后作为培养底物。将每个锥形瓶(250 mL)中装入2.0 g底物, 再用8.0 mL 0.5 %的麦芽浸汁润湿底物(Arora et al., 2002), 121 ℃高压灭菌30 min。待冷却后每个锥形瓶接种4片直径为8 mm的菌丝圆片作为接种物, 此接种物为取自27 ℃下培养7~9 d的PDA平板边缘菌丝生长旺盛的琼脂块。未接种的对照组也置于同样条件下。锥形瓶的瓶口用透气的纤维素塞子封住, 保持90 %湿度, (28 ±2)℃黑暗培养。培养2 d后第一次取样, 之后每隔7 d取一次直至第30 d, 最后一次间隔14 d取样。每个处理3个重复。
1.3 粗酶液的提取和质量损失的计算以底物的总有机物质(TOM)质量损失和降解速率作为指标来分析6种半知菌降解森林凋落物的能力。取样后, 向锥形瓶中加入10 mL提前预冷的醋酸钠缓冲溶液(50 mmol, pH 6.0), 25 ℃下置于旋转摇床上振荡20 min(120 r·min-1), 将混合液经烘干称重的Whatman No.1滤纸过滤。滤液再置于4 ℃冷冻离心机中10 000 g离心10 min, 取上清液作为粗酶液测定酶活性, 离心管中的沉淀物也置于上述滤纸上与第一次的过滤物一同烘干至恒重(72 ℃)。
样品质量损失率(%)=(样品的初始干质量-样品分解后的干质量)样品初始的干质量×100 %; 平均降解速率(%)=总TOM质量损失率培养天数。
1.4 酶活性测定 1.4.1 木质素酶的测定漆酶(EC 1.10.3.2)酶活性的测定采用ABTS作为底物(Buswell et al., 1995), 一个单位的酶活性定义为30 ℃条件下每分钟氧化1 μmol底物ABTS的酶量。底物ABTS的氧化通过测定反应液在420 nm下的吸光值来确定, 摩尔消光系数为36 000 mol-1·cm-1。LiP (EC 1.11.1.14)酶活性的测定采用30 ℃条件下以藜芦醇作为氧化底物产生藜芦醛的方法(Tien et al., 1988), 一个单位的酶活性定义为每分钟每毫升反应液的吸光值变化0.1个单位, MnP (EC 1.11.1.13)酶活性的测定采用苯酚红的方法(Orth et al., 1993), 一个单位的酶活性定义为610 nm下每分钟每毫升反应液的吸光值上升0.1个单位, 用U·mL-1表示。
1.4.2 纤维素酶的测定CMCase (EC 3.2.1.4)和FPA (EC 3.2.1.91)的测定依据Rodriguez等(1984)的方法, 测定羧甲基纤维素钠和滤纸条(Whatman No.1)释放的还原糖。空白对照的测定用0.5 mL热变性的粗酶液代替新鲜的粗酶发酵液。还原糖的测定采用3, 5-二硝基水杨酸的方法(Miller, 1959)。一个单位的酶活性定义为每分钟释放1 μmol产物的酶量, 用U·mL-1表示。
2 结果与分析 2.1 发酵提取液颜色变化试验中选用的6种半知菌均能在以马尾松落叶为底物的固体发酵基质上生长, 在开始阶段生长旺盛。第一次取样分析时, 对照组和试验组的缓冲提取液都表现出相似的透明褐棕色。44天以后, 对照组的发酵提取液颜色未变, 而Alternaria sp., Penicillium sp., Cephalosporium sp.和Tricherderma sp.的提取液显示出透明淡黄色; Pestalotia sp.的提取液却是清澈透明的; Aspergillus fumigatus的提取液仅次于Pestalotia sp., 也几乎无颜色。
2.2 TOM质量损失和平均降解速率如图 1, 在开始的9天内(前期), Alternaria sp.引起凋落物TOM质量损失和降解速率最高, 分别为6.0 %和0.66 %·d-1;其次是Penicillium sp., Tricherderma sp.和Cephalosporium sp., 质量损失分别为5.1 %、4.4 %和3.3 %, 它们的日平均降解速率在0.37 %~0.66 %之间。Pestalotia sp.和Aspergillus fumigatus引起TOM质量损失相对较低, 分别为2.1 %和1.6 %, 日平均降解速率为0.24 %和0.18 %。但是到后期(9~44天), Pestalotia sp.引起TOM质量损失却最高, 为22.8 %, Aspergillus fumigatus的TOM质量损失也追上其他4株菌, 这5种菌引起的TOM质量损失在10.0 %~14.1 %的范围内。而且, Aspergillus fumigatus和Pestalotia sp.的日平均降解速率(0.31 %~0.59 %)明显高于其他4种菌(0.19 %~0.24 %)。
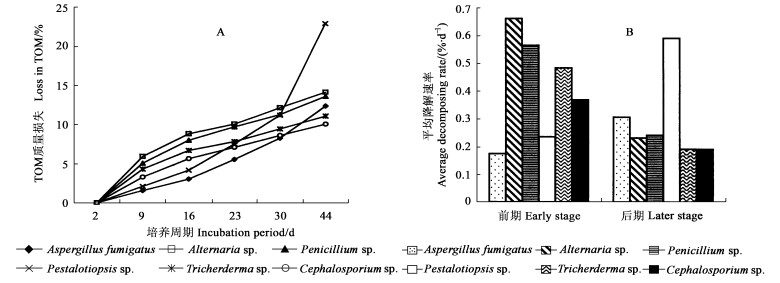
|
图 1 6种菌株在降解马尾松落叶过程中TOM质量损失和平均降解速率的变化 Fig. 1 The changes in loss in TOM and decomposing rate during the decomposition of Pinus massoniana needle litter by six fungi imperfecti |
在固体发酵开始的第2天, 没有检测到任何酶活性。在第9天时, 除了LiP外, 其他的木质素酶活性均被检测到, 6种菌的漆酶的酶活性都在第9天达到高峰。Pestalotia sp.产生的酶活性最高(0.35 U·mL-1), 其次是Aspergillius fumigatus。而Penicillium sp., Tricherderma sp., Cephalosporium sp.和Alternaria sp.产生的漆酶显著低于Pestalotia sp.和Aspergillus fumigatus (P < 0.05)(图 2A)。
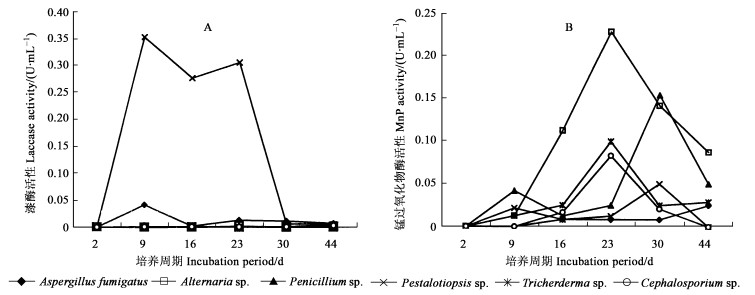
|
图 2 6种菌株在降解马尾松落叶过程中漆酶和锰过氧化物酶活性的变化 Fig. 2 The changes of laccase and M nP activities during the decomposition of Pinus massoniana needle litter by six fungi imperfecti |
Alternaria sp.产生的MnP酶活性在第23天最高, 0.23 U·mL-1; 其次为Penicillium sp.在第30天达到高峰, 0.15 U·mL-1; Tricherderma sp.和Cephalosporium sp.都在第23天到达高峰, 分别为0.10和0.08 U·mL-1。而Pestalotia sp.和Aspergillus fumigatus在整个发酵过程中产生的MnP酶活性相对于另外4种菌总是保持在一个很低的水平内。Penicillium sp.产生的MnP酶活性出现2次高峰, 分别在第9天和第30天(图 2B)。
2.4 6种菌株产生纤维素酶的变化Pestalotia sp.分泌的CMCase酶活性高峰值明显的高于其他菌株, 在第16天达到0.39 U·mL-1, 其次为Aspergillus fumigatus, Alternaria sp., Penicillium sp., Tricherderma sp.和Cephalosporium sp., 都在第16天出现最大峰值, 随后在第30天再次出现峰值(图 3A)。
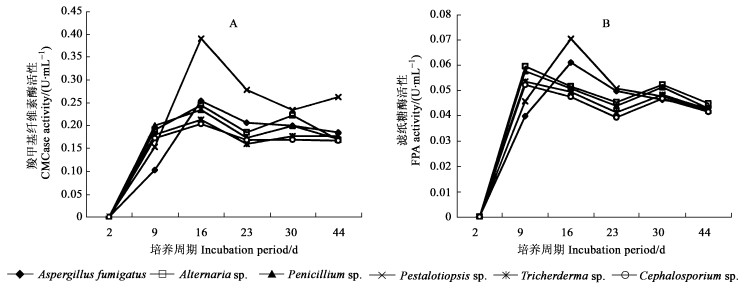
|
图 3 6种菌株在降解马尾松落叶过程K羧甲基纤维素酶和滤纸糖酶活性的变化 Fig. 3 The changes of CMCase and FPA activities during the decomposition of Pinus massoniana needle litter by six fungi imperfecti |
6种菌株产生的FPA的酶活性均较CMCase的酶活性低。Pestalotia sp.在第16天分泌的FPA酶活性最高, 为0.07 U·mL-1; 其次是Aspergillus fumigatus, 也在第16天到达峰值。Alternaria sp., Penicillium sp., Tricherderma sp.和Cephalosporium sp.产生的酶活性最大值较前两者低, 都分别在第9天和第30天显示出2次峰值(图 3B)。
3 结论与讨论在本试验过程中采用藜芦醇的方法未能测到LiP的酶活性, 这可能是因为叶片中含有一些抑制成分和有色物质干扰了测定结果, 或者本来分泌的LiP酶活性就很低。作为替代方法, 采用H2O2参与条件下氧化染料Azure B于pH 2.5、温度25 ℃(Archibald, 1992), 仍然没有测到LiP酶活性。据报道, 至今发现降解真菌中有5种氧化过氧化木质素降解酶体系: 1)只有LiP和MnP(Fukushima et al., 1995; Barbosa et al., 1996; Raghukumar et al., 1994); 2) LiP, MnP和Laccase(Lundell et al., 1994); 3) Laccase和LiP(Vares et al., 1993); 4) Laccase和MnP(Tapia et al., 1995); 5)只有Laccase(Eggert et al., 1996; Marzullo et al., 1995; Coll et al., 1993)。由此可以摧断, 本试验所采用的6种半知菌在降解马尾松落叶的过程中很有可能是上述降解酶体系的第4种。
除白腐菌外, 土壤中的半知菌也能够降解木质素和其他难降解的难分解底物(Kadam et al., 1986; Falcon et al., 1995), 以及杀菌剂、多环芳烃、染料等异质的生物物质(Hofrichter et al., 1993; Kim et al., 1995; Launen et al., 1995), 这表明土壤半知菌在降解自然界中的木质素和沉积的污染物中扮演重要的角色。最近报道了Fusarium solani固体发酵中能够降解小麦秸秆中25 %的碳水化合物和木质素, 同时它分泌的木质纤维素酶也能够降解聚合染料RBBR, poly R-478和bezopyrene (Verdin et al., 2004)。Aspergillus spp. (MPS-002)也被报道能够降解香蕉废弃物中的纤维素、半纤维素和木质素成分(Maulin et al., 2005)。在本试验中, TOM的不断质量损失和发酵提取物颜色的不断变浅都可以说明这6种半知菌也能够降解针叶中的木质纤维素成分以及其中的一些有色复合物。而且, 结果已表明: Pestalotia sp.和Aspergillus fumigatus的漆酶酶活性远远高于其他4种半知菌, 这可能是Pestalotia sp.和Aspergillus fumigatus的发酵提取液较另外4种菌的提取液更浅的原因, 因为漆酶能够应用于染料的脱色和降解(Thurston, 1994; Wong et al., 1999)。
根据结果所显示的TOM质量损失和平均降解速率, 6种土壤半知菌可以划分为2种功能类群:功能群Ⅰ包括Alternaria sp., Penicillium sp., Cephalosporium sp.和Tricherderma sp.4种菌; 功能群Ⅱ包括Pestalotia sp.和Aspergillus fumigatus 2种。功能群Ⅰ的4种菌在降解早期阶段, 其引起的TOM质量损失高于功能群Ⅱ的, 分解速率也相应地比功能群Ⅱ要快, 但随后TOM质量损失和分解速率却慢下来(图 1); 而功能群Ⅱ 2种菌后期分解速率要比其前期以及功能群Ⅰ的后期都要明显快得多。同时在试验中发现, 这2功能群菌分别产生有规律的木质素酶和纤维素酶。由于森林凋落物的降解与微生物在降解过程中产生的木质素酶和纤维素酶有密切的关系, 因此可以从这2种酶的分泌水平来揭示所研究的2功能群菌对马尾松凋落叶具有不同的分解速率。
在前期, 真菌主要消耗利用叶片中已经存在的可溶性碳水化合物和非木质化的纤维素等物质(Osono, 2003), 而且在开始时用于真菌生长所需的营养也是充分的, 所以前期的分解速率主要取决于纤维素酶的高低。从图 3结果来看, 功能群Ⅰ中4种分解菌在开始9天内分泌的CMCase和FPA酶活性比功能群Ⅱ 2种菌的要高, 分解利用落叶中可溶性的养分和有机复合物的速率相对要快, 这可能正是功能群Ⅰ前期的分解速率高于功能群Ⅱ的原因。而且在功能群Ⅰ和功能群Ⅱ各自包含的菌种之间, FPA酶活性较高的菌株, 它的CMCase酶活性也相应较高, 同时引起TOM的质量损失也会较高(图 1A), 相应的降解速率也较快(图 1B)。这种现象表明了FPA和CMCase在马尾松落叶早期的降解过程中协同地发生作用。虽然功能群Ⅱ 2种菌株在分解过程中分泌的漆酶显著高于功能群Ⅰ的, 但脱木质化是要经过开始的解聚作用(Hammel, 1997), 然后才能降解利用木质素, 所以漆酶只能在降解过程的后期才能表现出它的主导地位, 而在分解前期主要是为后期的真正木质素降解做准备。
在降解过程中, 落叶中直接可被真菌利用的成分是有限的, 它们会随着菌丝生长而不断地消耗殆尽, 坚韧的木质素以及木质化的纤维素由于很难被降解从而不断地积累(Osono, 2003), 所以在后期的降解作用中, 这些沉积下来的木质素和木质化的纤维素成为进一步制约降解的主要因素。由于功能群Ⅱ菌株分泌的漆酶明显高于功能群Ⅰ, 所以它们能够相对更有效地进行脱木质化作用。只有脱木质化作用之后, 纤维素才可作为纤维素酶的底物(Hammel, 1997), 转化为可被微生物直接吸收利用的成分, 从而降解作用才能继续进行下去。特别是Pestalotia sp., 由于它产生的漆酶远远高于其他菌株, 所以它在后期的降解速率非常明显地居于首位。同时根据所显示的试验结果, 功能群Ⅱ 2种菌株的CMCase和FPA在第16天才达到最高, 而且高于功能群Ⅰ的CMCase和FPA酶活性。从而可以推测, 由于木质素酶和纤维素酶的协同作用, 致使功能群Ⅱ菌株的后期分解速率要比其前期以及功能群Ⅰ后期的都要明显快得多; 而功能群Ⅰ 4种菌后期的降解速率下降可能是因为它们的漆酶酶活性很低, 使得积累下来的坚韧的木质素物质很少被降解, 菌丝生长受到限制, 这可能也是功能群Ⅰ的菌株在后期生产FPA酶活性下降的原因。当然, 功能群Ⅰ的MnP酶活性要比功能群Ⅱ的高, 但总体上MnP的酶活性水平较漆酶酶活性要低, 所以可以认为MnP不能够影响到2功能群之间的差异; 但却能够影响到功能群Ⅰ各种菌株之间的差异, 因为在漆酶酶活性普遍很低的功能群Ⅰ内部, MnP酶活性较高的菌株, 它的脱木质化作用也就相对要更有效, 结果也显示它的CMCase和FPA酶活性也会较高, 引起的TOM质量损失和降解速率也较高。因此可以认为功能群Ⅱ的2种菌株为木质纤维素分解菌, 它们不仅能够利用早期的植物源性可溶性有机物质, 而且在降解过程中能够比较有效地脱木质化作用, 即使在分解后期也会不断地提供菌丝生长所需的有机物质, 即其对凋落物的降解比较彻底; 而功能群Ⅰ的4种菌为糖或者纤维素分解菌(Osono et al., 2002), 因为这4种菌在落叶上生长进而降解叶片的能力主要依赖于叶片中已经存在的可被直接利用的可溶性碳水化合物或者非木质化的纤维素物质等成分, 其在降解过程中脱木质化作用很弱, 到后期时由于缺乏可利用的能源物质致使降解减慢。
试验中某些真菌产生的酶活性出现2次高峰, 这与所报道的一些白腐菌的木质素酶和纤维素酶相一致(Ruttimann et al., 1992; Raghukumar et al., 1999; Arora et al., 2000)。第二次峰值的出现可能是因为菌丝自溶而致使原来束缚在细胞膜上相应的胞内酶被释放出来的缘故。这6种菌株的TOM质量损失都在第44天达到最大值, 而它们的MnP、Laccase、CMCase和FPA酶活性的最高值都出现在此之前, 表明在落叶降解过程中这些酶协同作用从而使马尾松针叶地不断地被分解。
马尾松落叶作为底物的固体发酵过程中, Pestalotia sp.产生漆酶的酶活性最高(0.35 U·mL-1), 这在目前所报道的未经纯化的粗酶酶活性数据中是一个相对较高的数值, 而且它的产生并不依赖于添加一些诸如土温80、阿魏酸、Cu2+或者二甲代苯胺等诱导因子。这表明Pestalotia sp.是一株比较有效的生产漆酶的半知菌。
最近, 利用农业以及森林中的残余生物量作为发酵过程中可替代的再生性能源在工业上具有极大的吸引力(Durrant, 1996)。发酵产生的木质素酶, 特别是漆酶在许多方面都有广泛的应用, 比如造纸工业上的生物制浆和生物脱色(Boominathan et al., 1992), 土壤恢复和有毒污染物的降解(Breen et al., 1999; Cameron et al., 2000), 以及工业废水的处理(Robinson et al., 2001; Hublik et al., 2000)等。因此, 本试验中应用森林针叶作为固体发酵底物为工业上利用廉价的营养底物生产漆酶以及将木质纤维素底物转化为有用的产物提供理论依据。
宋富强, 田兴军, 郝杰杰, 等. 2005. 栓皮栎林下主要丝状真菌的分解能力. 生态学报, 25(1): 89-95. DOI:10.3321/j.issn:1000-0933.2005.01.015 |
Arora D S, Gill P K. 2000. Laccase production by some white-rot fungi under different nutritional conditions. Bioresour Technol, 73: 283-285. DOI:10.1016/S0960-8524(99)00141-8 |
Arora D S, Chander M, Gill P K. 2002. Involvement of lignin peroxidase, manganese peroxidase and laccase in degradation and selective ligninolysis of wheat straw. Int Biodeter Biodegr, 50: 115-120. DOI:10.1016/S0964-8305(02)00064-1 |
Archibald F S. 1992. A new assay for lignin-type peroxidases employing the dye Azure B. Appl Environ Microbiol, 58: 3110-3116. |
Barbosa A M, Dekker R F H, Hardy G. 1996. Veratryl alcohol as an inducer of laccase by an ascomycete, Botryosphaeria sp. when screened on the polymeric dye Poly R-478. Lett Appl Microbiol, 23: 93-96. DOI:10.1111/j.1472-765X.1996.tb00038.x |
Boominathan K, Reedy C A.1992.Fungal degradation of lignin ∥Arora D S, Elander R P, Mukerji K G, et al.Handbook of applied mycology.Marcel Dekker, New York, 4: 763-782
|
Breen A, Singleton F L. 1999. Fungi in lignocellulose breakdown and biopulping. Curr Opin Biotech, 10: 252-258. DOI:10.1016/S0958-1669(99)80044-5 |
Buswell J A, Cai Y J, Chang S T. 1995. Effect of nutrient nitrogen and manganese on manganese peroxidase and laccase production by Lentinula edodes. FEMS Microbiol Lett, 128: 81-88. DOI:10.1111/j.1574-6968.1995.tb07504.x |
Burns R G.1978.Enzyme activity in soil: some theoretical and practical consider-actions∥Burns R G. Soil enzymes. Academic Press, London, UK, 295-340
|
Cameron M D, Timofeevski S, Aust S D. 2000. Enzymology of Phanerochaete chrysosporium with respect to the degradation of recalcitrant compouns and xenobiotics. Appl M icrobiol Biot, 54: 751-758. DOI:10.1007/s002530000459 |
Coll P M, Fernandez-Abalos J M, Villaneueva J R, et al. 1993. Purification and characterization of a phenol oxidase (laccase) from the lignin-degrading basidiomycete PM1 (CECT 2971). Appl Environ Microbiol, 59: 2607-2613. |
Durrant I R. 1996. Biodegradation of lignocellulosic materials by soil fungi isolated under anaerobic conditions. Int Biodeter Biodegr, 6: 189-195. |
Eggert C, Temp U, Eriksson K E L. 1996. The ligninolytic system of the white-rot fungus Pycnoporus cinnabarinus :purification and characterization of the laccase. Appl Environ M icrobiol, 62: 1151-1158. |
Falcon M A, Rodriguez A, Carnicero A, et al. 1995. Isolation of microorganisms with lignin transformation potential from soil of tenerife island. Soil Biol Biochem, 27: 121-126. DOI:10.1016/0038-0717(94)00174-Y |
Fukushima Y, Kirk T K. 1995. Laccase component of the Ceriporiopsis subvermispora lignin-degrading system. Appl Environ M icrobiol, 61: 872-876. |
Hammel K E.1997. Fungal degradation of lignin∥Cadisch G, Giller K E. Plant litter quality and decomposition. Wallingford, UK, Cab International, 33-45
|
Hofrichter M, Gunther T, Fritsche W. 1993. Metabolism of phenol, chloro and nitrophenols by the penicillum strain Bi 7/2 isolated from a contaminated soil. Biodegradation, 3: 415-421. |
Hublik G, Schinner F. 2002. Characterization and immobilization of the laccase from Pleurotus ostreatus and its use for the continuous elimination of phenolic pollutant. Enzyme Microbiol Technol, 7: 330-336. |
Kirk T K.1983.Degradation and conversion of ligninocellulose∥ Smith J E, Berry D R, Kristiansen B.The filamentous fungi.Fungal Technology, London, Edward Arnold, 4: 266-295
|
Kadam K L, Drew S W. 1986. Study of lignin biotransformation by Aspergillus fumigatus and white rot fungi using 14C-lableled and unlabeled Kraft lignins. Biotechnol Bioeng, 28: 394-404. DOI:10.1002/bit.260280313 |
Kim S J, Ishikawa K, Hirai M, et al. 1995. Characteristics of a new ly isolated fungus Geotrichum candidum dec 1, which decolorize various dyes. J Ferment Bioeng, 79: 601-607. DOI:10.1016/0922-338X(95)94755-G |
Launen L, Pinto L, Wiebe C, Kiehlmann E, et al. 1995. The oxidation of pyrene andbenzo(a) pyrene by nonbasidiomycete soil fungi. Can JMicrobiol, 41: 477-488. DOI:10.1139/m95-064 |
Lee J. 1997. Biological conversion of lignocellulosic biomass to ethanol. J Biotechnol, 56: 1-24. DOI:10.1016/S0168-1656(97)00073-4 |
Lundell T, Hatakka A. 1994. Participation of Mn (Ⅱ)in the catalysis of laccase, manganese peroxidase and lignin peroxidase from Phlebia radiatai. FEBS Lett, 348: 291-296. DOI:10.1016/0014-5793(94)00627-X |
Marzullo L, Cannio R, Giardina P, et al. 1995. Veratryl alcohol oxidase from Pleurotus ostreatus participates in lignin biodegradation and prevents polymerization of laccase-oxidised substrates. J Biol Chem, 270: 3823-3827. DOI:10.1074/jbc.270.8.3823 |
Maulin P S, Reddy G V, Banerjee R, et al. 2005. Microbial degradation of banana waste under solid state processing using two lignocellulolytic fungi (Phylosticta spp. MPS-001 and Aspergillus spp. MSP-002). Proc Biochem, 40: 445-451. DOI:10.1016/j.procbio.2004.01.020 |
Miller G L. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugars. Anal Chem, 31: 426-428. DOI:10.1021/ac60147a030 |
Orth A B, Royse D J, Tien M. 1993. Ubiquity of lignin degrading peroxidases among variouswood degrading fungi. Appl EnvironMicrobiol, 59: 4017-4023. |
Osono T. 2003. Effects of prior decomposition of beech needle litter by phyllosphere fungi on substrate utilization by fungal decomposers. Mycoscience, 44: 41-45. DOI:10.1007/S10267-002-0078-8 |
Osono T, Takeda H. 2002. Comparison of litter decomposing ability among diverse fungi in a cool temperate deciduous forest in Japan. Mycologia, 94: 421-427. DOI:10.1080/15572536.2003.11833207 |
Robinson T, Chandran B, Nigam P. 2001. Studies on the production of enzymes by white-rot fungi for the decolourisation of textile dyes. Enzyme Microb Technol, 29: 575-579. DOI:10.1016/S0141-0229(01)00430-6 |
Rodriguez H, Volfova O. 1984. Formation and location of cellulases in a cellulomonas culture on bagasse. Appl Microbiol Biotechnol, 19: 134-138. DOI:10.1007/BF00302455 |
Raghukumar C, Dsouza T M, Thorn R G, et al. 1999. Lignin modifying enzymes of Flavodon flavus, a basidiomycete isolated from costal marine environment. Appl Environ Microbiol, 65: 2103-2111. |
Raghukumar C, Raghukumar S, Chinnaraj A, et al. 1994. Laccase and other lignocellulose modifying enzymes of marine fungi isolated from the coast of India. Bot Marina, 37: 515-523. |
Ruttimann C, Schwember E, Salas L, et al. 1992. Ligninolytic enzymesof white-rot basidiomycete Phlebis brevispora and Cereporiopsis subvermispora. Biotechnol Appl Biochem, 16: 64-76. |
Saito T, Hong P, Kato K, et al. 2003. Purification and characterization of an extracellular laccase of a fungus (family Chaetomiaceae)isolatedfrom soil. Enzyme Mirob Technol, 33: 520-526. DOI:10.1016/S0141-0229(03)00158-3 |
Song Fuqiang, Tian Xingjun, Li Zhongqi. 2004. Diversity of filamentous fungi in organic layers of two forests in Zijin Mountain. J Forest Res, 15: 273-279. DOI:10.1007/BF02844951 |
Sugiura M, Hirai H, Nishida T. 2003. Purification and characterization of a novel lignin peroxidase from white-rot fungus Phanerochaete sordida YK-624. FEMS Microbiol Lett, 224: 285-290. DOI:10.1016/S0378-1097(03)00447-6 |
Takashima S, Iikura H, Nakamura A, et al. 1998. Over production of recombinant Trichoderma reesei cellulases by Aspergillus oryzae and their enzymatic properties. J Biotechnol, 65: 163-171. DOI:10.1016/S0168-1656(98)00084-4 |
Tapia J, Vicuna R. 1995. Synthetic lignin mineralization by Ceriporiopsis subvermispora is inhibited by an increase in the pH of the cultures resulting from fungal growth. Appl Environ Microbiol, 61: 2476-2481. |
Thurston C F. 1994. The structure and function of fungal laccase. Microbiology, 140: 19-26. DOI:10.1099/13500872-140-1-19 |
Thygesen A, Thomsen A B, Schmidt A S, et al. 2003. Production of cellulose and hemicellulose-degrading enzymes by filamentous fungi cultivated on wet-oxidised wheat straw. Enzyme Microb Technol, 32: 606-615. DOI:10.1016/S0141-0229(03)00018-8 |
Tien M, Kirk T K. 1988. Lignin peroxidase of Phanerochaete chrysosporium. Methods Enzymol, 161: 238-249. DOI:10.1016/0076-6879(88)61025-1 |
Vares T, Lundell T K, Hatakka A. 1993. Production of multiple lignin peroxidases by the white-rot fungus Phlebia ochraceofulva. Enzyme Microb Technol, 15: 664-669. DOI:10.1016/0141-0229(93)90066-B |
Verdin A, Sahraoui A L H, Durand R. 2004. Degradation of benzopyrene by mitosporic fungi and extracellular oxidative enzymes. Inter Biodeterior Biodegr, 53: 65-70. DOI:10.1016/j.ibiod.2003.12.001 |
Wong Y, Yu J. 1999. Laccase-catalysed decolorization of synthetic dyes. Water Res, 33: 3512-3520. DOI:10.1016/S0043-1354(99)00066-4 |
 2006, Vol. 42
2006, Vol. 42

