文章信息
- 彭勇, 彭福田, 姜远茂, 周鹏, 张青.
- Peng Yong, Peng Futian, Jiang Yuanmao, Zhou Peng, Zhang Qing.
- 冬枣硝酸还原酶特性研究
- Study on Nitrate Reductase of Winter Jujube(Ziziphus jujuba var. inermis)
- 林业科学, 2006, 42(11): 52-57.
- Scientia Silvae Sinicae, 2006, 42(11): 52-57.
-
文章历史
- 收稿日期:2005-12-02
-
作者相关文章
硝酸还原酶(nitrate reductase, NR)是植物氮代谢的限速酶, 可催化NO3-还原为NO2-, 在调节植物吸收利用NO3-及维持体内多种代谢平衡中起着极为重要的作用(Nigel et al., 1992; 刘丽等, 2004)。研究表明: NO3-的同化部位与植物种类有关。李宪利等(1997)在苹果上、金松南等(2005)在梨树上、Bussi等(1997)在桃树上的研究均表明根系中具有较高的NR活性, 是同化NO3-的主要器官。但对于枣属(Ziziphus)的果树而言, 这种器官间的差异还未见报道。同时, NR又是一种诱导酶, 受NO3-的诱导, NR活性(NRA)在一定范围内与其底物浓度呈正相关(金松南等, 2005; 许长蔼, 1991), NR活性受光、温度、pH等各种因子的调节, 随器官及植物发育状况的变化而变化(Druart et al., 2000; Kaiser et al., 2001; 陆嘉陵等, 1983)。
沾化冬枣是我国特有的果树资源, 果实中维生素C含量丰富、营养价值极高, 并且该树种具有抗盐碱、耐瘠薄的特性, 是山东滨州盐碱地区的主要经济林树种之一, 近年来栽培面积迅速扩大。然而, 有关冬枣基础理论的研究严重滞后于生产, 其氮素的同化特性, 尤其是NO3-同化的关键酶NR特性报道不多。本试验主要对冬枣植株不同器官不同时期NR活性的变化动态以及不同形态氮素对其活性的影响进行研究, 以增加对冬枣氮素同化过程的认识, 为生产上科学施肥提供理论依据。
1 材料与方法 1.1 试材与处理试验在山东农业大学校内果树标本园进行。试材为2年生盆栽沾化冬枣(Ziziphus jujuba var. inermis), 砧木为金丝小枣。试验于2005年生长季5—10月份选晴天进行, 试验树30株, 树体生长良好, 土壤条件为:有机质含量9.5 g·kg-1, 硝态氮60.15 mg·kg-1, 碱解氮57.75 mg·kg-1, 速效磷42.80 mg·kg-1, 速效钾60.02 mg·kg-1。
不同部位NRA和NO3--N含量的确定。选取5株挂牌处理, 选晴朗的天气, 于花期和果实成熟期分两次采样测定, 采样时间为9 : 00左右, 采样部位为根系和叶片, 根分粗根(2~4 mm)、细根(< 2 mm)和新生吸收根; 叶片分枣吊基部叶、中部叶和幼叶。
NR活性日变化在2005年8月份进行。选取3株生长势一致的树体, 从7 : 00起每隔2 h采样1次, 采样部位为枣吊中部叶片。连续测定3天取平均值。季节变化的确定选取10株挂牌, 从2005年5月至10月, 每隔半月取样1次, 取样部位为枣吊中部叶片和细根。
不同形态氮素处理。选取3株, 以同一株树不同枝条作处理, 用毛刷涂抹枣吊叶片反正两面, 以清水作对照, 混合取样。这样选取的目的是为了减少试验误差, 因为植株树势之间的差异远高于同一株树的枝条诱导后取样时间的确定用40 mmol·L-1KNO3于9 : 00进行涂抹, 清水对照, 于涂抹后0、1、2、4、6、8、10 h取样。KNO3诱导处理设0、5、20、40、80、160、480 mmol·L-1等7个浓度梯度, 涂抹后4 h取样。不同形态氮素处理以根外追施0.3 %的尿素所含纯氮量配置其它几种形态的氮素。
田间条件下追施尿素试验于2005年6—7月在泰安市省庄镇山东农业大学冬枣试验园进行, 试验园土壤状况:有机质9.5 g·kg-1, 全氮91.05 mg·kg-1, 硝态氮50.14 mg·kg-1, 碱解氮67.48 mg·kg-1, 速效磷30.28 mg·kg-1, 速效钾45.42 mg·kg-1。5年生冬枣, 株行距3 m×4 m, 树体生长势一致。试验设对照(不施肥)、低氮(100 g·株-1)、中氮(200 g·株-1)、高氮(400 g·株-1) 4个处理, 每个处理随机选取5株, 于座果稳定后6月底放射沟施尿素, 施肥后每周取样1次, 取样部位为多年生枣吊中部成熟叶片。
1.2 测定方法样品以冰壶取回后, 均先用自来水冲洗, 后用蒸馏水冲洗, 洗净擦干, 一部分剪碎混匀立即测定NR活性, 其余叶片放入-20 ℃冰箱备用测定NO3-含量。试验混合取样3次重复测定并做方差分析。
NR活性测定采用活体法, 反应液成分为0.1 mol·L-1磷酸缓冲液(pH=7.5)和1 %异丙醇, 反复抽气后置于30 ℃黑暗保温30 min, 璜胺显色540 nm测定光密度, 酶活性单位以μg NO2--N·g-1FW h-1表示。NO3--N采用水杨酸比色法, 沸水浴提取30 min后, 加入5 %水杨酸-硫酸溶液和8 %NaOH反应, 410 nm测定光密度, 单位以mgNO3--N·g-1FW表示。方法参照植物生理学实验指导(赵世杰等, 1998)。
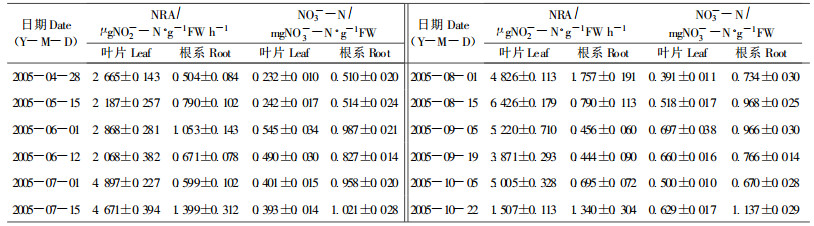
2 结果与分析 2.1 不同部位NR活性的差异比较由图 1可见:不同月份叶片中NR活性均高于根系, 以幼叶中最高, 其次为中部叶和基部叶, 这与金松南等(2005)在梨树上的研究表明新生叶片中NR活性较高一致。而根系中NR活性较小, 以细的网根中较高, 新生吸收根中最低, 几乎检测不出。9月份取样叶片NR活性稍高于6月份, 幼叶中可达5.220 μg NO2--N·g-1 FW h-1, 是细根的10倍左右。通过对NO3-的分析表明, 不同部位NO3--N含量以新生吸收根中最高, 可达0.965 mg NO3--N·g-1FW, 其次为细根和粗根, 而叶片中含量均低于根系, 其中幼叶中含量最低, 9月份取样幼叶中NO3--N含量仅是新生吸收根中的39.43 %, 细根中的49.44 %。表明叶片是冬枣硝酸盐还原的主要部位, 以新生叶片中最为活跃, 而根系中由于NR活性较低, 从而造成了NO3-含量的大量累积。
|
图 1 NRA and NO3--N在各器官中的分布 Fig. 1 Distribution of NRA and NO3--N in different organs |
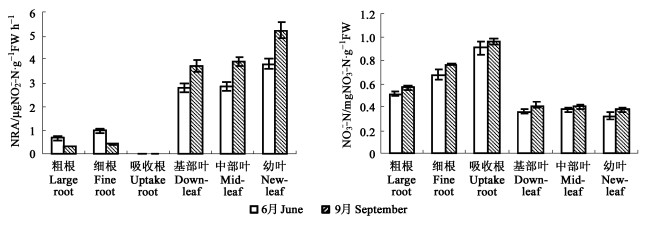
由图 2可见: NR活性的日变化呈先增加后降低的趋势, 从早上7 : 00开始, NR活性逐渐增加, 在11 : 00左右达到最高, 为4.145 μg NO2--N·g-1FW h-1, 比7 : 00提高了76.07 %, 而后NR活性开始下降, 至19 : 00, NR活性基本恢复到早上的水平, 这与Sun等(2004)在喜树上的研究表明NR活性日变化呈单峰曲线是一致的。NO3-含量在一天内的变化基本呈下降趋势, 以7 : 00含量最高, 19 : 00含量最低, 但变幅不大, 7 : 00、11 : 00和19 : 00的NO3-含量分别为0.520、0.490和0.383 mgNO3--N·g-1FW。NO3-含量这种日变化可能由于白天NR活性较高, 同化NO3-能力较强所造成的。
|
图 2 叶片NRA与NO3--N的日变化 Fig. 2 Diurnal changes of NRA and NO3--N in leaves |
由表 1可见, 叶片NR活性季节变化表现为先增加后降低的趋势, 以夏季8月中旬NR活性最高。在春季(4—6月), 叶片NR活性较低, NO3-有在叶片中积累的趋势, 这是因为此期正值萌芽和开花期, 为了满足叶片树体营养生长和花器官的发育, 必然需要从外界大量吸收氮素营养, 但由于春天气温较低, 光照强度弱, NR未达到最大活性, 从而造成了NO3-的累积。至夏季(7—8月中旬), 气温升高, 光照增强, NR活性达最大, 此期NO3-含量趋于稳定。至9月份, 天气转凉, 果实采收后叶片开始衰老, NR活性有下降的趋势, NO3-又在叶片中开始累积。可见NR活性和NO3-含量与冬枣的生长发育存在相关性, 叶片NR活性的季节变化受外界环境因子影响较大。对于根系, NR活性和NO3-含量的季节变化均表现为在花期(6月初)、果实速长期(7—8月)和采后(10月)出现3次高峰, 其中NR活性以8月初最高, 为1.757μg NO2--N·g-1FW h-1, 通过采样时的观察, 此三个时期正是根系大量发生的时期, 根系活力高, 可见, 根系中NR活性和NO3-含量均与根系的发生和生长存在相关性, 顾曼如等(1981)在苹果上的研究也表明根系NO3-含量在一年中的动态变化与根系的大量发生和生长密切相关。
|
|
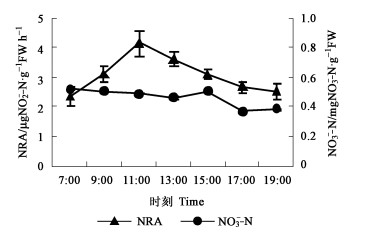
由图 3可见:涂抹40 mmol·L-1浓度的KNO3后, 随着时间的推移, NR活性开始上升, 至涂抹后4 h达到最高峰, 为6.748 μg NO2--N·g-1FW h-1, 比处理前提高了76.5 %, 而此时对照仅比处理前提高了15.3 %。涂抹后6 h, NR活性开始明显下降。这表明NR活性的诱导需要一定的时间间隔, 并且最好的采样时间出现在涂抹KNO3后的4~6 h。不同浓度KNO3处理, NR活性随着NO3-浓度的提高呈逐渐增加的趋势, 当外源KNO3浓度达80 mmol·L-1时, NRA达到15.392 μg NO2--N·g-1FW h-1, 为对照的2.57倍, 此后再增加KNO3浓度, NR活性变化幅度较小甚至略有下降; 通过对NO3-含量的分析表明, NO3-含量随着涂抹浓度的增加一直增加, 80 mmol·L-1时NO3-含量达0.837 mgNO3--N·g-1FW, 比对照提高了48.09 %, 而涂抹浓度大于80 mmol·L-1, 体内NO3-含量仍呈线形增加。可见在高浓度的NO3-诱导之下, 体内NO3-含量与NR活性并不一致, 外源NO3-浓度达80 mmol·L-1时NR活性已处于稳定状态。
|
图 3 KNO3对叶片NRA和NO3--N含量的影响 Fig. 3 Effects of KNO3 on NRA and NO3--N in leaves |
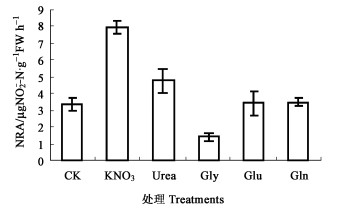
由图 4可见:不同形态氮素对NR活性的影响不同, 以NO3-对NR活性的影响效应最大, 达7.978 μg NO2--N·g-1FW h-1, 是对照的2.38倍, 其次为尿素, 比对照提高了42.0 %, 而Gln、Glu和Gly处理分别是对照的105.11 %、103.24 %和43.81 %, 可见涂抹Gln和Glu对叶片NR活性影响不大, 而Gly对NR活性可能产生了反馈抑制。
|
图 4 不同形态氮素对叶片NRA的影响 Fig. 4 Effects of nitrogen form on NRA in leaves |
由表 2可见, 各处理NR活性在不同时期取样均高于对照, 但各处理之间NR活性差异(0.05水平)并不显著。从不同取样时期看, 对照在试验阶段随着时间的延长NR活性降低, 在施肥后21天降至最低点, NR活性仅为施肥前的46.3 %, 而此时各处理NR活性仍较高, 分别为施肥前的77.0 %、110.4 %和91.7 %, 并且200 g和400 g处理NR活性在后期(施肥14 d后)增幅明显, 表明高氮处理肥力持续时间较长, 在后期对NR活性影响较大。总体来看, 施肥可以维持叶片较高的NR活性, 增加叶片对NO3-的同化能力。
|
|
众多研究表明: NO3-同化部位与植物种类有关, 许多作物多以叶片同化NO3-(Lillo et al., 2003; 余让才等, 2001; Black et al., 2002), 而在果树上, 尤其是北方落叶果树类, 如苹果(李宪利等, 1997)、梨(金松南等, 2005)、桃(Bussi et al., 1997)等多以根系同化NO3-, 根系中NR活性较高。但本试验发现, 冬枣根系中NR活性较低, 叶片是NO3-同化的主要器官, 尤其以新生叶片NR活性最高, 而新生吸收根中几乎检测不到NR活性。从不同器官NO3-的分布来看, 新生吸收根中NO3-含量最高, 幼叶中最低, NO3-含量和NR活性在地下与地上部的分配呈一定负相关。这与程国利(1996)在葡萄上的研究NR活性与叶片和叶柄中NO3-离子浓度呈负相关是一致的。可见冬枣吸收NO3-后, 除了少部分在根系中被NR还原外, 大部分向叶片转移, 在叶片中利用光合提供的能量、还原力和碳架, 同化NO3-, 这与其他落叶果树的氮素同化特性不同, 可能是由于树种不同的缘故。
NR活性的日变化和季节变化趋势因不同的物种和外界环境条件而有差异。本试验对冬枣叶片NR活性日变化表明, NR活性呈单峰曲线, 峰值出现在11 : 00左右, 并且7 : 00和19 : 00 NR活性水平相当。这与Sun等(2004)在喜树幼苗上及Druart等(2000)在菊苣上的研究叶片NR活性日变化呈单峰曲线是一致的。对于NR活性日变化的这种趋势, 许多研究表明光是NR活性的重要调节因子, 光可以为NR的合成提供能量和还原力, 促进NR活性的提高(陆嘉陵等, 1983; 余让才等, 2001)。最近Chow等(2004)在红藻上的研究进一步表明NR活性的日变化主要受到光照而不是生物钟的调控。对于NO3-含量日变化, 本试验表明呈下降趋势, 变幅不大, 其下降的主要原因可能是白天NR活性较高造成的。冬枣作为一种多年生的落叶果树, 具有当年分化当年开花、多次分化多次开花特性, 其NR活性和NO3-含量的季节动态变化较为复杂。本试验对NR活性和NO3-的季节变化研究表明:叶片NR活性夏季8月中旬最高, NR活性和NO3-含量均与冬枣生长发育存在一定相关性; 根系NR活性和NO3-含量在花期(6月初)、果实速长期(7—8月)和采后(10月)出现3次高峰, 与根系的发生和生长密切相关, 这与顾曼如等(1981)在苹果根系上的研究是一致的。
NO3-是NR的最适诱导因子, NO3-对NR的诱导作用有一段延迟期, 并且主要在转录水平上进行(许长蔼, 1991)。研究表明NO3-在植物细胞内呈区域化分布, 小部分位于代谢库细胞质中, 而大部分贮藏于液泡内, 只有在细胞质中的NO3-方可参与还原, 即是NR活性提高的主要原因(许长蔼等, 1990)。许长蔼等(1990)在小麦上的研究表明当增加营养液中NO3-的浓度时, 植物体内NO3-的积累量上升, NR活性提高, 但当营养液中NO3-浓度升高到一定程度时, 细胞质中NO3-含量不再增加, 此时NR活性趋于稳定, 继续吸收的NO3-则累积于液泡内。本试验在冬枣上的研究也表明叶片涂抹KNO34 h后NR活性达到高峰, 涂抹后4~6 h是最佳采样分析时期, 低浓度KNO3处理(< 80 mmol·L-1), NR活性和内源NO3-含量均增加, 当KNO3浓度高于80 mmol·L-1时, NO3-含量仍显著增加, 但NR活性不再升高, 这可能是由于过量的NO3-累积于液泡中不能被还原造成的, 表明高浓度NO3-环境下, NR活性的大小是限制NO3-还原的主要因子。在不同形态氮素对NR活性的影响方面, Li等(1995)研究表明Gln在NR的表达中起消极作用, 营养液中加入Gln会降低NRmRNA的积累, 但对叶片影响很小。Muller等(1995)研究表明Gly可反馈抑制NR活性。本试验表明涂抹尿素可以提高叶片NR活性, 涂抹Gln和Glu对叶片NR活性的影响效应不明显, Gly降低了叶片NR活性, 但不同形态氮素对NR活性影响的内在机理仍需进一步研究。
此外, 许多研究表明追施氮肥可以提高叶片和根系的NR活性(冯福生等, 1986; 李宪利等, 1997)。本试验发现追施尿素可以提高叶片NR活性, 维持叶片较高的NR活性, 增加叶片对NO3-的同化能力, 但各处理之间差异不显著, 这可能是由于冬枣作为多年生果树, 树体内贮藏营养对叶片生长发育起重要作用所造成的。总之, 根据冬枣不同部位NR活性的差异和季节变化, 在生产上抓住树体NO3-同化能力较强, 即NR活性较高的时期进行追肥或营养诊断有着重要的实际意义, 同时, 叶片作为冬枣NO3-同化的主要器官, 在特定时期可以根外追肥为主, 及时补充氮素营养的亏缺。但对于冬枣NR活性的转录和翻译后的内在调节机制仍需要今后进行深入研究。
程国利. 1996. 光照对葡萄叶片几个生理指标的影响. 中外葡萄与葡萄酒, (1): 11-13. |
冯福生, 陈文龙, 李洁, 等. 1986. 不同供氮水平下冬小麦叶片中RuBP羧化酶和硝酸还原酶的活性变化. 植物生理学通讯, (6): 20-22. |
顾曼如, 张若抒, 束怀瑞, 等. 1981. 苹果氮素营养研究初报—植株中氮素营养的年周期变化特性. 园艺学报, 8(4): 21-28. |
金松南, 崔东根, 周广芳. 2005. 喷施KNO3对新高梨实生苗硝酸还原酶活性和氮素积累的影响. 果树学报, 22(4): 315-318. |
李宪利, 高东升, 米瑞芙. 1997. 苹果植株硝酸还原酶(NR)研究初报. 山东农业大学学报, 28(1): 1-4. |
刘丽, 甘志军, 王宪泽. 2004. 植物氮代谢硝酸还原酶水平调控机制的研究进展. 西北植物学报, 24(7): 1355-1361. DOI:10.3321/j.issn:1000-4025.2004.07.038 |
陆嘉陵, 何文竹, 陈薇, 等. 1983. 硝酸还原酶研究Ⅱ.6-BA和光对小麦硝酸还原酶诱导的影响. 植物生理学报, 9(1): 41-49. |
许长蔼. 1991. 植物体内NO3-可给性对硝酸还原酶活性的调节. 植物生理学通讯, 27(3): 173-177. |
许长蔼, 倪晋山. 1990. 小麦叶内硝酸还原的代谢库. 植物生理学报, 16(3): 277-283. DOI:10.3321/j.issn:1671-3877.1990.03.010 |
余让才, 范燕萍, 李明启. 2001. 光暗转换对小麦幼苗硝酸还原酶活性的影响. 华南农业大学学报, 22(3): 37-39. DOI:10.3969/j.issn.1001-411X.2001.03.011 |
赵世杰, 刘华山, 董新纯. 1998. 植物生理学实验指导. 北京: 中国农业科技出版社, 43-50.
|
Black B L, Funchigami L H, Coleman G D. 2002. Partitioning of nitrate assimilation among leaves, stems and roots of poplar. Tree Physiology, 22: 717-724. DOI:10.1093/treephys/22.10.717 |
Bussi C, Gojon A, Passama L. 1997. In situ nitrate reductase activity in leaves of adult peach trees. Journal of Horticulture Science, 729: 347-353. |
Chow F, Oliveira M C, Pedersen M. 2004. In vitro assay and light regulation of nitrate reductase in red alga Gracilaria chilensis. Journal of Plant Physiology, 161: 769-776. DOI:10.1016/j.jplph.2004.01.002 |
Crawford N M, Wilkionson J Q, Labrie S T, et al. 1992. Control of nitrate reduction in plants. Journal of Plant Physiology, 19: 377-385. |
Druart N, Goupil P, Dewaele E, et al. 2000. Nitrate assimilation in chicory roots(Cichorium intybus L.) which acquire radial growth. Journal of Experimental Botany, 51: 539-546. DOI:10.1093/jexbot/51.344.539 |
Kaiser W M, Huber S C. 2001. Post-translational regulation of nitrate reductase : mechanism, Physiological relevance and environmental triggers. Journal of Experimental Botany, 52: 1981-1989. DOI:10.1093/jexbot/52.363.1981 |
Lillo C, Lea U S, Leydecker M T, et al. 2003. Mutation of the regulatory phosphorylation site of tobacco nitrate reductase results in constitutive activation of the enzyme in vivo and nitrite accumulation. The Plant Journal, 35: 566-573. DOI:10.1046/j.1365-313X.2003.01828.x |
Li X Z, Larson D E, Glibetic M, et al. 1995. Effect of glutamine on the induction of nitrate reductase. Physiologia Plantarum, 93: 740-744. DOI:10.1111/j.1399-3054.1995.tb05125.x |
Muller B, Tillard P, Touraine B. 1995. Nitrate fluxes in soybcan seedling roots and their response to amino acids: an approach using 15 N. Plant Cell and Environment, 18: 1267-1279. DOI:10.1111/j.1365-3040.1995.tb00186.x |
Oh S D, Jin S N, Lee H J. 2002. Growth, leaf nitrogen contents, and nitrate reductase activity of pear(Pyrus pyrifolia cv. Niitaka) trees as affected by different levels of nitrogen supply. Journal of Korean Society Horticulture Science, 43: 433-438. |
Sun S Q, Yan X F. 2004. Nitrate reductase activity and its diurnal variation rhythm for Camptotheca acuminate seedlings. Journal of Forestry Research, 15(3): 167-170. DOI:10.1007/BF02911018 |
 2006, Vol. 42
2006, Vol. 42