文章信息
- 李辛雷, 陈发棣.
- Li Xinlei, Chen Fadi.
- 菊花二倍体野生种与栽培种间杂种的幼胚拯救
- Embryo Rescue of Interspecific Hybrids between Wild Diploid Dendranthema Species and Dendranthema morifolium
- 林业科学, 2006, 42(11): 42-46.
- Scientia Silvae Sinicae, 2006, 42(11): 42-46.
-
文章历史
- 收稿日期:2005-01-19
-
作者相关文章
我国是栽培菊花(Dendranthema morifolium)的起源中心和菊属(Dendranthema)种质资源的分布中心, 菊属有40多个种, 在我国分布的有20余种, 栽培菊花品种达3 000多个。菊花近缘种属植物中具有许多栽培菊花所缺乏的优良性状, 将其导入栽培菊花进行菊花种质创新和品种改良是菊花育种的一条重要途径。菊属植物远缘杂交在相同倍性物种之间及四倍体与六倍体之间均较容易, 而倍性差异较大的二倍体与四倍体、六倍体间杂交均难以实现(戴思兰等, 1996)。我国分布的特有菊属植物大多数为二倍体, 用常规杂交手段很难将这些物种中的优良基因导入栽培菊花(一般为六倍体及其非整倍体)。利用幼胚拯救技术可以克服菊属种间杂交障碍, 获得远缘杂种。由于菊花的幼胚较小, 不易取出, 而利用子房培养则相对简单, 且不会伤害到幼小的胚, 因此, 在菊花幼胚拯救中常用子房培养(Watanabe, 1977; 李辛雷等, 2004a)。关于菊属植物远缘杂种幼胚拯救的各种影响因素及适宜条件的研究, 尚未见详细报道。本试验以原产中国的二倍体野生种与栽培菊花为材料, 建立了菊属植物幼胚拯救体系, 并对获得幼苗进行了RAPD早期鉴定及形态学鉴定, 以期为扩大菊属种质资源库, 培育新品种奠定良好基础。
1 材料与方法 1.1 材料二倍体野生种甘菊(D.lavandulifolium)、菊花脑(D.nankingense)、异色菊(D. dichrum)及5个栽培菊花(D.morifolium)品种'紫勋章' ('Zixunzhang')、'紫玉芙蓉' ('Ziyufurong')、'落霞' ('Luoxia')、'黄英' ('Huangying')、'滁菊' ('Chuju'), 所有材料均由南京农业大学菊花种质资源保存中心提供。
1.2 方法 1.2.1 远缘杂交试验于2002年9月—2004年4月进行。配置不同二倍体野生种与栽培菊花杂交组合, 母本均进行人工去雄并套袋隔离, 父本在舌状花微开时套袋, 于9:00—10:00或15:00—16:00授粉, 同一花序重复授粉2次。
1.2.2 子房培养接种时取授粉后不同时期(days after pollination, DAP)的头状花序, 用镊子剥取边缘舌状花的子房, 以75 %酒精表面消毒30 s后置于0.1 %的升汞溶液中灭菌5 min, 无菌水冲洗4~5次后用接种针将子房接入不同激素配比的培养基(表 1)。培养基中加入蔗糖30 g·L-1, 琼脂粉6 g·L-1。子房膨大后产生愈伤组织或子房直接萌发产生幼苗, 转入继代培养, 以后每月继代1次, 继代培养基为MS+BA 1.0 mg·L-1+NAA 0.1 mg·L-1。将愈伤分化及子房直接萌发所得幼苗转入MS+BA 0.2 mg·L-1的培养基中扩繁, 待无根苗长到3~4 cm时转入MS+NAA 0.1 mg·L-1培养基中生根, 炼苗后定植于田间。培养温度20~25 ℃, 每日光照10~12 h, 光照度1 600~2 000 lx。
|
|
出愈率(Ⅰ)=总愈伤组织块数(包括子房直接萌发)接种子房数×100 %; 成苗率(Ⅱ)=所得幼苗数接种子房数×100 %。
1.2.3 杂种鉴定RAPD鉴定:取杂交亲本及其后代不同单株上新鲜嫩叶用液氮混合磨样, 样品DNA提取、RAPD反应体系及条件按李辛雷等(2004b)的方法。随机引物、dNTP、Taq DNA聚合酶、琼脂糖(进口Spanish分装)均购自南京生通生物技术有限责任公司。
形态学鉴定:对子房培养所得植株及其亲本的株高、冠幅、花序直径及茎色、花色、叶裂的深浅、托叶有无等性状进行观察和统计。性状登记均按李鸿渐等(1993)标准进行, 花色以英国皇家园艺学会的色谱为标准(Colour chart, the Royal Hort. Culture Society, London)。依据杂交父母本及其后代的表现型对所得植株进行检测、鉴定。
2 结果与分析 2.1 基因型及激素配比对子房培养的影响4个杂交组合的子房在授粉后10~11 d时分别接种在4种激素配比的MS培养基上(表 1), 结果发现:以异色菊为母本分别与栽培菊花'紫玉芙蓉'、'落霞'杂交后进行子房培养时, 前者的最高出愈率为50.0 %, 最高成苗率3.7 %; 后者在各种培养基中的出愈率均低于前者, 且A、B培养基中均没有得到愈伤组织, 最高成苗率2.1 %; 前者平均出愈率、成苗率分别是后者的1.9倍和1.8倍。分别以'紫勋章'、'紫玉芙蓉'为母本与异色菊杂交后进行子房培养时, 前者最高出愈率58.8 %, 最高成苗率4.7 %; 后者最高出愈率22.2 %, 除B培养基外, 各种培养基的出愈率均低于前者, 最高成苗率1.9 %; 前者平均出愈率、成苗率分别是后者的3.3倍和2.4倍。可见基因型不同的杂交组合, 其子房培养的出愈率与成苗率均存在较大差异。
4个杂交组合的子房在4种不同的激素配比的MS培养基上培养时, 除'紫勋章'×异色菊组合在A培养基中出愈率最高外, 其余组合均在D培养基中出愈率最高; 除异色菊×'紫玉芙蓉'仅在B培养基中得到幼苗, 其余组合仅在D培养基上得到幼苗; D培养基平均出愈率及平均成苗率均最高, 分别为42.0 %和2.2 %; A、C培养基出愈率亦较高(18.6 %、31.4 %), 但没有得到幼苗; B培养基出愈率最低(6.2 %), 成苗率0.9 %。可见D培养基MS+BA 2.0 mg·L-1+NAA 2.0 mg·L-1有利于提高出愈率与成苗率, 培养效果最好。
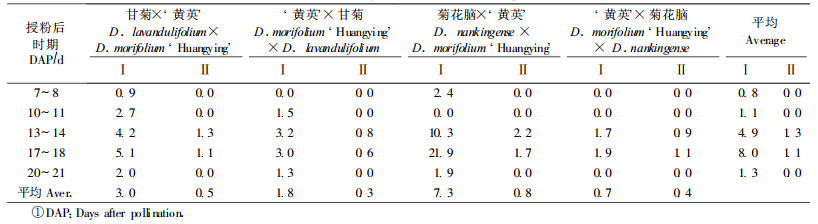
2.2 杂交方式及授粉后不同接种时期对子房培养的影响4个杂交组合在授粉后不同时期接种时子房培养的出愈率、成苗率见表 2。从表 2发现4个杂交组合的子房在授粉后7~8 d、10~11 d接种时, 平均出愈率分别为0.8 %、1.1 %, 出愈率最高仅为2.7 %, 部分组合没有得到愈伤组织; 所有组合均没有得到幼苗。授粉后13~14 d、17~18 d接种时, 所有组合均产生愈伤组织并得到幼苗, 其平均出愈率分别为4.9 %、8.0 %, 出愈率最高达21.9 %; 平均成苗率分别为1.3 %、1.1 %, 成苗率最高达2.2 %, 最低为0.6 %。授粉后20~21 d的子房接种时, 4个杂交组合的平均出愈率仅为1.3 %, 出愈率最高为2.0 %; 所有组合均没有得到幼苗。可见授粉后13~14 d、17~18 d进行子房培养时, 出愈率、成苗率均达到最高, 所有杂交组合均得到幼苗, 而其他时期出愈率较低且没有得到幼苗, 说明授粉后13~18 d应为子房培养的最佳时期。
|
|
甘菊×'黄英'组合子房培养的平均出愈率、成苗率分别为3.0 %、0.5 %, 而反交组合两者分别为1.8 %和0.3 %, 正交组合子房培养的平均出愈率和成苗率为反交的1.7倍; 菊花脑×'黄英'组合子房培养的平均出愈率、成苗率分别为7.3 %、0.8 %, 而反交组合两者分别为0.7 %和0.4 %, 正交组合子房培养的平均出愈率、成苗率分别为反交的10.4和2.0倍。可见不同杂交方式影响子房培养结果, 二倍体野生种作母本与栽培菊花杂交时, 子房培养的出愈率、成苗率均明显高于反交。
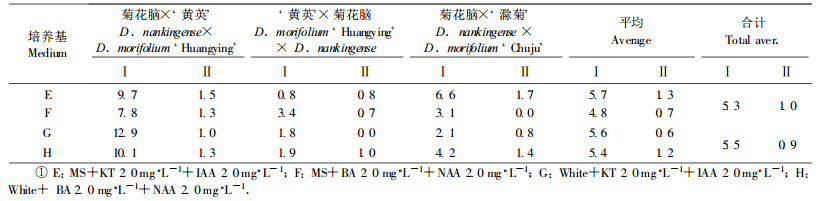
2.3 基本培养基对子房培养的影响3个杂交组合的子房在授粉后15~16 d时分别接种在添加KT 2.0 mg·L-1+IAA 2.0 mg·L-1、BA 2.0 mg·L-1+NAA 2.0 mg·L-1的MS和White培养基上(表 3), 结果发现: MS、White培养基中平均出愈率分别为5.3 %、5.5 %, 平均成苗率分别为1.0 %、0.9 %, 无明显差异。
|
|
当KT 2.0 mg·L-1+IAA 2.0 mg·L-1加入MS和White培养基中时, 其平均成苗率分别为1.3 %、0.6 %, 前者为后者的2.2倍; 当BA 2.0 mg·L-1+NAA 2.0 mg·L-1加入MS、White培养基中时, 其平均成苗率分别0.7 %、1.2 %, 后者为前者的1.7倍。
当MS培养基中添加KT 2.0 mg·L-1+IAA 2.0 mg·L-1和BA 2.0 mg·L-1+NAA 2.0 mg·L-1时, 平均成苗率分别为1.3 %和0.7 %, 前者是后者的1.9倍; 而White培养基中添加KT 2.0 mg·L-1+IAA 2.0 mg·L-1和BA 2.0 mg·L-1+NAA 2.0 mg·L-1时, 平均成苗率分别为0.6 %和1.2 %, 后者为前者的2.0倍。
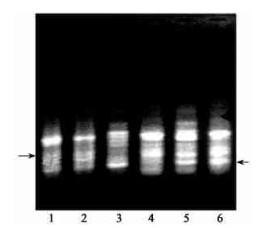
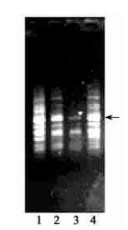
2.4 杂种RAPD鉴定对子房培养所得植株及其亲本进行RAPD鉴定, 可以明显看出杂种与亲本之间的差异(图 1, 图 2, 图 3)。由于RAPD标记是显性标记, 对杂种鉴定可以根据有无父本的特征带来鉴定其是否杂交成功(刘焕芳等, 2004)。引物B-02对菊花脑×'黄英'组合后代及其亲本的重复扩增结果见图 1, 3、4、5号植株均表现父本特异带(箭头所指), 据此判断其为真杂种。引物B-04对'黄英'与甘菊正反交后代植株的RAPD鉴定均扩增出父本特异带, 说明其全部为杂种(图 2); 同时用引物S-03亦鉴定出甘菊×'黄英'组合后代植株为杂种(图 3)。

|
图 1 菊花脑×'黄英'杂交后代RAPD分析(引物B-02) Fig. 1 RAPD analysis of D. nankingense × D. morifolium 'Huangying' and their F1 offsprings (Primer B-02) 1.菊花脑D. nankingense; 2. '黄英' D. morifolium 'Huangying'; 3~ 5.杂交后代F1 offsprings. |
|
图 2 '黄英'与甘菊正反交后代RAPD分析(引物B-04) Fig. 2 RAPD analysis of D. morifolium 'Huangying', D. lavandulifolium and their F1 offsprings(Primer B-04) 1~ 2.'黄英' ×甘菊后代F1 offsprings of D. morifolium 'Huangying' × D. lavandulifolium; 3.'黄英' D. morifolium 'Huangying'; 4.甘菊D. lavandulifolium; 5~6.甘菊×'黄英'后代F1 offsprings of D. lavandulifolium ×D. morifolium 'Huangying'. |
|
图 3 甘菊×'黄英'杂交后代RAPD分析(引物S-03) Fig. 3 RAPD analysis of D. lavandulifolium ×D. morifolium 'Huangying' and their F1 offsprings(Primer S-03) 1~ 2.甘菊×'黄英'后代F1 offsprings; 3.甘菊D. lavandulifolium; 4. '黄英' D. morifolium 'Huangying'. |
对亲本及其后代的观察发现, 杂种F1代的株高、冠幅、花序直径等数量性状大多介于双亲之间; 杂交后代具备的某些父本特异性状或父母本不具备的新性状, 亦可以作为判定杂种的有效证据, 如茎的颜色、花色、叶裂、托叶有无等。部分杂种的特异性状鉴定见表 4, 根据表 4可以得出4个结论, 证实了杂种的真实性: 1)栽培菊花茎的紫色转移到所有二倍体野生种与栽培菊花的杂种中; 2)所有以栽培菊花为母本的杂种叶深裂; 3)杂种花色更相似于栽培菊花; 4)一些杂种表现亲本不具备的新性状, 如花色、叶裂等。
|
|
不同的遗传机制及生殖器官结构上的差异, 导致不同基因型亲本的杂交组合幼胚拯救的成功率差异较大, Rangan(1984)认为植物的基因型很大程度上影响幼胚拯救的成功率, 即使在亲缘关系较近的栽培品种上差异亦较大。栽培菊花为异源多倍体, 具复杂的遗传基础(陈发棣等, 1998), 不同栽培菊花品种基因型不同, 与二倍体野生种杂交后子房培养的出愈率与成苗率均存在较大差异, 这与Rangan(1984)研究结果一致。
菊花中胚的形态发育在8~11 d达到球形胚(Drewlow et al., 1975), 球形胚之后是心形胚、鱼雷形胚, 最后子叶形成, 心形胚出现后是进行胚拯救的适宜时期(Anderson et al., 1990)。Watanabe(1977)用二倍体野生种与多倍体杂交授粉后9~13 d的子房进行培养时, 发现少量子房仅发育出根却未能分化芽, 在获得杂种苗中, 部分幼苗出现白化现象或移栽后死亡。本试验用杂交授粉后13~18 d的子房进行培养时, 亦发现部分子房产生愈伤组织后只生根却不能分化的现象, 但在得到杂种幼苗中, 未出现白化现象, 所有幼苗移栽后均成活, 说明其白化现象或幼苗移栽后死亡可能主要由于子房的早熟萌发。
不同杂交方式影响幼胚拯救的成功率, Buitendijk等(1995)在进行六出花属(Alstroemeria)种间杂交幼胚拯救时发现:二倍体与四倍体种正反交幼胚拯救的结果存在较大差异。菊属二倍体野生种作母本与多倍体栽培菊花杂交时子房培养效果好于反交, 可能主要由于花器官差异(Raghavan et al., 1982)。本试验中所有杂交组合子房培养均获得成功, Watanabe(1977)用八倍体及十倍体的非整倍体菊花为母本与菊属二倍体野生种Chrysanthemum boreale杂交, 子房培养均失败, 没有得到幼苗, 可能由于其倍性较高, 亲缘关系较远, 缺少同源性遗传信息。
培养基提供幼胚生长发育所需的碳源和营养物质, 激素主要作用是调节渗透压(Raghavan et al., 1982)。培养基中添加KT 2.0 mg·L-1+IAA 2.0 mg·L-1和BA 2.0 mg·L-1+NAA 2.0 mg·L-1时子房培养的成功率较高, 可能是由于较高的激素浓度有利于提供幼胚发育所需的渗透压; 不同基本培养基对子房培养没有明显差异, 但不同培养基添加不同配比的激素时, 培养结果差异较大。基本培养基与激素是否存在互作, 有待于进一步研究。
陈发棣, 陈佩度, 房伟民, 等. 1998. 栽培小菊与野生菊间杂交一代的细胞遗传学研究. 园艺学报, 25(3): 308-309. DOI:10.3321/j.issn:0513-353X.1998.03.022 |
戴思兰, 陈俊愉. 1996. 菊属7个种的人工种间杂交试验. 北京林业大学学报, 18(4): 16-22. DOI:10.3321/j.issn:1000-1522.1996.04.003 |
李鸿渐, 邵建文. 1993. 中国菊花. 南京: 江苏科学技术出版社.
|
李辛雷, 陈发棣. 2004a. 菊属种间杂交胚拯救过程成苗途径的初步研究. 植物学通报, 21(3): 337-341. |
李辛雷, 陈发棣. 2004b. 栽培小菊、野生菊及菊属种间杂种的RAPD分析. 南京农业大学学报, 27(3): 29-33. |
刘焕芳, 陈学森, 段成国, 等. 2004. 甜樱桃与中国樱桃杂种的胚抢救及杂种鉴定. 园艺学报, 31(3): 303-308. DOI:10.3321/j.issn:0513-353X.2004.03.004 |
Anderson N O, Ascher P D, Widmer R E, et al. 1990. Rapid generation cycling of Chrysanthemum using laboratory seed development and embryo rescue techniques. J Amer Soc Hort Sci, 115(2): 329-336. DOI:10.21273/JASHS.115.2.329 |
Buitendijk J H, Pinsonneaux N, Van Donk A C, et al. 1995. Embryo rescue by half-ovule culture for production of interspecific hybrids in Alstroemeria. Scientia Horticulturae, 64: 65-75. DOI:10.1016/0304-4238(95)00827-2 |
Drewlow L W, Ascher P D, Widmer R E. 1975. Rapid method of determining pollen incompatibility in Chrysanthemum morifolium Ramat. Euphytica, 24: 29-32. DOI:10.1007/BF00147165 |
Raghavan V, Srivastava P S.1982.Embryo culture∥Johri B M.Experimental embryology of vascular plants. Academic New York, 195-230
|
Rangan T S.1984.Culture of ovule∥Vasil I K. Cell culture and somatic cell genetics of plants: Vol.1 Laboratory procedures and their applications. Academic New York, 227-31
|
Watanabe K. 1977. Successful ovary culture and production of F1 hybrids and androgenic haploids in Japanese Chrysanthemum species. The Journal of Heredity, 68: 317-320. DOI:10.1093/oxfordjournals.jhered.a108844 |
 2006, Vol. 42
2006, Vol. 42