文章信息
- 王满囷, 张志春, 李娟, 王楠, 薛东, 张国安, 李周直.
- Wang Manqun, Zhang Zhichun, Li Juan, Wang Nan, Xue Dong, Zhang Guoan, Li Zhouzhi.
- 鞭角华扁叶蜂体内多胺的动态
- Changes of Polyamines of Chinolyda flagellicornis
- 林业科学, 2006, 42(10): 80-84.
- Scientia Silvae Sinicae, 2006, 42(10): 80-84.
-
文章历史
- 收稿日期:2004-11-19
-
作者相关文章
2. 南京林业大学 南京 210037
2. Nanjing Forestry University Nanjing 210037
多胺(polyamines)如腐胺(putrescine, Put)、亚精胺(spermidine, Spd)、尸胺(cadaverine, Cad)及精胺(spermine, Spm)是一类带正电荷的小分子脂肪族化合物, 广泛存在于原核和真核细胞内。1948年Herbs首先在细菌中发现多胺的存在, 其后Ham和Berrossi分别于1964、1965年发现多胺在动植物细胞增殖中有重要作用(Tabor et al., 1984)。近年来对多胺生物学功能的研究较多, 尽管这些胺类的生理功能至今仍未完全清楚, 但已有研究表明:多胺是细胞维持正常生长所必需的, 快速增长细胞的多胺浓度比静止细胞显著增高; 多胺影响DNA、RNA以及蛋白质的生物合成(Frydman et al., 1992; Thomas et al., 1993; Matthews, 1993), 直接或间接参与细胞的分化(Ludquist et al., 1983; Sjoholm, 1993), 并能特异抑制多胺的生物合成及组织的生长(冯立新等, 1996; 1998)。多胺及其合成酶存在于昆虫体内, 可与JH和MH相互作用, 参与昆虫卵黄发生、胚胎发育、变态、行为等生理调节过程, 对昆虫具有多效性的生理功能(Sparks et al., 1991; Strambi et al., 1993; Caryre et al., 1995, 1996, 1997; Kogan et al., 1985; 2000)。由于昆虫体内多胺代谢的复杂性, 多胺对昆虫生理的调节机理尚不十分清楚。
鞭角华扁叶蜂(Chinolyda flagellicornis)是柏木(Cupressus funebris)、柳杉(Cryptomeria fortunei)的重要害虫, 属于一化性昆虫, 以滞育预蛹在土中越夏越冬长达300 d左右(崔相富等, 1992)。滞育是昆虫长期适应自然不良环境而获得的一种时间对策。因此, 昆虫滞育的诱导、维持、终止和滞育后的发育总是与生境的有利与否"并发配合", 如果通过人为的诱导或解除干扰昆虫与生境间的"并发配合", 则可达到消灭害虫和利用益虫的目的(王满囷等, 2004)。但由于昆虫生理过程的复杂性, 昆虫滞育的分子机理仍不完全清楚。具有多种生理功能的多胺是否也可以参与调节昆虫滞育?为了进一步探讨多胺在昆虫体内的生理功能及对昆虫滞育的影响, 本文测定了鞭角华扁叶蜂不同发育时期多胺的种类和含量。
1 材料与方法 1.1 试验昆虫鞭角华扁叶蜂幼虫在自然条件下, 以水培柏木当年生枝叶饲养。龄期以幼虫蜕皮次数来记数, 本试验确定5龄晚期幼虫头壳从前胸背板上脱落起计为6龄0 h。
1.2 血淋巴的收集6龄幼虫0 h开始, 每隔12 h收集1次血淋巴, 预蛹期以入土为起点, 每隔1个月收集1次血淋巴和头。
1.3 多胺样品的制备血淋巴直接加入冷冻的5%高氯酸溶液涡旋, 于冰浴中放置1 h(期间摇动几次)后, 在26 000 g离心力的冷冻离心机中离心15 min, 取上清液即可用于测定游离和结合态的多胺。以腐胺(Put)、亚精胺(Spd)、精胺(Spm)、和尸胺(Cad)(Sigma公司产品, 南京林业大学沈惠娟教授惠赠)为标准液。
1.4 多胺的测定取多胺提取液和多胺标准液各200 μL, 加400 μL二甲基氨基萘磺酰氯(每毫升丙酮溶解5 mg二甲基氨基萘磺酰氯, 现配现用), 再加200 μL饱和碳酸钠, 充分均匀后, 于黑暗、室温下放置过夜, 然后加入100 μL脯氨酸(每毫升蒸馏水溶解100 μg), 充分摇匀后, 在室温下反应30 min, 以除去多余的二甲基氨基萘磺酰氯。再加0.5 mL苯搅拌30 s(分2次), 以萃取二甲基氨基萘磺酰氯多胺化合物, 并用硅胶薄层层析板展开(展开剂为氯仿:三乙胺=100:20 V/V)。在紫外灯下对照标准多胺, 用铅笔标记出被分离的多胺部位, 刮下后溶于2.5 mL乙酸乙酯溶剂中, 用荧光分光光度计(HITACHI 850), 在激活波长为350 nm、荧光波长为495 nm下测定多胺的量。
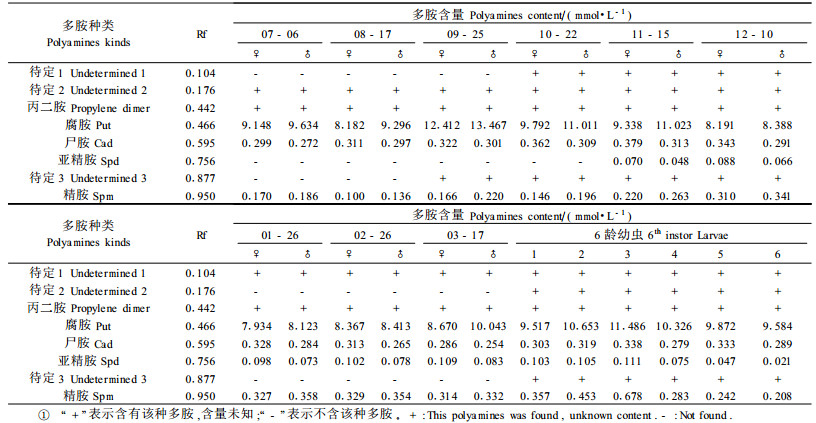
2 结果与分析 2.1 多胺的种类鞭角华扁叶蜂预蛹不同发育时期多胺种类和含量的测定结果见表 1。
|
|
从表 1可以看出:鞭角华扁叶蜂预蛹血淋巴内可分离到多胺的主要谱带8条。同一发育期雌、雄预蛹血淋巴的谱带完全相同, 但多胺的含量有所差异。而在不同的发育时期, 预蛹血淋巴的谱带有所不同, 即不同时期血淋巴中多胺的种类和含量有所不同。在6龄幼虫的整个发育过程中, 幼虫的谱带完全相同, 整个龄期8种多胺都始终存在。
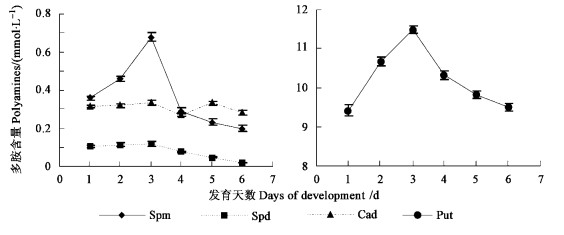
2.2 末龄幼虫血淋巴中多胺含量动态末龄幼虫血淋巴中4种多胺的含量动态如图 1。从图 1中可以看出:在整个6龄期, Spm和Put均有一个明显的峰值。6龄初期Spm和Put的含量均较低, 分别为(0.358 ±0.01)和(9.422 ±0.15)mmol·L-1, 随着幼虫的生长发育, 到第3天时达到峰值, 随后逐渐降低, 到下树落地时降至最低。Spd在整个6龄期的含量均较低, 随着幼虫的生长发育, 含量越来越低, 至落地越夏越冬时已测不出它的浓度。Cad在整个6龄期有2个峰值, 在6龄的初期, Cad的浓度较低, 之后逐渐升高, 发育至第3天时达到第1个峰值, 随后的一天又下降, 到第5天时达到第2个峰值, 到落地越夏越冬时, 又降至最低值。
|
图 1 鞭角华扁叶蜂6龄期幼虫血淋巴中4种多胺的变化 Fig. 1 The change of four polyamines during six instar |
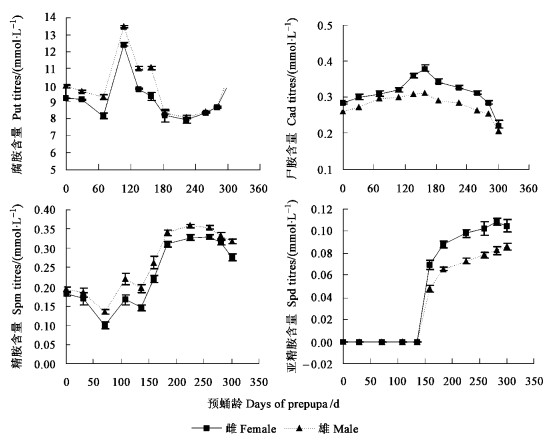
以预蛹龄为横坐标, 多胺含量为纵坐标绘制4种多胺在整个越夏越冬过程中的动态图(图 2)。从图 2可以看出:在整个的滞育期间, Spm、Spd、Cad、Put相对都比较活跃, 雌雄预蛹在刚入土时Spm的含量分别为(0.182 ±0.01)和(0.194 ±0.01)mmol·L-1, 随着滞育程度的加深, Spm的浓度逐渐降低, 到70天时降至最低水平, 之后在140天时虽稍有下降, 但总的呈上升趋势, 到180天时逐渐趋于平稳。Spd在整个滞育期间相对处于较低水平, 在滞育的前130天, 血淋巴中几乎不含Spd, 而之后血淋巴中的Spd迅速升高, 此时已是11月份, 气温也已逐渐降低, 这说明低温可能导致预蛹血淋巴中Spd含量增加。而Cad的含量在整个滞育期间除在滞育中期含量稍有升高外, 一直相对较为平稳。血淋巴中的Put含量始终处于很高的水平, 在滞育初期, 雌雄血淋巴中Put的含量分别为(9.216 ±0.12)和(9.938 ±0.07)mmol·L-1, 之后稍有下降, 至70天左右又迅速升高, 110天左右达峰值, 雌雄预蛹血淋巴中Put的含量分别达(12.412 ±0.14)和(13.467 ±0.17)mmol/L, 在以后的200多天, Put浓度呈U型变化。
|
图 2 鞭角华扁叶蜂预蛹血淋巴中4种多胺代谢动态 Fig. 2 The changes of four haemolymph polyamines of sawfly prepupa |
在鞭角华扁叶蜂预蛹滞育期间, 雌雄预蛹血淋巴中Spd、Spm、Cad、Put 4种多胺的代谢趋势较一致(图 2)。在整个滞育期, 雌雄预蛹血淋巴4种多胺的代谢趋势不存在差异。
在同一发育时期, 雌预蛹血淋巴中Spd和Cad的含量始终高于雄预蛹, 雌雄预蛹血淋巴中Spd和Cad的比例分别为(1.35 ±0.06):1和(1.14 ±0.05):1(♀:♂); 雄预蛹血淋巴中Spm和Put的含量则高于雌预蛹, 它们的比例分别为(1.18 ±0.05):1和(1.14 ±0.12):1(♂:♀)。但雌雄预蛹之间4种多胺的含量并不存在着显著差异(P < 0.05)。
3 讨论目前, 在昆虫中已经报道的多胺达20余种, 其中腐胺、亚精胺、精胺、尸胺是普遍存在的多胺, 也是生物及昆虫中主要研究的多胺。但对于不同的昆虫种类, 其机体内多胺的种类有所不同, 如腐胺、降亚精胺、亚精胺、降精胺、精胺是家蚕(Bombyx mori)、半目大蚕(Antheraea yamamai)、蜡螟蛾(Galleria mellonella)3种昆虫中主要的多胺, 二氨丙烷和高亚精胺是次要多胺, 但在它们的成虫中检测不到精胺(Hamana et al., 1991)。腐胺、亚精胺、精胺是蟋蟀生长发育过程中主要的多胺, 但在其神经组织中检测不到腐胺(Hamana et al., 1989; Strambi et al., 1993)。对家蚕不同组织中多胺测定的结果表明:腐胺和亚精胺在其丝腺、生殖腺、黏液腺、吸胃中含量特别高在以上组织中虽也检测到精胺, 但含量较低; 含有滞育卵的个体生殖腺和吸胃中多胺的含量特别高, 其滞育卵中尸胺的含量明显高于非滞育卵; 丝腺中多胺的含量在幼虫不同的发育阶段基本不变, 但在成虫阶段显著降低; 而生殖腺中多胺含量则不降低, 相反, 腐胺、二氨丙烷、降亚精胺的含量在成虫阶段有所升高(Hamana et al., 1984)。
在本研究中, 鞭角华扁叶蜂预蛹血淋巴经薄层层析可以分离到的谱带主要有8条, 说明其体内含有8种多胺, 其中腐胺、亚精胺、精胺、尸胺为普遍存在的多胺。在相同的发育阶段, 雌雄两性预蛹血淋巴中的谱带完全相同, 不存在质的差异; 雌雄预蛹之间血淋巴中多胺的代谢趋势基本相似, 除Cad的代谢雌雄之间存在差异外, 其余4种多胺Spm、Spd、Put、Cad的代谢不存在差异, 而且4种多胺的含量在雌雄预蛹之间也基本相似。随着发育阶段的不同, 多胺的种类和含量都会有所不同。在滞育预蛹整个发育过程中, 4种多胺的代谢较为激烈, Spm一直保持较高的含量, 并在整个滞育期间存在2个峰值; 在滞育的前5个月中血淋巴中不存在Spd, 但之后Spd突然出现, 且含量迅速升高; Cad的代谢较平稳, 在化蛹前稍有下降; Put的含量除在滞育后3个月左右有一个较大的峰值外, 其余阶段的含量均较高, 并在化蛹前还有一个升高的动态。
以上的研究表明:多胺可能参与了鞭角华扁叶蜂预蛹滞育过程。对家蚕不同组织中多胺的测定也得到类似的结果, 含有滞育卵的个体, 其生殖腺和吸胃中多胺的含量特别高, 滞育卵中尸胺的含量明显高于非滞育卵(Hamana et al., 1991)。但由于滞育及昆虫生理过程的复杂性, 对多胺如何调节昆虫滞育的生理生化的分子机理仍不完全清楚, 还需要通过深入研究与滞育相关的多胺及外源多胺或多胺抑制剂对昆虫生理生化代谢的影响, 并进一步分析多胺对昆虫滞育的调节效应及其与昆虫神经内分泌系统的协调关系等来加以证实。
崔相富, 陶华齐, 王于荣, 等. 1992. 鞭角华扁叶蜂生物学特征及防治方法的研究. 林业科学研究, 5(3): 321-327. |
冯立新, 范慕贞. 1996. DFMO诱导HL60细胞分化及凋亡. 中日友好医院学报, 10: 121-123. |
冯立新, 范慕贞. 1998. 多胺生物合成抑制诱导HL60细胞凋亡相关基因的克隆及表达. 中国肿瘤杂志, 20(4): 274-276. |
王满囷, 李周直. 2004. 昆虫滞育研究进展. 南京林业大学学报, 28(1): 71-76. |
Caryre M, Strambi C, Charpin P, et al. 1997. Specific requirement of putrescine for the mitogenic action of juvenile hormone on adult insect neuroblasts. Proc Natl Acad Sci USA, 94: 8238-8242. DOI:10.1073/pnas.94.15.8238 |
Cayre M, Strambi C, Charpin P, et al. 1996. Inhibition of polyamine biosynthesis alters oviposition behavior in female crickets. Behavior Neuros, 110: 1117-1125. DOI:10.1037/0735-7044.110.5.1117 |
Cayre M, Strambi C, Tirara A, et al. 1995. Effects of juvenile hormone on polyamines of the fat and neural tissue of the cricket Acheta domesticus. Comp Biochem Physiol, 111A: 241-250. |
Frydman L, Rossomando P C, Frydman V, et al. 1992. Interactions between natural polyamines and tRNA :an 15N NMR analysis. Proc Natl Acad Sci USA, 89: 9186-9190. DOI:10.1073/pnas.89.19.9186 |
Hamana K, Matzuzaki S, Inoue K. 1984. Changes in polyamine levels in various organs of Bombyx mori during its life cycle. J Biochem, 95: 1803-1809. DOI:10.1093/oxfordjournals.jbchem.a134793 |
Hamana K, Suzuki M, Wakabayashi T, et al. 1989. Polyamine levels in the gonads, sperm and aslivary gland of cricket cockroach, fly and midge. Comp Biochem Physiol, 92B: 691-695. |
Hamana K, Niitsu M, Samejima K, et al. 1991. Novel polyamines in insects and spiders. Comp Biochem Physiol, 100B(2): 399-402. |
Kogan P H, Hangedorn H H. 1985. Control of polyamines synthesis and its requirement during vitellogenin production in the mosquito, Aedes aegypti. Am Zool, 25: 127. DOI:10.1093/icb/25.1.127 |
Kogan P H, Hagedorn H H. 2000. Polyamines, and effects from reducing their synthesis during egg development in the yellow fever mosquito, Aedes aegypti. J Insect Physiol, 46: 1079-1095. DOI:10.1016/S0022-1910(99)00084-0 |
Ludquist A, Lowkvist B, Liden M, et al. 1983. Polyamines in early embryonic development :their relationship to nuclear multiplication rate, cell cycle traverse, and nuclar formation in a dipteran egg. Devl Biol, 95: 253-259. DOI:10.1016/0012-1606(83)90026-X |
Matthews H R. 1993. Polyamines, chromatin structure and tran cription. Bioessays, 15: 561-566. DOI:10.1002/bies.950150811 |
Pegg A E, Peter P M. 1982. Polyamines metabolism and function. Am J Physiol, 243: C212-C221. DOI:10.1152/ajpcell.1982.243.5.C212 |
Sjoholm A. 1993. Role of polyamines in the regulation of proliferation and hormone production by insulin-secreting cells. Am J Physiol, 264: 501-518. DOI:10.1152/ajpcell.1993.264.3.C501 |
Sparks R B, Vaske D, Lilleberg S, et al. 1991. Temporal expression of ornithine decarboxylase in developing embryos of Musca domestica L. Archs Insect Biochem Physiol, 16: 177-187. DOI:10.1002/arch.940160304 |
Strambi C, Tirarad A, Renucci M, et al. 1993. Ecdysone deprivation affects polyamine metabolism in the house cricket Acheta domesticus. Insect Biochem Mole Biol, 23: 165-170. DOI:10.1016/0965-1748(93)90096-B |
Tabor C W, Tabor H. 1984. 5 Polyamines. Ann Rev Biochem, 3: 749-190. |
Thomas T, Thomas A. 1993. Selectivity of polyamines in triplex DNA stabilization. Biochem, 32: 14068-14074. DOI:10.1021/bi00213a041 |
 2006, Vol. 42
2006, Vol. 42