文章信息
- 董娟娥, 梁宗锁, 靳爱仙, 余震宇, 成密红.
- Dong Juan'e, Liang Zongsuo, Jin Aixian, Yu Zhenyu, Cheng Mihong.
- 杜仲叶酸性多糖提取分离及含量测定
- The Extraction and Content Measurement of Acidic Polysaccharides from Eucommia ulmoides Leaves
- 林业科学, 2006, 42(10): 59-64.
- Scientia Silvae Sinicae, 2006, 42(10): 59-64.
-
文章历史
- 收稿日期:2006-03-29
-
作者相关文章
2. 国家林业局调查规划设计院 北京 100714
2. Academy of Forest Inventory and Planning, State Forestry Administration Beijing 100714
近年来研究表明, 多糖具有多种生理活性和营养价值, 如南瓜多糖是预防糖尿病的活性成分(范文秀等, 2005); 茶多糖具有降血糖、降血脂、增加冠状动脉血流量、增强机体免疫力、抗癌等多种功效(倪德江等, 2003; 陈海霞等, 2002); 螺旋藻多糖具有抗氧化、抗疲劳的作用(殷钢等, 1999); 酸性多糖具有较强的免疫促进作用, 如紫松果菊酸性多糖、刺五加酸性多糖和黑木耳酸性多糖等(张俐娜等, 1994)。
杜仲(Eucommia ulmoides)是杜仲科杜仲属植物。杜仲皮是名贵的滋补药材, 被列为中药上品, 富含多种生物活性物质、微量元素及营养物质, 具有延缓衰老、增强免疫、防癌抗癌等功效(尉芹等, 1995, 张康健等, 1996), 是一种很好的药食同源植物。近年来, 人们对杜仲次生代谢物及杜仲叶中药用有效成分的提取分离做了大量研究(张康健等, 1999a; 1996;2001;2002;高锦明等, 1998; 董娟娥等, 2002; 2003;马柏林等, 2002; 马希汉等, 2003; 2004), 结果表明以叶代皮完全可行。早在20世纪90年代初, 日本学者Gonda等(1990)和Tomoda等(1990)从杜仲树皮中分得2种酸性多糖(Eucommia A和Eucommia B), 并认为这2种多糖可增强机体非特异性免疫功能。此后, 日本学者又从杜仲树叶中提取分离出酸性多糖, 认为杜仲酸性多糖是抗感染症剂和脑代谢促进剂, 可抑制后天性免疫缺陷性病毒细胞的吸附和增殖, 预防和治疗艾滋病毒的感染, 长期服用也无副作用(朱晓薇等, 1977)。我国有杜仲林36万hm2, 每年秋季大量落叶, 造成资源浪费。若能以杜仲叶或提取过杜仲有效成分的叶渣为原料提取杜仲酸性多糖, 并开发成为药品或保健品, 就会大大提高杜仲的经济效益, 保护自然资源, 也可使主要分布在西部贫困山区的杜仲林得以保护, 并对农民脱贫致富做出贡献。目前, 有关杜仲叶多糖研究少见报道(赵晓明等, 1999), 而有关杜仲叶酸性多糖的提取分离和含量测定未见有关系统报道。本文以提取过药用有效成分后的杜仲叶渣为原料, 研究杜仲叶酸性多糖的提取分离和含量测定方法, 以期为杜仲叶酸性多糖的工业化生产提供工艺参数, 为杜仲叶资源的综合开发利用提供科学依据。
1 材料与方法 1.1 材料来源原材料采自西北农林科技大学杜仲优树汇集圃, 杀青后荫干; 用体积分数为80 %的乙醇水溶液提取药用成分(供分离药用成分用), 收集叶渣, 荫干备用。
1.2 主要仪器与试剂UV2000型紫外-可见分光光度计(上海尤尼柯公司), LD4 -2型离心机(北京医用离心机厂), 层析柱(10 cm×100 cm)(天津高科)。
3, 5 -二硝基水杨酸(DNS)试剂的配制:精密称取182 g酒石酸钾钠, 加热下溶于500 mL蒸馏水, 精密称取6.3 g DNS加入到上述500 mL酒石酸钾钠的热溶液中, 标记为A。配制262 mL 2 mol·L-1 NaOH溶液。然后于A中依次加入配制好的NaOH溶液、5 g重蒸酚和5 g亚硫酸氢钠, 搅拌使其充分溶解, 冷却后以蒸馏水定容到1 000 mL, 贮于棕色瓶中备用。以上所有试剂均为分析纯。
1.3 研究方法 1.3.1 大孔树脂(西安电力树脂厂)的预处理树脂用体积分数为95 %的乙醇(或丙酮)浸泡24 h使其充分溶胀, 洗至无大分子杂质, 用蒸馏水除去乙醇(或丙酮); 再用3倍体积(BV)的3 %的HCl溶液以5 BV·h-1的流速冲洗树脂, 用蒸馏水洗至中性; 最后用3 BV的3 %的NaOH溶液以5 BV·h-1的流速冲洗树脂, 蒸馏水洗至中性后备用。
1.3.2 含量测定工作原理多糖是非还原糖。多糖在酸作用下水解成单糖后迅速脱水成糖醛衍生物, 此糖醛衍生物和DNS试剂缩合生成棕红色的氨基有色化合物(3 -氨基-5 -硝基水杨酸)。在一定的浓度范围内, 氨基有色化合物的浓度与反应液的颜色呈比例关系, 用比色法可测定样品中的含糖量。
1.3.3 多糖的水解取一定量的待测样品, 加入6mol·L-1的HCl 5 mL, 在沸水浴中加热15 ~ 20 min, 冷却后用6 mol·L-1的NaOH溶液调pH至中性。
1.3.4 显色反应程序取一定量水解后的溶液, 加入2 mL DNS试剂, 充分混匀后于90 ℃水浴中显色, 以DNS试剂加蒸馏水为对照。冷却, 用蒸馏水定容为10 mL。
2 结果与讨论 2.1 杜仲叶酸性多糖提取工艺影响杜仲叶酸性多糖提取率的主要因素有碱液浓度、提取时间、提取温度、提取次数、液料比和原料的粉碎度等, 本试验主要考察碱液的浓度、提取时间和提取温度等对提取率的影响, 最终确定杜仲叶酸性多糖提取的较佳工艺参数。所有试验均设定提取2次、料液比为1:8和原料不粉碎。
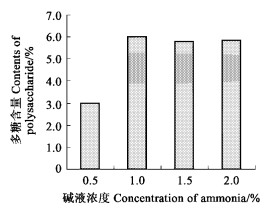
2.1.1 碱液浓度对杜仲叶酸性多糖提取率的影响精确称取10 g干燥的材料4份, 分别用8倍量的体积分数0.5 %、1.0 %、1.5 %和2.0 %的氨水溶液提取。提取液反复过滤、定溶, 测定酸性多糖含量, 结果见图 1(n =3)。在碱液浓度为0.5 %时, 酸性多糖的提取率较低, 1.0 %的提取率较高, 继续增加碱液的浓度并没有提高酸性多糖的提取率。工业化生产时, 如果碱的浓度过大, 在高温加热条件下会对生产设备造成腐蚀。因此, 在文中所设定的浓度范围内, 提取时最佳的碱浓度应为体积比1.0 %。
|
图 1 碱液浓度对多糖提取率的影响 Fig. 1 The effects of different ammonia concentrations on the extractions of polysaccharide |
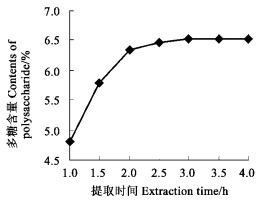
精确称取10 g 7份干燥的原材料, 分别提取1.0、1.5、2.0、2.5、3.0、3.5和4.0 h, 测定提取液中酸性多糖的含量, 结果见图 2(n =3)。随着提取时间的延长, 酸性多糖的提取率呈增加趋势, 但超过2 h后, 提取率无显著增加。在工业化生产中, 为了节约成本, 提取时间应为2 h。
|
图 2 提取时间对多糖提取率的影响 Fig. 2 The effects of different time on the extraction of polysaccharide |
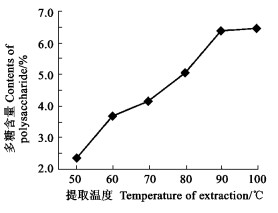
精确称取10 g 6份干燥的原材料, 用1.0 %的碱溶液分别在50、60、70、80、90和100 ℃下提取, 测定提取液中酸性多糖的含量, 结果见图 3(n =3)。杜仲叶酸性多糖的提取率在50 ℃时最低(3.576 %)。随着温度的升高, 溶剂分子运动速度加快, 向植物组织中渗透和扩散的能力相应增加, 酸性多糖的提取率增高。由图 3可以看出, 酸性多糖的提取率在100 ℃时达最大(6.462 %), 但与90 ℃时无显著差异。故提取杜仲酸性多糖的温度可为90 ~ 100 ℃。
|
图 3 提取温度对多糖提取率的影响 Fig. 3 The effects of different exacting temperatures on extraction of polysaccharide |
从上述单因素试验可以直观看出, 碱液浓度在1.0 %~ 2.0 %时提取率差异不大, 但与0.5 %的差异较大; 提取2 h与4 h提取率的差异不大, 但与1.5 h时有明显差异。分别以90 ℃和100 ℃进行提取, 提取时间设为2 h、碱液浓度为1.0 %, 结果分别为6.501 %(90 ℃)和6.634 %(100 ℃), 100 ℃下的提取率较大。因此, 确定杜仲叶酸性多糖的提取工艺参数为:用1.0 %的碱液、在100 ℃的温度下提取2次, 每次2 h。
2.2 杜仲叶酸性多糖含量测定方法测定多糖含量的方法主要有HPLC法、苯酚-硫酸法和硫酸-蒽酮法等, 但因HPLC法需要有较昂贵的仪器, 苯酚-硫酸法和硫酸-蒽酮法中硫酸具有严重的腐蚀性, 苯酚也极易氧化, 给试验操作带来不便。因此, 本试验对DNS法测定杜仲叶多糖的含量进行考察。
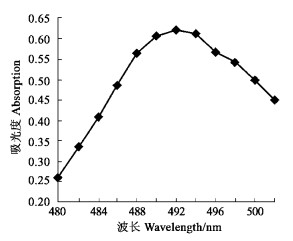
2.2.1 检测波长的确定文献报道用DNS测定还原糖时, 在475 ~ 482 nm和520 nm处有2个最大吸收波长(尹银嘉等, 2003)。为了考察杜仲叶酸性多糖显色反应后的最大吸收波长, 本试验从480 ~ 502 nm之间每隔2 nm测定显色溶液吸光度, 测定结果见图 4。吸光度在492 nm波长时最大, 故确定杜仲叶酸性多糖含量测定波长为492 nm。
|
图 4 酸性多糖的吸收波长 Fig. 4 The absorption wavelength of acid polysaccharide |
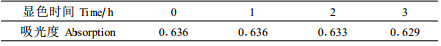
显色反应过程中, 如果时间过短, 则反应不完全。但在显色反应完成后, 长时间高温加热又会引起部分物质的分解变化。因此, 有必要确定适宜的显色时间。
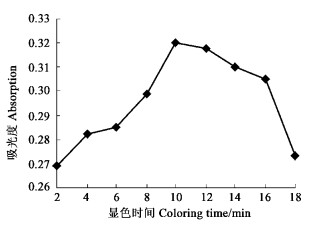
取9支试管, 各加入0.2 mg·mL-1的葡萄糖标准溶液2 mL, DNS试剂2 mL, 充分混匀(以蒸馏水加DNS试剂为对照)。于90 ℃水浴中分别加热显色2、4、6、8、10、12、14、16和18 min后取出, 冷却, 用蒸馏水定容至10 mL, 测定吸光度, 结果见图 5。显色时间为10 min时溶液的吸光度达到最大值。
|
图 5 不同显色时间的吸光度 Fig. 5 The absorption of the different coloring time |
将显色后的待测液在室温下放置不同时间后测定吸光度, 考察显色溶液的稳定性。结果见表 1。
|
|
表 1显示, 显色溶液的吸光度在2 h内无显著变化, 显色稳定, 到3 h时略有下降, 故测定工作须在2 h内完成。
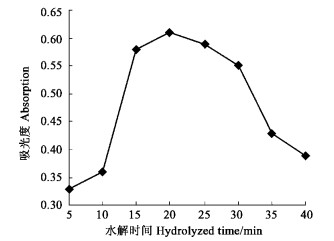
2.2.4 水解时间的确定在样品测试液的制备过程中, 酸水解的时间既不能太短(多糖水解不完全), 也不能太长。水解时间太长, 单糖会进一步水解成5 -羟甲基糠醛, 不能与3, 5 -二硝基水杨酸缩合成有色物质(尹银嘉等, 2003), 影响测定结果的准确性。通过试验认为, 15 ~ 20 min是杜仲叶酸性多糖水解的较佳时间(图 6)。
|
图 6 不同水解时间的吸光度 Fig. 6 The absorption tested after different hydrolyzed time |
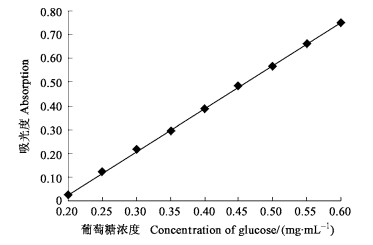
精密称取100.0 mg葡萄糖对照品, 配制成1.0 mg·mL-1的对照品溶液。分别吸取对照品溶液2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5和6.0 mL, 以蒸馏水定容为10 mL, 得一系列不同浓度的标准液。取各浓度的标准液2 mL于9支试管中, 各加入2 mL DNS试剂, 充分混匀, 90 ℃水浴中显色, 冷却, 用蒸馏水定容至10 mL, 在492 nm测吸光度(对照同上)。以葡萄糖对照品浓度为横坐标, 相应的吸光度为纵坐标绘制标准曲线, 如图 7所示。经计算得回归方程:
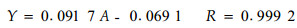
|
|
图 7 标准曲线 Fig. 7 The standard curve of glucose |
式中:Y为标准液浓度(mg·mL-1); A为吸光度。
2.2.6 加样回收率取已知含量的一定量样品的水解总糖溶液置5支试管中, 各加入0.1 mg·mL-1的葡萄糖标准溶液1 mL, 按上述方法显色、测定加样回收率, 并计算相对标准偏差(RSD)。相对标准偏差的计算公式为:
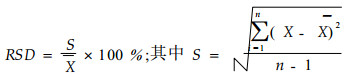
|
式中:S为标准差; X为平均值; n为重复次数。
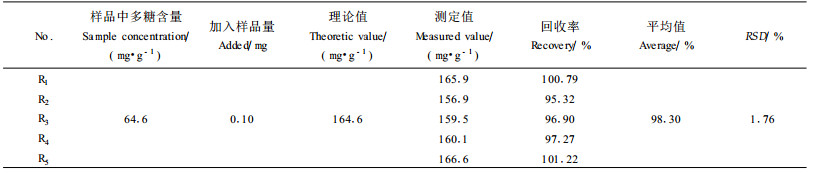
加样回收率测定结果见表 2(n =5)。
|
|
表 2显示, 用DNS法测定杜仲叶酸性多糖含量的平均回收率为98.30 %, 标准差为1.76 %(小于2.0 %), 符合测定精度要求。
DNS法测定多糖含量克服了苯酚-硫酸和硫酸-蒽酮法的缺点, 具有测定过程简便、操作安全和测定结果可靠等优点。但应注意, 在该法的显色反应中, 酒石酸钾钠的作用是提高反应的灵敏度和使显色稳定, 但它同时也会降低亚硫酸钠对还原糖的保护作用, 造成一部分葡萄糖被破坏而不显色。
2.2.7 杜仲叶渣中酸性多糖含量的测定与计算取10.0 g的待测样品, 按照上述选定的提取条件提取、过滤、定容后得待测液。取待测液2 mL于刻度试管中, 加入2 mL DNS试剂, 在90 ℃水浴中显色, 测定提取液中还原性单糖量a; 取同样量的待测液, 按“多糖的水解”程序水解, 测定提取液中总糖量b; 样品中多糖的含量计算公式为:
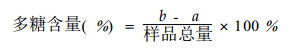
|
按照此法测定杜仲叶渣中杜仲酸性多糖的含量为6.43 %。
2.3 酸性多糖的分离纯化及含量测定 2.3.1 分离纯化工艺采用上述选定的提取条件对原料进行提取得到粗提液, 然后以多糖的含量和得率为考察指标, 对粗提液进行大孔树脂层析和醇沉等分离纯化处理, 最后确定了杜仲叶渣中酸性多糖的分离纯化工艺如下:
称取干燥的原材料(提取过药用有效成分后的杜仲叶渣)750 g, 用1.0 %的碱水在100 ℃下提取2次, 每次2 h, 真空抽滤, 合并滤液, 浓缩到约400 mL(按原料计约为2 g·mL-1), 用大孔吸附树脂吸附8 h, 蒸馏水洗脱。洗脱液在60 ℃水浴锅中真空浓缩至300 mL, 在不断搅拌下向浓缩液中缓慢加入4倍体积(BV)的无水乙醇, 室温放置30 min, 4 000 r·min-1离心10 min, 滤出上清液; 将上清液浓缩至约300 mL, 在不断搅拌下缓慢加入2 BV的85 %乙醇, 4 000 r·min-1离心10 min, 滤出上清液; 再次将上清液浓缩至约200 mL, 在不断搅拌下缓慢加入2倍体积的无水乙醇, 4 000 r·min-1离心15 min后, 弃去上清液。沉淀在60 ℃真空烘箱中烘干, 得到灰白色粉末状杜仲酸性多糖5.9 g。此得率按投料量计算为0.787 %, 按总的多糖量计算为12.29 %(杜仲叶渣中含量按6.4 %计算, 750 g原料中共有多糖48 g)。
2.3.2 含量测定精确称量烘至恒重的杜仲叶酸性多糖粉末0.557 g, 加热下溶解于蒸馏水中, 冷却后定容为100 mL, 得待测液。然后按照“2.2.7”项下方法操作, 测得分离纯化后杜仲叶渣酸性多糖的含量为41.46 %。
3 结论提取杜仲叶酸性多糖的工艺条件是:用1.0 %的碱水在100 ℃时提取2次, 每次2 h。
杜仲叶渣中酸性多糖的含量为6.43 %。
以杜仲叶渣为原料, 经提取、树脂吸附、洗脱和醇沉等步骤可进一步分离纯化杜仲叶酸性多糖。杜仲叶酸性多糖为灰白色粉末; 在本试验条件下, 按投料量计算, 多糖得率为0.787 %, 纯度为41.46 %。有关杜仲叶酸性多糖的进一步分离纯化、理化鉴定和生理活性等还有待于做深入研究。
用DNS法测定杜仲叶酸性多糖含量时, 多糖的水解时间控制在15 ~ 20 min; 显色反应时间为10 min; 测定波长为492 nm; 在试验条件下, 糖含量在0.20 ~ 0.60 mg·mL-1范围显色灵敏、稳定, 线性关系良好; 加样回收率为98.30 %, RSD为1.76 %; 显色溶液在2 h内吸光度值稳定, 能满足测定工作要求。该法可以作为一种实验室测定多糖含量的简便、快捷、有效的方法。
杜仲是我国特有的药用植物, 全国种植面积达36万hm2。杜仲叶资源非常丰富, 每年秋季大量枯落, 造成资源浪费。杜仲叶中含有大量的药用有效成分和营养成分, 杜仲叶药用有效成分的提取大多以乙醇或乙醇-水溶液为溶剂, 而多糖一般在乙醇中不溶解。因此, 提取过药用有效成分的叶渣可以用来提取酸性多糖, 实现杜仲的多级开发、资源重复利用途径。利用杜仲叶渣提取纯化的杜仲叶酸性多糖又可作为保健食品、饮品的添加剂, 充分发挥其药理活性和营养功能。
陈海霞, 谢笔均. 2002. 茶多糖对小鼠实验性糖尿病的防治作用. 营养学报, 24(1): 85-86. |
董娟娥, 马柏林, 刘丽, 等. 2003. 超声波提取杜仲叶中有效成分工艺研究. 西北林学院学报, 18(3): 66-68. |
董娟娥, 马柏林, 仝小林, 等. 2002. 提高杜仲叶中主要活性物质提取率的研究. 西北林学院学报, 17(1): 64-67. |
范文秀, 李新峥. 2005. 南瓜生长过程中多糖含量的测定. 光谱实验室, 22(4): 834-836. |
高锦明, 刘丽, 张鞍灵, 等. 1998. 杜仲叶生物活性成分的提纯研究. 西北林学院学报, 13(1): 83-86. |
马柏林, 董娟娥, 刘丽, 等. 2002. 杜仲素与杜仲总黄酮连续提取分离研究. 西北林学院学报, 17(1): 70-73. |
马希汉, 王冬梅, 苏印泉. 2004. 大孔吸附树脂对杜仲叶中绿原酸、总黄酮的分离研究. 林产化学与工业, 24(3): 47-51. |
马希汉, 尉芹, 景谦平. 2003. 杜仲叶提取绿原酸的中间试验研究. 林产化学与工业, 23(3): 73-76. |
倪德江, 谢笔钧, 宋春和, 等. 2003. 茶多糖提取条件的研究. 农业工程学报, 19(2): 176-179. |
尉芹, 马希汉, 张康健. 1995. 杜仲化学成分研究. 西北林学院学报, 10(4): 88-93. |
殷钢, 李琛, 何清华, 等. 1999. 螺旋藻中藻胆蛋白和多糖的分离纯化及产品特性. 精细化工, 16(2): 10-13. |
尹银嘉, 魏士超, 马宝瑕. 2003. 3, 5-二硝基水杨酸法测二味康口服液中多糖的含量. 中国医院药学杂志, 23(7): 414-416. |
张康健, 白明生, 张檀. 2001. 杜仲叶次生代谢物与个体生长发育特性的研究. 林业科学, 37(6): 45-51. |
张康健, 董娟娥, 马柏林. 2002. 杜仲次生代谢物部位差异性的研究. 林业科学, 38(6): 12-16. |
张康健, 马希汉, 马梅. 1999a. 杜仲叶次生代谢物生长积累动态的研究. 林业科学, 35(2): 15-20. |
张康健, 王蓝, 马希汉. 1996. 杜仲综合开发的进展与前景. 西北林学院学报, 11(2): 70-75. |
张康健, 王亚琴, 马希汉. 1999b. 杜仲叶次生代谢物生态学研究初报. 林业科学, 35(6): 28-34. |
张俐娜, 陈和生, 李翔. 1994. 黑木耳酸性杂多糖构效关系的研究. 高等学校化学学报, 15(8): 1231-1234. |
赵晓明, 张鞍灵, 张檀, 等. 1999. 杜仲叶多糖研究. 西北林学院学报, 14(4): 73-75. |
朱晓薇, 柳云湘. 1977. 用于预防和治疗HIV感染的杜仲树皮或叶和碱性提取物. 国外医药植物药分册, 12(4): 184. |
Gonda R, Tomoda M, Shimizu N, et al. 1990. An acidic polysaccharide having activity on the reticuloendothelial system from the bark of Eucommia ulmoides. Chem Parm Bull, 38(7): 1966-1969. DOI:10.1248/cpb.38.1966 |
Tomoda M, Gonda R, Shimizu N, et al. 1990. A reticuloendothelial system-activation glycan from the barks of Eucommia ulmoides. Phytochem, 29(10): 3091-3094. DOI:10.1016/0031-9422(90)80163-B |
 2006, Vol. 42
2006, Vol. 42