文章信息
- 肖祥希, 刘星辉, 杨宗武, 万泉, 郑蓉, 王志洁.
- Xiao Xiangxi, Liu Xinghui, Yang Zongwu, Wan Quan, Zheng Rong, Wan Zhijie.
- 铝胁迫对龙眼幼苗蛋白质和核酸含量的影响
- Effect of Aluminum Stress on the Content of Protein and Nucleic Acid of Longan (Dimocarpus longan)Seedlings
- 林业科学, 2006, 42(10): 24-30.
- Scientia Silvae Sinicae, 2006, 42(10): 24-30.
-
文章历史
- 收稿日期:2005-07-05
-
作者相关文章
2. 福建农林大学园艺学院 福州 350002
2. College of Horticulture, Fujian Agriculture and Forestry University Fuzhou 350002
核酸和蛋白质是生物体内最重要的组分, 它们一起构成生命的主要物质基础。在逆境条件下, 如水分胁迫(陈立松等, 1999; 王万里等, 1986)、缺镁胁迫(李延等, 2001)、盐胁迫(卞彦等, 2000)、酸雨胁迫(吕振武等, 1998)等均会引起植株核酸、蛋白质、氨基酸含量以及RNase (核糖核酸酶)、DNase (脱氧核糖核酸酶)、蛋白酶活性变化。已有研究表明, 铝能干扰植物氮代谢过程, 对DNA、RNA和许多核苷酸具有高度亲和性, 可直接或间接地影响DNA和RNA的结构和功能(Morefield et al., 2005; Sasaki et al., 2002; 2004; Kochian, 1995; Xiao et al., 2005; 田仁生等, 1990; 刘东华等, 1995; 张帆等, 2005)。因此本文研究铝胁迫下龙眼(Dimocarpus longan)幼苗氮含量、蛋白质、氨基酸、核酸及相关酶活性的变化, 阐明铝对龙眼幼苗氮代谢的影响。
1 材料与方法 1.1 材料供试材料为苗龄7个月的乌龙岭龙眼实生苗, 苗木从圃地取出移入培养液中经过2个月恢复培养, 于2001年7月开始进行铝胁迫, 胁迫3个月后进行相关指标测定。
1.2 方法 1.2.1 苗木培养和处理水培试验营养液采用王仁玑等(1981)的配方, 用1/4浓度进行培养, 容器采用外壁漆黑的小塑料桶, 每桶3株, 每桶装培养液2 L, 每14 d更换1次培养液, 更换培养液时调节pH至4.2, 每天定时通气3次、每次20 min。铝胁迫处理是采用在营养液中加铝, 铝源采用AlCl3·6H2O, Al3+浓度设0 (CK)、0.185、0.370、0.740、1.110、1.850 mmol·L-16个处理, 按随机区组设计, 重复5次。
1.2.2 材料的采集分析和测定用的叶片均取自小苗顶端向下第2至第4片复叶, 根系取须根根尖2~3 cm。各处理采用混合采样法, 除氨基酸外各生理指标测定重复3次。
1.2.3 测定方法蛋白质含量及蛋白酶活性:称取叶样或根样0.5 g, 加入适量的50 mmol·L-1、pH7.0的磷酸缓冲液(含0.1%PVP), 在冰浴中研磨成匀浆, 匀浆用冷冻离心机15 000×g离心20 min, 上清液用于可溶性蛋白质含量及蛋白酶活性测定。蛋白质含量按Bradford (1976)的方法测定。热稳定和热不稳定蛋白的测定参照曾韶西等(1997)的方法, 取适量酶提取液煮沸10 min, 于1 200×g下离心20 min, 上清液为热稳定蛋白, 沉淀部分为热不稳定蛋白, 各部分分别测定其含量。蛋白酶活性参照Kar等(1977)的方法。1 mL酶提取液加2 mL反应液(内含1.5 mL 50 mmol·L-1 pH6.0柠檬酸-磷酸缓冲液, 0.5 mL新配制的2%的牛血清蛋白)在40 ℃下混合培养2 h, 然后加入2 mL 10%的TCA终止反应, 4 ℃过夜, 12 000×g离心10 min, 吸取1 mL上清液加入1 mL无氨蒸馏水、0.1 mL 0.1%AsA及3 mL水合茚三酮试剂(西北农业大学植物生理生化教研组, 1987), 沸水浴中反应15 min, 然后放在冷水浴中迅速冷却并经常摇动, 待溶液呈蓝紫色时补加60%的乙醇至5 mL, 在570 nm处测OD570值。
N含量:样品经粉碎烘干(70 ℃)至恒重后直接用全自动碳氮分析仪(Sumigraph NC-80和Shimadzu gas chromatograph GC-8A两个系统)测定全N。蛋白质N、铵态N和硝态N参照陈因(1999)的方法, 粉碎烘干的样品用2%三氯乙酸浸泡, 在摇床上振荡50~60 min后过滤, 残渣烘干(70 ℃)至恒重后, 用全自动碳氮分析仪直接测定蛋白质N。
氨基酸含量:样品用6 mmol·L-1HCl水解过滤后真空干燥, 残渣用0.1 mmol·L-1的柠檬酸缓冲液(pH2.2)溶解, Hitachi835-50型氨基酸自动分析仪测定, 每个处理测定2个样本, 取平均值。
硝酸还原酶(NR)活性:采用磺胺比色法, 根据华东师范大学生物系植物生理教研组(1980)主编的《植物生理学实验指导》中的方法进行, 酶活性以每h每g鲜质量产生的NO2- μg数表示。
核酸含量及核酸酶活性:用紫外分光光度法(波长260 nm)测定核酸总量, 然后样品液进行二苯胺反应, 在波长595 nm下测定DNA的含量(朱广廉等, 1990), 核酸总量减去DNA即为RNA。RNase活性参照颜秋生等(1981)的方法, 0.2 mL酶液加0.5 mL酵母核糖核酸钠(30 mg酵母核糖核酸钠溶于100 mL pH5.0的0.1 mmol·L-1醋酸缓冲液中), 在37 ℃水浴中保温30 min, 随即用冰水冷却, 再用冰冷的蒸馏水稀释10倍, 用分光光度计测定OD260。DNase活性参照颜秋生等(1981)的方法, 0.2 mL酶液加入0.8 mL小牛胸腺DNA (10 mg小牛胸腺DNA溶于pH5.0的0.1 mmol·L-1醋酸缓冲液中过夜, 次日加入1 mL 0.1 mmol·L-1MgSO4, 用上述醋酸缓冲液定容至100 mL), 然后按RNase的步骤进行测定。
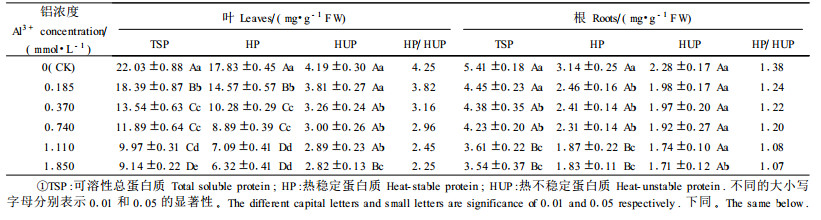
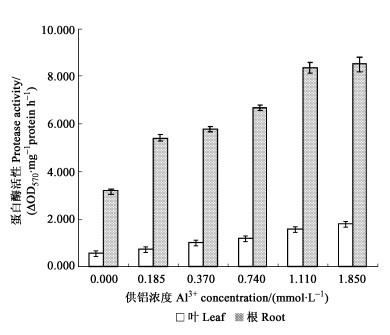
2 结果 2.1 铝对龙眼幼苗蛋白酶活性及蛋白质含量的影响铝胁迫下, 龙眼幼苗叶、根蛋白酶活性显著增加(图 1), 与对照相比, 蛋白酶活性叶片增加了33.76%~217.30%, 根增加了70.45%~167.86%, 根蛋白酶活性明显大于叶, 但蛋白酶活性的增加幅度, 除0.185 mmol·L-1铝浓度处理外, 其余各处理都是叶大于根。说明低浓度铝胁迫(0.185 mmol·L-1)时, 根的蛋白酶活性对铝更敏感。铝胁迫引起龙眼幼苗叶、根可溶性蛋白质、热稳定蛋白质和热不稳定蛋白质含量下降(表 1)。铝胁迫下, 叶片可溶性蛋白质、热稳定蛋白质和热不稳定蛋白质含量分别下降了16.54%~58.53%、18.29%~64.56%、9.09%~32.87%, 根中的含量分别下降了17.84%~34.61%、21.47%~41.59%、12.85%~24.99%, 其中热稳定蛋白质下降幅度明显大于热不稳定蛋白质, 从而使得热稳定蛋白质与热不稳定蛋白质的比值下降。从表 1还可以看出, 叶片可溶性蛋白质、热稳定蛋白质和热不稳定蛋白质含量明显大于根; 不论是叶还是根, 热稳定蛋白质始终比热不稳定蛋白质高。相关分析表明, 叶、根可溶性蛋白质、热稳定蛋白质和热不稳定蛋白质含量与铝胁迫浓度之间呈显著的负相关, 相关关系为:y (叶可溶性蛋白质) =6.101 3x2-17.662x+21.218 (R=-0.97**), y (叶热稳定蛋白质) =5.368 2x2-15.622x+17.10 (R=-0.97**), y (叶热不稳定蛋白质) =0.733 2x2-2.039 9x+4.117 7 (R=-0.97**); y (根可溶性蛋白质) =0.645 7x2-2.058 6x+5.150 6 (R=-0.94**), y (根热稳定蛋白质) =0.458 8x2-1.450 4x+2.952 8 (R=-0.94**), y (根热不稳定蛋白质) =0.186 8x2-0.608 1x+2.197 7 (R=-0.94**)。可见上述蛋白质含量的下降与铝胁迫密切相关。
|
图 1 铝胁迫对龙眼蛋白酶活性的影响 Fig. 1 Effect of Al3+ stress on protease activity of Longan |
|
|
铝胁迫下, 龙眼叶片全N量和蛋白质N下降, 非蛋白质N有所增加(图 2 a), 全N比对照下降了2.85%~8.26%, 蛋白质N下降了5.80%~33.31%, 非蛋白质N增加了10.22%~102.79%, 蛋白质N占总N量的百分数由对照的81.60%下降为59.32%~79.12%, 由此可以进一步说明铝胁迫可导致蛋白质降解和蛋白质合成受阻。龙眼叶片铵态N的含量明显高于硝态N, 铝胁迫下, 铵态N下降了3.76%~44.84%;低浓度铝胁迫使得龙眼叶片硝态N增加, 0.185 mmol·L-1铝处理时达到最大值, 而后随铝胁迫浓度的增加硝态N逐渐减少, 与对照相比下降了7.81%~21.09% (图 2 b)。相关分析表明, 铵态N、硝态N含量与铝处理浓度呈显著相关:y (铵态N) =-0.597 9x+2.272 9 (R=-0.95**), y (硝态N) =0.006 2x2-0.028 3x+0.131 7 (R=-0.94**)。
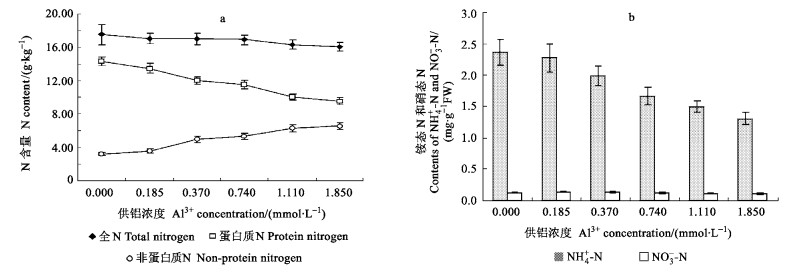
|
图 2 铝胁迫对龙眼叶片氮含量的影响 Fig. 2 Effect of Al3+ stress on contents of nitrogen in Longan leaves |
NR是氮代谢的限速酶, 铝胁迫抑制龙眼叶片的NR活性(图 3 a), NR活性比对照下降了4.03%~40.73%, 可见铝胁迫下龙眼N的吸收和代谢受到了抑制。
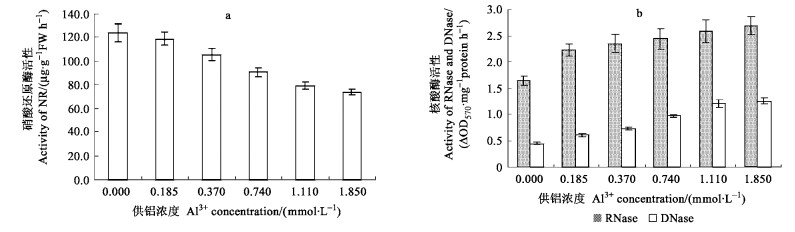
|
图 3 铝胁迫对龙眼叶片硝酸还原酶和核酸酶活性的影响 Fig. 3 Effect of Al3+ stress on the activity of nitrate reductase (NR), RNase and DNase in Longan leaves |
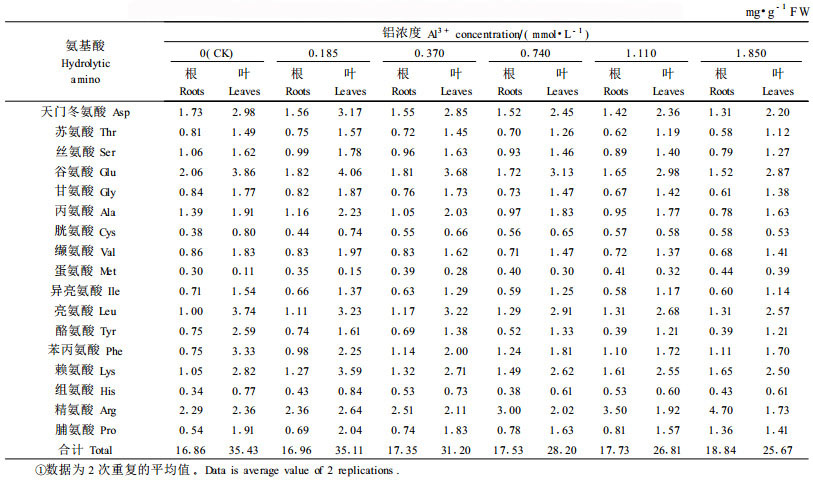
铝胁迫导致龙眼幼苗根水解氨基酸总量增加, 增加幅度为0.59%~11.74%, 叶片水解氨基酸总量下降, 下降幅度为0.90%~27.55%, 叶片水解氨基酸总量明显高于根系(表 2)。在根系中, 脯氨酸、精氨酸、赖氨酸、亮氨酸、蛋氨酸、胱氨酸随铝胁迫浓度的增加而增加; 而天门冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、酪氨酸则随铝胁迫浓度的增加而减少; 缬氨酸、异亮氨酸变化幅度不大, 苯丙氨酸和组氨酸除CK处理相对较小外, 其他各处理变化幅度也不大。在叶中, 脯氨酸、精氨酸、组氨酸、赖氨酸、缬氨酸、丙氨酸、甘氨酸、谷氨酸、丝氨酸、苏氨酸、天门冬氨酸在低浓度(0.185 mmol·L-1)铝胁迫时含量达到最大值, 而后(铝浓度大于0.185 mmol·L-1)则随铝处理浓度的增加而减少; 苯丙氨酸、酪氨酸、亮氨酸、异亮氨酸、胱氨酸含量随铝胁迫浓度的增加而减少, 蛋氨酸则随铝胁迫浓度的增加而增加。
|
|
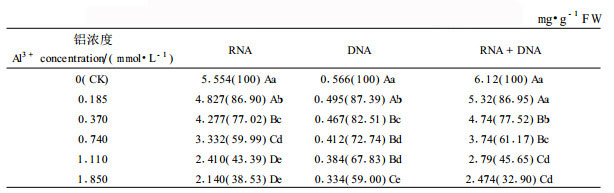
龙眼叶片RNase活性明显高于DNase (图 3 b), 在铝胁迫下, RNase活性上升了35.62%~63.47%, DNase活性上升了35.57%~183.27%, 与对照比, RNA含量下降了13.10%~61.47%, DNA含量下降了12.61%~41.00%, 下降幅度RNA大于DNA (表 3)。相关分析表明, RNA、DNA分别与RNase活性、DNase活性呈显著的负相关, y (RNA) =-3.356 6x (RNase) +11.533 (R=-0.91**), y (DNA) =-0.247 9x (DNase) +0.657 4 (R=-0.98**)。由此可见, 铝胁迫下RNA、DNA含量的下降, 与RNase、DNase活性的提高有关, RNase、DNase活性的提高, 加速了RNA、DNA的分解, 从而导致其含量下降。
|
|
铝胁迫导致龙眼幼苗蛋白质含量下降, 这与其他逆境胁迫如水分胁迫(陈立松等, 1999)、缺镁胁迫(李延等, 2001)、盐胁迫(马翠兰, 2001)、低温胁迫(曾韶西等, 1997)等所得结果相似。铝胁迫下蛋白质含量下降的主要原因有:1)蛋白酶活性的提高使蛋白质水解加剧, 统计分析表明, 可溶性蛋白质与蛋白酶之间呈显著负相关, 相关关系为:y (叶可溶性蛋白质) =-10.411x (叶蛋白酶活性) +26.139 (R=-0.96**), y (根可溶性蛋白质) =-0.338 7x (根蛋白酶活性) +6.408 1 (R=-0.99**)。说明蛋白质含量的下降是由于蛋白酶活性升高而导致蛋白质的水解。2) RNA、DNA含量减少, 使蛋白质合成速率降低, 因为蛋白质的生物合成需要DNA、RNA的参与, DNA、RNA对蛋白质的合成起着重要的作用。叶片可溶性蛋白质与DNA、RNA之间呈极显著的正相关, 相关关系为:y (叶可溶性蛋白质) =58.67x (叶DNA) -11.834 (R=0.96**), y (叶可溶性蛋白质) =3.573 2x (叶RNA) +0.733 7 (R=0.96**)。说明DNA、RNA含量的下降对蛋白质含量的下降也有直接的影响。3)逆境胁迫导致活性氧增加, 膜脂过氧化加剧(肖祥希等, 2003a), 蛋白质合成受到抑制。陈立松等(1999)研究认为MDA、H2O2使蛋白质合成受抑; 李延等(2001)研究表明, 
铝胁迫下龙眼幼苗根水解氨基酸总量增加, 叶片水解氨基酸总量减少。根系水解氨基酸总量增加的可能原因有:1)铝胁迫下蛋白质水解加剧, 游离氨基酸增多; 2)铝胁迫下其他器官游离氨基酸转移到根部; 3)铵态N的同化加剧。根系游离氨基酸增多, 对维持根系细胞膜结构和功能具有一定的作用。胡红青等(1995)对小麦(Triticum aestivum)的研究也证明了这一点, 小麦根系在铝胁迫下, 根系分泌氨基酸的量显著增加。叶片水解氨基酸总量减少的主要原因是铝毒害导致蛋白质合成受阻、蛋白质含量下降所致。在根系中, 脯氨酸、精氨酸、赖氨酸、亮氨酸、蛋氨酸、胱氨酸随铝胁迫浓度的增加而增加, 表现出比较明显的累积效果; 在叶中, 脯氨酸、精氨酸、组氨酸、赖氨酸、缬氨酸、丙氨酸、甘氨酸、谷氨酸、丝氨酸、苏氨酸、天门冬氨酸在低浓度(0.185 mmol·L-1)铝胁迫时含量增加并达到最大值, 而铝浓度 > 0.185 mmol·L-1则随铝处理浓度的增加而减少, 蛋氨酸随铝胁迫浓度的增加而增加。铝胁迫下龙眼叶与根氨基酸的这种变化机制和生理意义尚不十分清楚, 有待于今后进一步研究和探讨。但已有的研究表明, 逆境条件下氨基酸的变化具有一定的生理意义, 如逆境中植物体内大量累积的脯氨酸具有多种生理功能, 作为细胞质渗透调节物质、稳定生物大分子结构、降低细胞酸度、清除活性氧以及作为能量库调节细胞氧化还原势等(Kishor et al., 1995; Smirnoff et al., 1989; Smirnoff et al., 1993; Arora et al., 1995; Saradhi et al., 1995; Alia et al., 1995; Wu et al., 1995)。
铝胁迫干扰龙眼N代谢过程, 主要表现为铝胁迫下龙眼幼苗叶片全N、NR、铵态N下降, 硝态N在低浓度铝胁迫时(≤0.185 mmol·L-1)增加, 而铝浓度 > 0.185 mmol·L-1则表现为逐渐下降的趋势。植物根系可通过对介质中NO3-的吸收, 放出OH-来提高介质的pH, 从而减弱铝的活性, 降低其毒性, 这已为Taylor等(1985)、Foy等(1965)对小麦铝胁迫研究、王建林(1991)对水稻(Oryza sativa)铝胁迫研究所证实。植物受铝毒害时, 具有在NH4+-N存在时而使用NO3--N从而提高介质pH的能力。低浓度铝胁迫下硝态N的累积与低浓度铝刺激根系对硝态N的吸收有关, 这是铝胁迫下龙眼植株自我保护的一种防御机制。至于全N、铵态N和硝态N (Al3+浓度 > 0.185 mmol·L-1时)的下降, 笔者认为:一方面与NR活性下降有关, 因为NR是N代谢的限速酶; 另一方面植株受到伤害后, N的吸收转运受到影响。铵态N下降的另一个可能原因就是铝胁迫下氨同化加剧, 使得游离氨基酸增多, 游离氨基酸对提高细胞液的浓度、降低铝的毒性、维持膜的结构稳定具有一定的作用, 同时可减轻氨的积累造成的植株毒害。
本试验研究还表明, 铝胁迫导致RNA、DNA含量下降。铝对DNA、RNA和许多单核苷酸具有高度的亲和性, 直接或间接地影响DNA和RNA的结构和功能(田仁生等, 1990; 刘东华等, 1995; Kochian, 1995)。用分子筛色谱分析得出Al3+优先与核酸中DNA结合, 增加DNA双螺旋稳定性, 从而阻止DNA复制。Matsumoto根据自己多年的研究工作, 提出了铝抑制DNA转录为RNA过程的可能模型(田仁生等, 1990)。王爱国等(1993)研究表明, 
卞彦, 谈建康, 张纪林. 2000. 钠盐胁迫对小麦叶片中过氧化氢和核酸含量的影响. 南京林业大学学报, 24(3): 65-67. DOI:10.3969/j.issn.1000-2006.2000.03.016 |
陈立松, 刘星辉. 1999. 水分胁迫对荔枝叶片氮和核酸代谢的影响及其与抗旱性的关系. 植物生理学报, 25(1): 49-56. DOI:10.3321/j.issn:1671-3877.1999.01.008 |
陈因.1999.蛋白质氮与非蛋白质氮的测定及氨态氮和硝态氮的测定//中国科学院上海植物生理研究所, 上海市植物生理学会.现代植物生理学实验指南.北京: 科学出版社, 134-140
|
华东师范大学生物系植物生理教研组. 1980. 植物生理学实验指导. 北京: 人民教育出版社, 68-120.
|
胡红青, 黄巧云, 李学垣. 1995. 不同铝浓度对小麦根系分泌氨基酸和糖类的影响. 土壤通报, 26(1): 15-17. |
李美如, 刘鸿先, 王以柔, 等. 1996. 钙对水稻幼苗抗寒性的影响. 植物生理学报, 22(4): 379-384. |
李延, 刘星辉, 庄卫民. 2001. 缺镁胁迫对龙眼苗期氮代谢的影响. 植物营养与肥料学报, 7(2): 218-222. DOI:10.3321/j.issn:1008-505X.2001.02.017 |
刘东华, 蒋悟生. 1995. 铝对植物的毒害. 植物学通报, 12(1): 24-32. |
罗广华, 王爱国, 邵从本, 等. 1989. 高浓度氧对水稻幼苗的伤害与活性氧的防御酶. 中国科学院华南植物研究所集刊, (4): 169-176. |
吕振武, 王建林. 1998. 模拟酸雨对不同植物叶片核酸代谢影响的研究. 西北农业学报, 7(3): 100-101. |
马翠兰.2001.柚对盐胁迫的生理反应及适应性研究.福建农林大学博士学位论文, 67-80
|
田仁生, 刘厚田. 1990. 酸化土壤中铝及其植物毒性. 环境科学, 11(6): 41-46. |
王爱国, 叶发辉, 罗广华. 1993. 活性氧对花生叶片大分子量DNA的损伤. 植物生理学通讯, 29(4): 260-262. |
王建林. 1991. 土壤中铝的胁迫与水稻生长. 土壤, 23(6): 302-306. |
王仁玑, 庄伊美. 1981. 龙眼幼苗缺素试验初报. 亚热带植物通讯, (2): 5-10. |
王万里, 章秀英, 林芝萍. 1986. 水分胁迫对高粱等作物叶片中核糖核酸酶活力的影响. 植物生理学报, 12(1): 16-25. |
西北农业大学植物生理生化教研组. 1987. 植物生理学实验指导. 西安: 陕西科学技术出版社, 35-36.
|
肖祥希, 陈立松, 蔡燕惠, 等. 2005. 铝胁迫对龙眼幼苗营养元素吸收的影响. 江西农业大学学报, 27(2): 230-233. DOI:10.3969/j.issn.1000-2286.2005.02.015 |
肖祥希, 刘星辉, 杨宗武, 等. 2003a. 铝胁迫对龙眼叶片活性氧代谢及膜系统的影响. 林业科学, 39(Sp.1): 52-57. |
肖祥希, 刘星辉, 杨宗武, 等. 2003b. 铝胁迫对龙眼叶和根细胞超微结构的影响. 林业科学, 39(Sp.1): 58-61. |
颜秋生, 李向辉. 1981. 大麦叶肉原生质体培养中核酸酶活性的研究. 植物生理学通讯, (5): 11-12. |
曾韶西, 王以柔. 1997. 不同胁迫预处理提高水稻幼苗抗寒性期间蛋白质的变化. 植物学报, 39(2): 130-136. |
张帆, 罗承德, 张健. 2005. 植物铝胁迫发生机制及其内在缓解途径研究进展. 四川环境, 24(3): 64-68. DOI:10.3969/j.issn.1001-3644.2005.03.019 |
朱广廉, 钟海文, 张爱琴. 1990. 植物生理学实验. 北京: 北京大学出版社, 245-248.
|
Alia, Prasad K V, Saradhi P P. 1995. Effect of zinc on free radicals and proline in Brassica and Cajaxus. Phytochem, 39(1): 45-47. DOI:10.1016/0031-9422(94)00919-K |
Arora S, Saradhi P P. 1995. Light-induced enhancement in proline levels in Vigna radiate exposed to environmental stresses. Aust J Plant Physiol, 22: 383-386. |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Dhindsa R S. 1991. Drought stress, enzymes of glutathione metabolism, oxidation injury, and protein synthesis in Tortula ruralis. Plant Physiol, 95: 648-651. DOI:10.1104/pp.95.2.648 |
Foy C D, Burns G R, Brown J C, et al. 1965. Differential aluminum tolerance of two wheat varieties associated with plant-induced pH changes around their roots. Soil Sci Soc Am Proc, 29: 64-67. DOI:10.2136/sssaj1965.03615995002900010019x |
Kar M, Mishra D. 1977. Protease activity during leaf senescence. Biol Plant, 19: 365-369. DOI:10.1007/BF02922733 |
Kishor P B K, Hong Z L, Miao G H, et al. 1995. Overexpression of Δ1-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants. Plant Physiol, 108: 1387-1394. DOI:10.1104/pp.108.4.1387 |
Kochian L V. 1995. Cellular mechanisms of aluminum toxicity and resistance in plants. Ann Rev Plant Physiol Plant Mol Biol, (46): 237-261. |
Morefield H, Goodman T V, Hamissou M. 2005. The effects of aluminum toxicity on the protein expression of Arabidopsis thaliana. BIOS, 76(2): 84-88. DOI:10.1893/0005-3155(2005)076[0084:RATEOA]2.0.CO;2 |
Saradhi P P, Alia, Arora S, et al. 1995. Proline accumulates in plants exposed to UV radiation and protects them against UV induced peroxidation. Biochem Biophys Res Commun, 209: 1-5. DOI:10.1006/bbrc.1995.1461 |
Sasaki T, Yamamoto Y, Ezaki B, et al. 2004. A wheat gene encoding an aluminum-activated malate transporter. Plant J, 37: 645-653. DOI:10.1111/j.1365-313X.2003.01991.x |
Sasaki T, Ezaki B, Matsumoto H. 2002. A gene encoding multidrug resistance (M DR)-like protein is induced by aluminum and inhibitors of calcium flux in wheat. Plant Cell Physiol, 43(2): 177-185. |
Smirnoff N. 1993. The role of active oxygen in the response of plants to water deficit and desiccation. New Physiol, 125: 27-31. DOI:10.1111/j.1469-8137.1993.tb03863.x |
Smirnoff N, Cumbers Q J. 1989. Hydroxyl radical scavenging activity of compatible solutes. Phytochem, 28: 1057-1062. DOI:10.1016/0031-9422(89)80182-7 |
Taylor G J, Foy C D. 1985. Mechanisms of aluminum tolerance in Triticum aestivum L.(wheat)Ⅰ :Differential pH induced by winter cultivars in nutrient solution. Amer J Bot, 72: 695-701. DOI:10.1002/j.1537-2197.1985.tb08327.x |
Wu J T, Chang S J, Chou T L. 1995. Intracellular proline accumulation in some algae exposed to copper and cadmium. Bot Bull Acad Sin, 36: 89-93. |
Xiao Kai, Bai Guihua, Carver B F. 2005. Nylon filter arrays reveal differential expression of expressed sequence tags in wheat roots under aluminum stress. Journal of Integrative Plant Biology Formerly Acta Botanica Sinica, 47(7): 839-848. |
 2006, Vol. 42
2006, Vol. 42