文章信息
- 孙红梅, 李天来, 李云飞.
- Sun Hongmei, Li Tianlai, Li Yunfei.
- 内源ABA对兰州百合鳞茎顶芽内物质变化的调节作用
- Regulating of Endogenous Abscisic Acid on Subtances Changes in Terminal Bud of Lilium davidii var.unicolor Bulbs
- 林业科学, 2006, 42(10): 19-23.
- Scientia Silvae Sinicae, 2006, 42(10): 19-23.
-
文章历史
- 收稿日期:2005-07-19
-
作者相关文章
百合(Lilium)鳞茎具有自然休眠的特性, 生产中要解决的主要技术问题是提早解除鳞茎休眠或延长鳞茎的休眠期。但迄今为止, 国内外在人工调控百合鳞茎休眠的实用技术方面仍有许多问题需要解决(Gude et al., 2000), 除低温处理以外的其他技术并未实现产业化, 其根本原因是植物的休眠机制尚不明确。而与种子休眠相比, 变态器官的休眠研究更为薄弱, 百合鳞茎的休眠机制研究仍属起步阶段。从20世纪60年代以来, 有关百合小鳞茎离体培养条件方面的报道很多(Hidehiro et al., 2001; Kim et al., 2000), 但鳞茎内, 特别是商品种球鳞茎内物质代谢的研究尚少。Miller等(1993; 1990a;1990b; 1989)曾报道了铁炮百合(L. longiflorum)鳞片内碳水化合物的变化, 指出了低温下除淀粉以外葡甘露聚糖的降解。Shin等(2002)研究了离体小鳞茎低温处理过程中与蔗糖代谢有关酶的变化。Takayama等(1993)以铁炮百合为试材, 通过GC/SIM分析认为休眠百合与发芽百合中ABA的水平差异很小。Djilianov等(1994)采用HPLC/MS方法研究了原产日本的美丽百合(L. speciosum)的离体培养小鳞茎, 也认为ABA含量与小鳞茎的休眠没有相关性。但Gude等(2000)分别对亚洲百合('Connecticut King')、东方百合('Star Gazer')和铁炮百合鳞茎成熟过程中的ABA、可溶性糖、渗透势和呼吸活性进行研究, 根据不同类型百合发育的差异, 指出除铁炮百合外, 鳞茎休眠进程与ABA含量之间有一定关系。产生上述不同结果的原因, 一方面是由于试验材料和产地气候条件的差异, 另外的关键问题是对整个鳞茎而言休眠的主体不明确。鉴于生产体系中最终涉及的还是商品种球, 商品种球内的物质代谢是研究百合休眠问题的重点和难点, 笔者研究了进入休眠和解除休眠阶段百合鳞茎不同部位的碳水化合物、游离氨基酸、酚类物质以及相关酶活性的变化(孙红梅等, 2004a; 2004b; 2004c; 2005), 确定了顶芽是百合鳞茎休眠和休眠解除活动的中心, 但顶芽的发育离不开鳞茎盘和鳞片的物质供应, 这一结果为深入研究百合休眠奠定了基础。本试验在前期工作基础上, 进一步研究了低温解除休眠过程中顶芽内源激素的变化, 并着重分析了内源激素变化与其他物质代谢的相互关系, 以期为明确百合鳞茎的休眠机制提供生理学理论基础。
1 材料与方法试验于沈阳农业大学园艺科研基地进行。选取休眠期较长的兰州百合(Lilium davidii var. unicolor)为试材。2002年4月栽种, 供试土壤为壤土, 其碱解氮为121.85 mg·kg-1, 速效磷(P2O5)为200 mg·kg-1, 速效钾(K2O)为150.54 mg·kg-1, 电导率为0.41 mS·cm-1, pH =7.3, 其他管理措施与一般生产相同。2002年10月待地上植株枯萎以后收获鳞茎, 选取鳞片抱合紧密无损伤、质量为(26 ±1)g的独头鳞茎, 按每10个鳞茎1.5 L的比例与事先消毒、含水量为70 %的锯木屑混合后装入聚乙烯袋, 分别放于2、6、10 ℃的ZPQ -350型智能气候箱贮藏。贮藏过程中于0、34、67、101 d取样, 各处理每次取鳞茎20个, 去除鳞片和鳞茎盘, 将顶芽随机分成3组混合取样, 迅速在液氮中冷冻保存备测。采用酶联免疫(ELISA)法测定内源激素含量, ELISA试剂盒由南京农业大学生产。采用DPS(data processing system)数据处理软件对内源激素、碳水化合物、酚类物质和精氨酸等物质代谢进行逐步回归分析, 得出多元一次回归方程并进行偏相关检验和通径分析。文中数据均为3次重复的平均值。
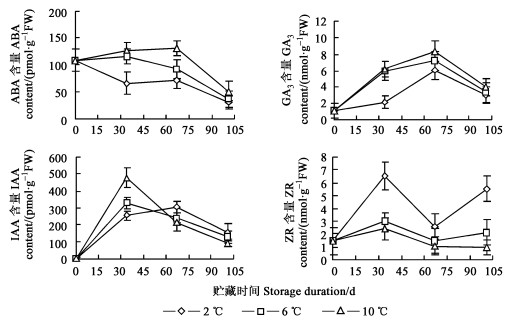
2 结果与分析 2.1 兰州百合鳞茎低温贮藏期间顶芽内源激素的变化由图 1可知, 贮藏101 d范围内, 3种温度处理的ABA含量均呈下降趋势, 但贮藏温度越低, ABA含量下降得越早。GA3和IAA含量呈明显的单峰曲线, GA3含量在处理后67 d出现峰值, 而IAA含量除2 ℃处理的峰值出现在67 d外, 6、10 ℃处理均在34 d时达到最大值。ZR含量在处理初期的34 d升高, 34 d后下降, 67 ~ 101 d范围内, 2、6 ℃处理有所升高。
|
图 1 兰州百合鳞茎低温贮藏期间顶芽内源激素的变化 Fig. 1 Changes of endogenous hormones in terminal buds of L. davidii var. unicolor bulbs stored at different temperatures |
不同温度处理相比较, ABA、GA3含量随处理温度升高而增加, ZR含量变化与之相反。IAA含量在处理初期的34 d随处理温度升高而增大, 67 d后变化趋势相反, 但各温度间相差不大。
2.2 兰州百合鳞茎低温贮藏期间顶芽内源激素比值的变化植物生长发育的调节往往是多种激素综合作用的结果。因此, 进一步比较了低温处理过程中各种内源激素比值的变化。结果表明, GA3/ABA在101 d范围内呈直线上升趋势, IAA/ABA则在0 ~ 34 d显著增加, ZR/ABA在低温处理期间呈增大趋势, 但6、10 ℃处理的变化不明显, 且上述3种比值均随贮藏温度降低而增大。GA3/IAA和ZR/IAA在处理初期的34 d内急剧下降, 34 d后变化很小, 整个处理过程中温度处理之间差异甚微。GA3/ZR在处理101 d范围内有明显升高的过程, 峰值出现在67 d, 且随处理温度下降而下降。
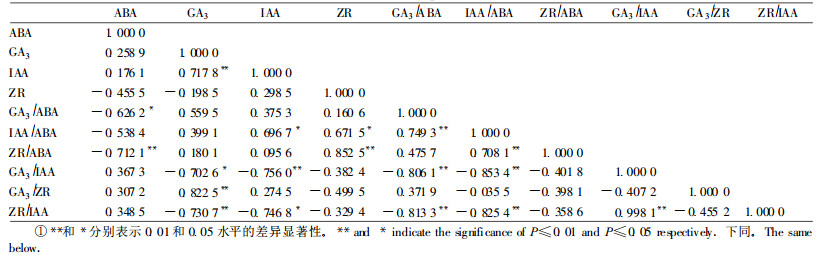
2.3 兰州百合鳞茎低温贮藏期间顶芽内源激素的相关分析进一步分析了4种激素及其比值的相关性。从表 1可以看出, 顶芽中的4种内源激素, 除IAA与GA3极显著正相关外, 其他各激素之间并无显著相关性, 但一些激素的比值之间却存在显著或极显著的相关关系, 说明4种内源激素之间存在复杂的互作, 这或许是外源施用植物生长调节剂处理种球效果并不明显、结果不尽一致(Hidehiro et al., 2001; Yoshiji, 1988)的重要原因。
|
|
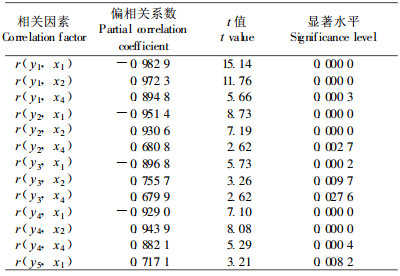
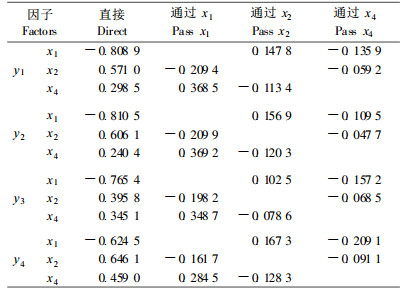
植物体内糖类含量的变化是低温条件下植物代谢较为敏感的生理指标之一(Miller et al., 1990a), 酚类物质也与植物组织的生长发育及代谢活动密切相关(陈伟等, 1997)。笔者前期工作表明, 低温解除休眠过程中, 鳞茎内可溶性糖和酚类物质含量显著增加, 淀粉酶和苯丙氨酸解氨酶(PAL)活性增大是产生上述变化的关键因素。作为生命物质基础的氨基酸在植物的生长发育中有重要作用, 百合鳞茎的游离氨基酸主要集中在顶芽, 其中含量最高、变化最大的是精氨酸(孙红梅等, 2004b), 占顶芽内氨基酸总量的50 %以上。为明确各种物质代谢的关系, 进一步对淀粉酶、总可溶性糖、PAL、酚类物质以及精氨酸等关键指标的变化与4种内源激素含量变化进行逐步回归分析。从表 2的逐步回归方程可知, 顶芽内淀粉酶活性、总可溶性糖含量、PAL活性、酚类物质含量均与顶芽内的ABA含量极显著负相关, 而与GA3含量和ZR含量呈极显著正相关关系。由于4种内源激素之间存在互作(表 1), 为正确分析各种内源激素与其他指标之间的真实关系, 对上述结果进行了偏相关检验(表 3), 结果表明所得方程均真实可信。通径分析(表 4)的结果表明, ABA的负效应是最关键的因素, 其次是GA3的正效应, 而ZR的贡献率则相对较小, 因此, 可以推断内源ABA是抑制顶芽萌发的主要因子。
|
|
|
|
|
|
顶芽的精氨酸含量随贮藏温度的升高而增加(孙红梅等, 2004b)。从顶芽内精氨酸含量与ABA含量极显著正相关可知, 较高的ABA可能抑制了精氨酸的进一步代谢。
3 讨论自1935年首次发现赤霉素(gibberellin acid, GA)、1961年首次发现脱落酸(abscisic acid, ABA)以来, 人们对它们在植物休眠领域的生理作用进行了不懈的探索。前人的研究成果表明, GA3和ABA是对休眠有重要作用的2种激素(李宗霆等, 1996), GA3能打破种子休眠, 与其诱导水解酶的合成和促进水解酶的分泌有关; 而ABA诱导种子休眠与其抑制水解酶的合成有关, 受GA和ABA双重调节的α-淀粉酶基因已被鉴定和克隆(李宗霆等, 1996), 但这一系列研究都是以谷类作物种子糊粉层系统作试材的, 对于多年生树种, 迄今尚未能确证内源ABA水平与芽休眠之间存在相关性(Faust et al., 1997), 变态器官的休眠研究则更加薄弱。综合分析20世纪50年代至今国内外百合方面的文献, 可以看出绝大多数研究都是以铁炮百合为试材的, 但由于这类百合休眠并不明显, 研究休眠问题不是最佳材料, 也影响结果的可靠性。本研究选用原产中国、休眠期极长的兰州百合为试材, 结果表明, 在休眠的主体部位———顶芽中, GA3和ABA并无任何相关性。通过分析淀粉酶活性与上述2种激素的关系可知, ABA的负效应是最关键的因素, 其次是GA3的正效应, 这说明百合鳞茎低温解除休眠活动中, 在顶芽这个淀粉含量较低(孙红梅等, 2004a)的部位, GA3并不是淀粉酶活性增加的必须因素。
低温处理过程中, ABA、GA3、IAA、ZR 4种内源激素含量及其比值都发生了明显变化, 尤其在处理初期的34 d内变化最为显著, 这与顶芽在此期间迅速萌动、其他物质代谢也较为剧烈的结果一致(孙红梅等, 2004a; 2004b; 2004c)。但从鳞茎发芽以及栽种后植株生长情况来看, 低温贮藏34 d的鳞茎发芽所需时间较长, 且种植后长势很弱以至于不能出苗, 个别出苗的植株呈现莲座(rosette)状, 说明此期间并没有完全满足鳞茎解除休眠对于低温的要求。在101 d范围内, 随着处理温度的降低和处理时间延长, 百合种球出苗及采收的一致性增强, 植株生物量增加(孙红梅等, 2004a), 说明百合鳞茎萌发以及正常生长要求物质流达到一定强度。
综合本试验和前期研究结果, 笔者认为低温解除百合鳞茎休眠的可能机理在于:低温使顶芽内ABA等抑制物质含量下降, GA3含量有所增加, 导致GA3/ABA的比值升高, 从而使顶芽内的“库”强增大, 这是顶芽能够萌发的关键所在。同时低温导致顶芽内淀粉酶活性提高使淀粉降解加快, 充足的可溶性糖供应是顶芽萌动和继续伸长的重要条件。PAL活性提高导致酚类物质含量增加促进了顶芽的萌发, 但精氨酸的代谢去向有待于深入研究。
陈伟, 叶明志, 周洁. 1997. 植物酚类物质研究进展. 福建农业大学学报, 26(4): 502-508. |
李宗霆, 周燮. 1996. 植物激素及其免疫检测技术. 南京: 江苏科学技术出版社, 179.
|
孙红梅, 李天来, 李云飞. 2005. 百合鳞茎发育过程中碳水化合物含量及淀粉酶活性变化. 植物研究, 25(1): 59-63. |
孙红梅, 李天来, 李云飞. 2004a. 不同贮藏温度下兰州百合种球淀粉代谢与萌发关系初探. 园艺学报, 31(3): 337-342. |
孙红梅, 李天来, 李云飞. 2004b. 百合鳞茎低温贮藏期间游离氨基酸含量及组分变化. 植物生理学通讯, 40(4): 414-418. |
孙红梅, 李天来, 李云飞. 2004c. 百合鳞茎低温解除休眠过程中酚类物质含量及相关酶活性变化. 中国农业科学, 37(11): 1777-1782. |
Djilianov D, Gerrits M M, Ivanova A. 1994. ABA content and sensitivity during the development of dormancy in lily bulblets regenerated in vitro. Physiologia Plantarum, 91(4): 639-644. |
Faust M, Erez A, Rowland L J. 1997. Bud dormancy in perennial fruit trees:Physiological basis for dormancy induction, maintenance, and release. HortScience, 32(4): 623-629. DOI:10.21273/HORTSCI.32.4.623 |
Gude H, Verbruggen J, Franssen J. 2000. Physiological markers for lily bulb maturity. Acta Horticulturae, 517: 343-350. |
Hidehiro N, Shigeaki A. 2001. Breaking dormancy in micropropagated bulblets of Lilium japonicum using Gibberellic Acid4. Journal of the Japanese Society for Horticultural Science, 70(4): 522-524. DOI:10.2503/jjshs.70.522 |
Kim E Y, Choi J D, Park K I. 2000. Production of non-dormant bulblets of Lilium Oriental Hybrid by control of culture temperature and growth regulators in vitro. Journal of the Korean Society for Horticultural Science, 41(1): 78-82. |
Miller W B, Hammer P A, Kirk T I. 1993. Reversed greenhouse temperature alter carbohydrate status in Lilium longiflorum Thunb. " Nellie White".Journal of the America Society for Horticultural Science, 118(6): 736-740. DOI:10.21273/JASHS.118.6.736 |
Miller W B, Langhans R W. 1990a. Low temperature alters carbohydrate metabolism in Easter lily bulbs. HortScience, 25(4): 463-465. |
Miller W B. 1990b. Localization of reserve mobilization during scalet formation on Easter lily scales. Acta Horticulturae, 266: 95-100. |
Miller W B, Langhans R W. 1989. Carbohydrate changes of Easter lilies during growth in normal and reduced irradiance environments. Journal of the America Society for Horticultural Science, 114(2): 310-315. |
Shin K S, Chakrabarty D, Paek K Y. 2002. Sprouting rate, change of carbohydrate contents and related enzymes during cold treatment of lily bulblets regenerated in vitro. Scientia Horticulturae, 96: 195-204. DOI:10.1016/S0304-4238(02)00087-0 |
Takayama T, Toyomasu T, Yamane H. 1993. Identification of gibberellins and abscisic acid in bulbs of Lilium elegans Thunb.and their quantitative changes during cold treatment and subsequent cultivation. Journal of the Japanese Society for Horticultural Science, 63(2): 189-196. |
Yoshiji N. 1988. Effects of chilling and GAS-treatments on breaking dormancy in Lilium rubellum Baker bulblets cultured in vitro. Journal of the Japanese Society for Horticultural Science, 57(2): 250-257. DOI:10.2503/jjshs.57.250 |
 2006, Vol. 42
2006, Vol. 42