文章信息
- 张晓英, 王华芳, 朱祯, 王天祥, 尹伟伦.
- Zhang Xiaoying, Wang Huafang, Zhu Zhen, Wang Tianxiang, Yin Weilun.
- 国槐离体再生及抗虫基因sck的转导
- In Vitro Regeneration and Agrobacterium Transformation of Sophora japonica with sck Gene
- 林业科学, 2006, 42(9): 34-38.
- Scientia Silvae Sinicae, 2006, 42(9): 34-38.
-
文章历史
- 收稿日期:2005-03-10
-
作者相关文章
2. 中国科学院遗传与发育生物学研究所 北京 100101
2. Institute of Genetics and Developmental Biology, Chinese Academy of Sciences Beijing 100101
国槐(Sophora japonica)原产中国北方(陈嵘, 1957), 为华北、西北地区城乡重要的绿化树种。但是国槐的害虫种类甚多, 初步统计有14种以上(弗林特等, 1985), 槐尺蠖(Semiothisa cinerearia)的危害较大。大量施用化学杀虫剂, 不仅对人、畜、树木的正常生长构成了威胁, 而且造成了“虫-药”双重的环境污染。随着植物生物技术的日益发展, 通过基因工程手段导入外源抗虫基因培育国槐抗虫新品系成为可能。豇豆胰蛋白酶抑制剂(cowpea trypsin inhibitor, CpTI)属丝氨酸蛋白酶抑制剂类型, 是一种重要的抗虫蛋白, 对大部分鳞翅目害虫有抑制作用, 目前已经导入杨树中(郝贵霞等, 2001), 并且证明具有一定的抗虫效果。
20世纪80年代初期, 陈维伦等(1982)首次报道了通过国槐子叶及胚轴的培养来获得不定芽; 之后王喆之等(1993a;1993b;1997)先后通过胚胎发生、花药培养等手段获得再生植株。但是, 关于国槐抗虫转基因的研究, 国内外未见成功的报道。本文筛选出了繁殖系数较高的叶片再生体系, 利用根癌农杆菌介导法成功地将经过修饰的豇豆胰蛋白酶抑制剂基因sck导入国槐, 获得了再生植株, 并对其进行分子鉴定。
1 材料与方法 1.1 材料所用植物材料取自北京林业大学植物生物技术学科实验室。无菌苗由国槐种子(购自北京市种苗站)萌发, 在附加6-BA 1.0 mg·L-1和IAA 0.1 mg·L-1的MS(Murashige et al., 1962)培养基上进一步继代繁殖得来, 苗高均为1.0 cm以上。
根癌土壤农杆菌(Agrobacterium tumefaciens)LBA4404携带的质粒pBinΩSCK含修饰的豇豆胰蛋白酶抑制剂(CpTI)基因sck, 由中国科学院遗传与发育生物学研究所601组实验室构建(刘春明等, 1993), 主要结构为Ubi-Signal-CpTI-KDEL-Tnos(图 1)。

|
图 1 pBinΩSCK质粒结构 Fig. 1 Diagram of plasmid pBinΩSCK |
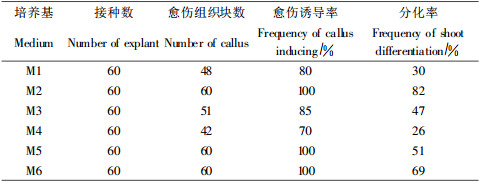
从无菌苗上摘取较幼嫩健康的叶片(带叶柄), 接种在含不同浓度不同激素组合的固体培养基上, 基本培养基为MS, 根据预备试验和相关资料, 分别附加IAA(0.05, 0.1 mg·L-1), 6-BA(1, 3, 5 mg·L-1)和2, 4-D (0.05, 0.1 mg·L-1)。通过随机区组试验, 设计了6组试验, 即M1: MS+BA 1.0 mg·L-1+IAA 0.1 mg·L-1; M2: MS+BA 3.0 mg·L-1+IAA 0.05 mg·L-1; M3: MS+BA 5.0 mg·L-1+IAA 0.1 mg·L-1; M4: MS+BA 1.0 mg·L-1+2, 4-D0.05 mg·L-1; M5: MS+BA 3.0 mg·L-1+2, 4-D 0.1 mg·L-1; M6: MS+BA 5.0 mg·L-1+2, 4-D 0.1 mg·L-1。3种不同浓度的激素, 蔗糖为3%, 琼脂粉0.6%, pH值为5.8, 培养温度为22~26 ℃, 光照强度为1 500~2 000 lx, 前期遮光培养直至外植体完全愈伤化, 再按每日13~14 h的光照培养, 每月继代1次。培养50 d后统计结果。详细结果见表 1。本试验中不定芽高度超过0.2 cm的为有效统计芽。计算愈伤诱导率及不定芽分化率公式如下:愈伤诱导率=(产生愈伤的外植体数/接种外植体数)×100%;不定芽分化率= (不定芽数/愈伤组织总块数)×100%。
|
|
将获得的不定芽在MS+BA 0.5 mg·L-1+IAA 0.05 mg·L-1上进一步伸长培养, 将高为2 cm以上的不定芽切下接种在生根培养基1/2MS+IBA 1.0 mg·L-1上进行生根培养, 培养条件为光照16 h, 温度25 ℃。当植株长至5~10 cm时可进行移栽。
1.2.2 抗生素临界浓度筛选由于所构建的植物表达载体携带有新霉素磷酸转移酶(NpT Ⅱ)基因, 它编码的产物对某些氨基酸糖苷类抗生素, 例如卡那霉素(kanamycin, Km)和遗传霉素(geneticin, G418)等具有抗性。因此, 本试验以Km和G418为筛选试剂选择转化细胞。为了确定国槐对这2种抗生素的本底抗性, 将叶片接种于分别附加卡那霉素0、30、50、70、100、150 mg·L-1和遗传霉素0、4、8、10、12、16 mg·L-1的改良MS培养基上培养, 每一种浓度重复5次, 每皿16个外植体, 培养温度为(23 ±2)℃。30 d后统计出愈和分化情况。
1.2.3 农杆菌培养将根癌农杆菌菌种pBinΩSCK划线培养于含50 mg·L-1利福霉素(Rif)和50 mg·L-1卡那霉素(Km)的YEB平板上, 置于28 ℃恒温培养箱培养2 d。从平板上挑取单菌落, 加入含Rif 50 mg·L-1、Km 50 mg·L-1的YEB液体培养基中, 28 ℃180~200 r·min-1振荡培养过夜。次日早晨取以2%的接种量转接于20 mL新鲜的YEB液体培养基中, 加入50 mg·L-120μL乙酰丁香酮(3, 5-dimethoxy-4-hydro xyaceto phenone, AS), 继续振荡培养3~5 h, 当菌液OD600为0.5左右时即可用于转化。
1.2.4 抗虫基因转化取生长健壮的无菌苗叶片, 放在预培养培养基上预培养2~3 d, 然后在菌液中浸染10~15 min, 取出叶片, 用无菌滤纸吸干后, 转入覆有一层无菌滤纸的共培养培养基(MS+BA 3.0~5.0 mg·L-1+IAA 0.05~0.1 mg·L-1+AS 100μmol·L-1)中, 于25 ℃遮光培养2~3 d后, 将叶片转入筛选培养基(MS +BA 3.0~5.0 mg·L-1+IAA 0.05~0.1 mg·L-1+G418 8 mg·L-1+Cef 500 mg·L-1)中, 25 ℃的条件下光培养。经过伸长培养和生根培养, 获得完整的转化植株。
1.2.5 PCR检测以转化的国槐再生植株叶片为材料, 用改良CTAB法提取基因组总DNA(Porebski et al., 1997)。参照sck基因全长设计引物:
5′端为5′AAAATGAAGAGCACCATCTTC 3′
3′端为5′TCTAGAGTTCATCTTTCTCATCATC 3′
在25μL总反应体系中加入基因组总DNA各0.1μg为模板, 引物浓度均为0.4 pmol, dNTP各200μmol, Taq聚合酶1U。反应程序为: 95 ℃预变性5 min, 后94 ℃变性1 min, 55 ℃退火1 min, 72 ℃延伸1 min, 36个循环后在72 ℃继续延伸10 min。反应完后取样10μL在1.0%的琼脂糖凝胶上进行电泳检查。
2 结果与分析 2.1 外植体愈伤组织的诱导和分化将叶片接种在M1 —M6号分化培养基上, 黑暗条件下培养7~10 d后即皱折、肥大、发黄, 30 d后开始出现不定芽。芽多从叶柄和叶缘上长出。6组试验结果见表 1。
6-BA浓度较大时, 有利于国槐叶片愈伤的诱导和不定芽分化。在分别附加IAA和2, 4-D的培养基上生长情况不同:在含IAA的培养基上, 叶片先是完全愈伤化, 20 d后, 愈伤组织上出现绿色密集芽点, 更换新鲜培养基后分化加快, 30 d后, 形成大量无根苗; 在含2, 4-D的培养基上, 1周后叶片肿胀卷曲, 叶柄处产生少量绿色愈伤组织, 培养25 d时叶柄处萌发出3~5个不定芽, 转移到继代培养基中进行光培养以使不定芽伸长成苗。
在M2培养基上, 不定芽分化频率最高达到82%;而6-BA与2, 4-D的组合中最高的分化率仅为69%, 而且诱导周期较长。因此, 选择M2培养基(MS+6-BA 3 mg·L-1+IAA 0.05 mg·L-1)诱导国槐叶片不定芽发生。这同王喆之等(1997)的研究结果不一致, 可能是树种不同的基因型所导致。
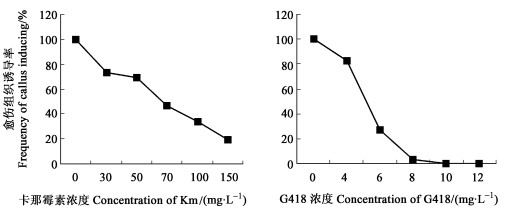
2.2 抗虫基因转化 2.2.1 抗生素临界浓度由于所构建的植物表达载体携带有新霉素磷酸转移酶(NpT Ⅱ)基因npt Ⅱ, 该基因产物对一系列含有氨基糖苷键的抗生素有解毒作用(Bevan et al., 1983), 如新霉素(neomycin)、卡那霉素、遗传霉素, 筛选中常用卡那霉素和遗传霉素。如果目的基因已导入国槐, 再生植株能在含相应抗生素的培养基上生长, 因此在做以农杆菌介导为途径的遗传转化之前必须对它们的使用浓度进行探讨, 以筛选转化植株。结果见图 2。
|
图 2 不同浓度的卡那霉素和G418对叶片培养的影响 Fig. 2 Effect of Km and G418 on induction of leaf |
图 2表明, 卡那霉素浓度低于150 mg·L-1时并没有完全抑制叶片的愈伤化, 考虑到较高浓度的卡那霉素可能会引诱植株产生突变, 本试验没有采用更高的浓度作进一步试验。而遗传霉素的添加明显抑制了愈伤组织的形成, 在不含遗传霉素的培养基上, 茎段2周后就开始形成愈伤组织, 3周时出愈率已达86%。随着遗传霉素的添加和浓度的提高, 外植体形成愈伤组织的时间推迟, 出愈率降低。当添加浓度超过8 mg·L-1时, 外植体开始有死亡现象, 且随着培养时间的延长, 死亡率急剧上升。由此说明国槐叶片对卡那霉素不敏感, 而可以将侵染的叶片置于含有8 mg·L-1遗传霉素培养基中进行筛选培养, 可初步证明外源基因是否已导入国槐中。
2.2.2 转化植株的获得未侵染的对照外植体(图版Ⅰ-1)接种在不含抗生素的培养基上, 暗培养15~20 d后就有淡黄绿色愈伤组织产生, 并且继续培养一段时间后愈伤组织就分化出不定芽。而经过农杆菌侵染的外植体暗培养15~20 d后只有少部分产生愈伤组织, 继续培养大多数外植体逐渐死亡, 极少量愈伤组织分化出小芽(图版Ⅰ-2)。未经农杆菌侵染的外植体在筛选培养基上培养一段时间后变黄死亡(图版Ⅰ-3)。待获得的抗性芽(图版Ⅰ-4)长至2~3 cm时(图版Ⅰ-5), 切下转移至含遗传霉素10 mg·L-1的生根培养基中, 约20 d后抗性小苗生出根(图版Ⅰ-6), 发育成完整的再生植株。

|
图版Ⅰ Plate Ⅰ |
对所获得的转化株系分别从叶片分化不定芽能力、试管苗继代生长能力和试管苗生根能力3个方面检测转化植株的G418抗性: 1)未转化植株叶片在含8 mg·L-1G418的选择再生培养基上变黄, 不形成愈伤组织(图版Ⅰ-3); 而转化植株叶片在含8 mg·L-1G418的选择培养基上可形成愈伤组织, 并分化出不定芽(图版Ⅰ-2)。2)将转化芽和非转化芽同时接种在含8 mg·L-1G418的继代培养基上, 未转化芽生长一段时间变黄, 然后变白死亡; 而转化芽均能连续增殖。3)未转化植株幼苗在无G418的生根培养基上正常生根, 生根率达100%(图版Ⅰ-6), 未转化植株幼苗在附加8 mg·L-1G418生根培养基上完全不能生根。由于G418能有效地抑制植株离体生根能力, 所以通常以植株在含G418的培养基中能否正常生根作为鉴定植物携带外源npt Ⅱ基因的一个重要标志。
2.3 转化植株检测从抗性植株提取基因组DNA, 以质粒pBinΩSCK作为阳性对照, 以未转基因植株作为阴性对照, 进行PCR扩增。电泳检测结果如图 3所示。未转化植株基因组未出现PCR扩增片段, 转基因的植株经PCR扩增, 得到1条和预期长度一样大小的415 bp的片段。

|
图 3 转基因植株PCR分析 Fig. 3 PCR analysis of transgenic plant 1.未转化植株Non-transgenic plant; 2.质粒Plasmid DNA; 3~9.转化植株Transgenic plants. |
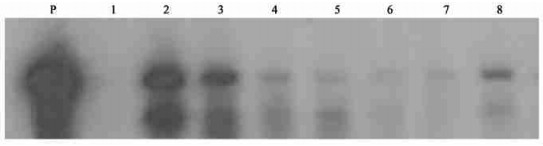
为了进一步证明外源基因在植物细胞中的整合情况, 分别从PCR检测为阳性的转基因植株中随机选择7株, 用HindⅢ酶切植物总DNA, sck基因片段作探针, 进行Southern blotting杂交分析, 结果表明, 5株转基因植株均获得了明显的杂交信号, 而非转化对照基因组中未出现任何杂交信号(图 4), 进而证实了sck基因已整合进国槐的基因组中。
|
图 4 国槐转sck基因植株的Southern blotting分析 Fig. 4 Southern assay of sck gene in transgenic plants P.质粒pBinΩSCK/HindⅢ作为阳性对照pBinΩSCK was digested by HindⅢ as positive control; 1.非转基因植株基因组DNA用HindⅢ酶切Non-transgenic control plant, genomic DNA was digested with HindⅢ; 2~ 8.转基因植株基因组DNA用HindⅢ酶切Transgenic plants, genomic DNA was digested with HindⅢ. |
在前人的工作基础和前期大量试验的基础上, 建立了国槐高效稳定的再生和基因转化体系: 1)再生体系:幼嫩叶片→在MS+BA 3.0 mg·L-1+IAA 0.05 mg·L-1遮光培养6周→获得大量不定芽→切取不定芽在1/2MS+IBA 1.0 mg·L-1生根培养→完整植株; 2)转化体系:幼嫩叶片→农杆菌侵染→MS+BA 3.0 mg·L-1+IAA 0.05 mg·L-1+AS 100μmol·L-1共培养3 d→MS+BA 3.0 mg·L-1+IAA 0.05 mg·L-1+G418 8 mg·L-1+Cef 500 mg·L-1筛选培养→获得不定芽→在1/2MS+IBA 1.0 mg·L-1+G418 10 mg·L-1+Cef 100 mg·L-1生根培养→分子生物学检测。
NpT Ⅱ是目前较广泛使用的选择标记, 它赋予植物卡那霉素抗性。但是具此抗性的抗生素种类较多, 不同种类抗生素对不同植物的选择效果也有差异。本试验在含有G418和Km的培养基上分别进行了抗生素临界浓度试验, 结果发现, 国槐对G418较Km敏感, 从试验成本考虑, 选择G418来筛选转化植株。但是用较大浓度的Km来筛选的结果是否如前所述会引起植株突变, 或影响植株再生等问题, 有待于进一步研究。
国槐的遗传转化体系中, 有诸多影响因素, 如国槐再生苗的玻璃化问题, 不同属性的农杆菌对转化效率的影响, 以及对农杆菌采取的必要的诱导处理, 包括培养条件, 接菌的浓度、时间和AS的利用(George et al., 1986)等, 这些因素在提高国槐转化频率及转化植株再生方面的研究, 将在另文报道。
陈嵘. 1957. 中国树木分类学. 北京: 科学出版社.
|
陈维伦, 郭东红. 1982. 国槐子叶和下胚轴外植体上芽的形成. 植物杂志, (1): 19. |
弗林特M L, 范德博希R. 1985.害虫综合治理导论.曹骥, 赵修复, 译.北京: 科学出版社
|
郝贵霞, 朱祯, 朱之悌. 2001. 转CpTI基因毛白杨的获得. 林业科学, 37(1): 117-119. DOI:10.3321/j.issn:1001-7488.2001.01.018 |
刘春明, 朱祯, 周兆斓, 等. 1993. 豇豆胰蛋白酶抑制剂cDNA在大肠杆菌中的克隆和表达. 生物工程学, (9): 152-157. |
王喆之, 李克勤, 刘全宏, 等. 1993a. 槐树子叶组织培养中的形态发生研究. 实验生物学报, 26(3): 39-49. |
王喆之, 李克勤, 刘全宏, 等. 1993b. 槐树花药培养并获得单倍体植株. 科学通报, 38(1): 266-269. |
王喆之, 胡正海. 1997. 国槐组织细胞培养的研究. 西北植物学报, 17(5): 1-6. DOI:10.3321/j.issn:1000-4025.1997.05.001 |
Bevan M V, Flavell R B, Chilton M D. 1983. A chimaeric antibiotic resistance gene as a selectable marker for plant cell transformation. Nature, 294: 184-187. |
George W B, Eugene W, Nester E W. 1986. Plant phenolic compounds induce expression of the Agrobacterium tumefaciens loci needed for virulence. Science, 232: 983-985. DOI:10.1126/science.3085219 |
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant, 15: 473-497. DOI:10.1111/j.1399-3054.1962.tb08052.x |
Porebski S, Bailey G, Baum B R. 1997. Modification of CTAB DNA extraction protocl for plants containing high polysaccharide and polyphenol components. Plant M ol Biol Rep, 15: 8-15. DOI:10.1007/BF02772108 |
 2006, Vol. 42
2006, Vol. 42