文章信息
- 席梦利, 施季森.
- Xi Mengli, Shi Jisen.
- 杉木成熟合子胚器官发生和体胚发生
- Organogenesis and Somatic Embryogenesis from Mature Zygotic Embryos of Cunninghamia lanceolata
- 林业科学, 2006, 42(9): 29-33.
- Scientia Silvae Sinicae, 2006, 42(9): 29-33.
-
文章历史
- 收稿日期:2005-07-26
-
作者相关文章
针叶树的离体培养和植株再生是植物组织培养研究中难度较大的一个领域。随着人类环境保护意识的增强和对发展无性系育林业的重视, 在过去的30~40年里, 世界各国对针叶树的组织培养工作给予了特别的关注, 该领域的研究也取得了重要进展。目前, 已有40余种针叶树通过直接器官发生产生了不定芽, 国内外已从冷杉属(Abies)、落叶松属(Larix)、云杉属(Picea)、松属(Pinus)、黄杉属(Pseudotsuga)和红杉属(Sequoia)的40多种针叶树培养产生了体细胞胚, 该领域的研究主要集中在云杉属和松属(黄健秋等, 1994; 1995a; 1995b; 1995c;唐巍等, 1996; 1997a; 1997b;杨金玲等, 1997; 1999)。
杉木(Cunninghamia lanceolata)是我国特有的常绿针叶树种之一。杉木生长快、木材纹理直、结构细、耐腐力强, 又因其萌芽力强、成林迅速, 故成为重要的商品用材和造林树种。我国杉木人工林面积约30亿hm2, 年产木材占全国商品材的1/4, 杉木与国计民生关系极为密切。有关杉木组培快繁方面的研究已有文献报道, 但主要以幼树或成年树的嫩枝为试验材料(阙国宁, 1980; 朱鹿鸣等, 1980), 杉木成熟合子胚器官发生和体胚发生的研究国内外未见报道。本文系统地研究了基本培养基、不同种类的细胞分裂素对器官发生和体胚发生及不定芽生根的影响, 并用石蜡切片法观察了不定芽和体胚的发生和发育过程。
1 材料与方法 1.1 试验材料以福建第2代遗传改良种子园当年收获的优良种子的成熟合子胚为起始外植体, 种子使用前在4 ℃冰箱中冷藏保存。
1.2 试验方法 1.2.1 消毒与接种成熟种子, 吸水膨胀后剥去外种皮, 在超净工作台上用75%酒精浸泡1 min, 0.1% HgCl2浸泡15 min, 无菌水冲洗5~6次, 无菌条件下剥出合子胚接种于诱导培养基上, 每个处理接种5瓶, 每瓶接种10个胚。
1.2.2 培养基与培养条件不定芽和体胚的诱导培养基:选用MS(Murashige and Skoog, 1962)、1/2MS、DCR (Gupta and Durzan, 1985)、GD(Gresshoff and Doy, 1972)4种基本培养基。激素浓度范围: 6-BA 0~2.5 mg·L-1, ZT 0~2.5 mg·L-1, TDZ 0~0.004 mg·L-1, NAA 0.1 mg·L-1。琼脂0.65%, 蔗糖2%, pH值5.8。
不定芽的伸长和体胚萌发培养基:不添加植物激素的DCR基本培养基, 琼脂0.65%, 蔗糖2%, pH值5.8。
不定芽的生根培养基:选用MS、1/2MS、1/4MS 3种基本培养基, 附加IBA 0~0.2 mg·L-1, NAA 0~0.2 mg·L-1。蔗糖2%, 琼脂0.6%, pH值5.8。
采用光照培养, 每天光照(2 000 lx) 14 h, 培养温度23~25 ℃。
1.2.3 数据统计方法不定芽的诱导频率(%)=长出不定芽的外植体数接种的外植体数×100%;体胚的诱导频率(%)=长出体胚的外植体数接种的外植体数×100%;诱导的平均不定芽数=不定芽的总数诱导出不定芽的外植体数; 不定芽的形成能力(bud forming capacity, BFC)=平均不定芽数×不定芽的诱导频率(Mathur et al., 1999)。
不定根的诱导频率(%)=长出不定根的不定芽数/接种不定芽数×100%;平均不定根数=不定根的总数/诱导出不定根的不定芽数。不定根的形成能力(root forming capacity, RFC)=平均不定根数×不定根的诱导频率。
每个因子的试验重复3次, 最终的数据为3次重复的平均值。
1.2.4 石蜡切片方法选取带有不定芽原基和不同发育阶段体胚的合子胚, 用锋利的单面刀片切割成0.2 cm×0.2 cm×0.2 cm的材料块。FAA(70%)固定, 正丁醇逐级脱水, 石蜡透入包埋, 常规石蜡切片, 切片厚度8~10μm。番红-固绿对染, 显微镜下观察照相。
2 结果与分析 2.1 不定芽和体胚的诱导 2.1.1 基本培养基对不定芽和体胚发生的影响成熟合子胚接种于添加6-BA 1.0 mg·L-1、NAA 0.1 mg·L-1的MS、1/2MS、DCR、GD培养基上, 接种6 d后, 不同培养基上的胚均膨大。15 d后, 接种于MS、1/2MS培养基上的合子胚变红、开始愈伤化, 35 d后, 形成疏松的红褐色愈伤组织, 1/2MS培养基上的愈伤组织较MS上的生长量大。45 d后红色愈伤组织开始干枯, 没有观察到不定芽和体细胞胚胎发生; 接种15 d以后, DCR、GD培养基上的合子胚继续膨大, 25 d后部分胚的子叶顶端及表面分化出不定芽, 35 d后, 观察到子叶表面有体细胞胚胎发生。统计分析后发现, DCR培养基上体胚诱导频率、不定芽诱导频率、平均不定芽数和不定芽形成能力均明显高于GD培养基(表 1), 说明DCR基本培养基最适于诱导不定芽和体胚发生。
|
|
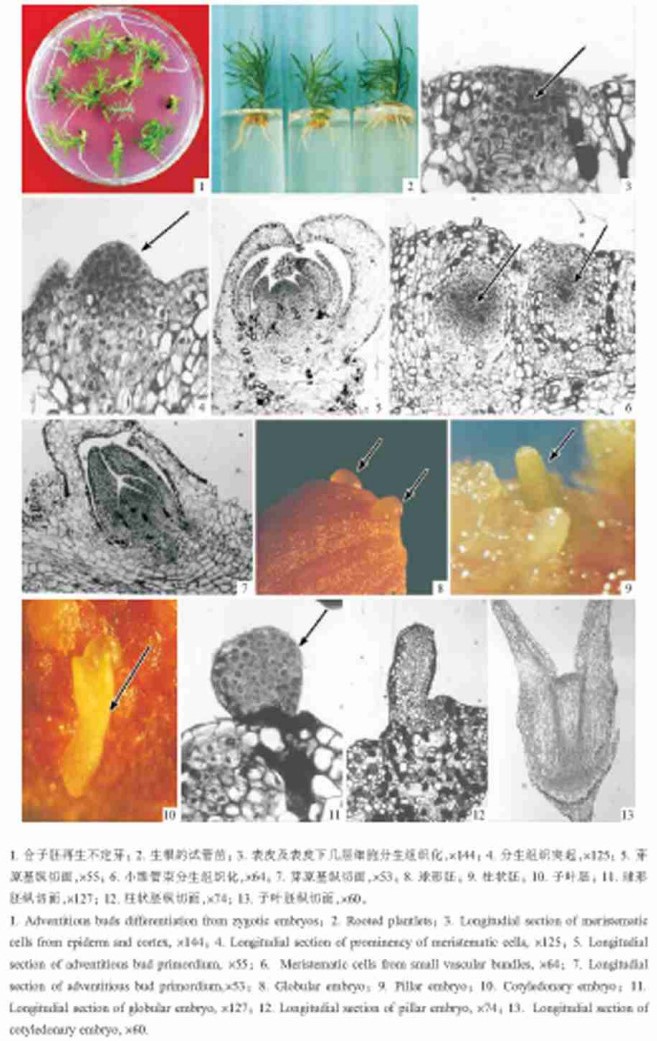
成熟合子胚接种于附加6-BA 0.5~2.5 mg·L-1、NAA 0.1 mg ·L-1的DCR培养基上。10 d后, 合子胚开始膨大。15 d后, 可观察到合子胚的子叶表面和顶端出现小突起, 这些小突起为不定芽原基, 不定芽原基进一步发育成形态可辨的不定芽(图版Ⅰ-1)。35 d后, 合子胚上有不同时期的体细胞胚胎发生, 解剖镜下观察发现, 发育早期的体细胞胚呈球形(图版Ⅰ-8), 进一步发育成一圆柱体(图版Ⅰ-9), 发育后期的体细胞胚胎有2片典型的子叶、胚轴和胚根(图版Ⅰ-10)。统计分析后发现, 6-BA浓度在0.5~2.0 mg·L-1范围内变动时, 成熟合子胚的体细胞胚胎诱导频率随着6-BA浓度的升高而提高(表 2), 6-BA浓度为2 mg·L-1时, 体胚诱导频率最高, 达7.3%。6-BA浓度在0.5~1.5 mg·L-1时, 成熟合子胚的不定芽诱导频率、平均不定芽数及不定芽形成能力随着6-BA浓度的升高而提高, 6-BA浓度为1.5 mg·L-1时, 不定芽的诱导频率、平均不定芽数及不定芽形成能力最高, 分别可达69.8%、4.73和3.30。6- BA浓度高于1.5 mg·L-1时, 诱导出的不定芽出现玻璃化现象, 而且, 6-BA浓度越高, 玻璃化现象愈严重。
|
图版Ⅰ Plate Ⅰ |
|
|
成熟合子胚接种于附加6-BA 1.0 mg·L-1、TDZ 0.000 5~0.004 mg·L-1、NAA 0.1 mg·L-1的DCR培养基上。4 d后, 外植体开始膨大, 12 d可观察到不定芽原基, 30 d可观察到体胚发生。观察发现, 成熟合子胚多从子叶上长出不定芽。分析发现, TDZ对成熟合子胚的不定芽和体胚发生, 均产生了明显影响。成熟合子胚在附加6-BA 2.0 mg·L-1时, 体胚的诱导频率最高, 为7.3%。培养基中添加TDZ后, 体胚发生频率显著提高, TDZ为0.003 mg·L-1时, 体胚的诱导频率最高, 可达13.5%。成熟合子胚的不定芽诱导频率、平均不定芽数及不定芽的形成能力也有明显提高(表 2), TDZ为0.002 mg·L-1时, 3项指标均达到最佳, 分别为85.8%、5.45、4.68。
2.1.4 ZT浓度对不定芽和体胚发生的影响成熟合子胚接种于附加6-BA 1.0 mg·L-1、ZT 0.5~2.5 mg·L-1、NAA 0.1 mg·L-1的DCR培养基上, 外植体的变化与不加ZT时相似。统计分析结果发现, ZT浓度在0.5 ~2.5 mg·L-1变动时, 成熟合子胚的体胚发生频率、不定芽诱导频率、平均不定芽数及不定芽的形成能力与不添加ZT时相比, 均未发生明显变化(表 2)。该试验证明, ZT虽然是一种高活性的细胞分裂素, 但是, 对杉木成熟合子胚的体胚发生和不定芽发生却没有明显的促进作用。
2.2 不定芽的伸长和体细胞胚的萌发 2.2.1 不定芽的伸长经过不定芽诱导培养的合子胚, 转接入不添加植物激素的DCR培养基, 10 d后, 可观察到不定芽明显伸长, 35 d后, 大量不定芽可伸长到1.5~2.0 cm(图版Ⅰ-1), 长1.5 cm以上的不定芽可用于生根培养。
2.2.2 体细胞胚的萌发将发育成熟的健壮子叶胚转接于未添加任何植物激素的DCR培养基上, 10 d后观察到2片子叶中央开始发育真叶, 18 d左右, 真叶长1~2 cm, 20 d后少数体胚根端明显发育, 25 d后发育成一完整植株。DCR培养基中添加少量活性炭(0.5~1 g·L-1), 可促进体细胞胚根端发育。
2.3 不定芽的生根长1.5~2.0 cm的不定芽接入生根培养基(表 3), 8 d后, 1/4MS附加IBA和NAA的生根培养基上开始有不定根长出, 17 d后不定根伸长到1~1.5 cm。在1/2MS、1/4MS单独附加IBA的生根培养基上, 11 d后才观察到有不定根被诱导出, 20 d后不定根伸长到1~1.5 cm(图版Ⅰ-2)。这说明NAA和IBA配合使用, 可明显缩短生根时间, 观察还发现, 1/4MS培养基上的试管苗呈淡绿色, 开始表现出营养不良的症状。接种27 d统计分析后发现, 随着MS基本培养基中大量元素的降低, 生根率、平均根数和不定根形成能力迅速提高, 由此可见, 生根培养基中大量元素的含量是影响杉木不定芽生根的重要因素。
|
|
1/4MS附加IBA和NAA的4种生根培养基上, NAA浓度为0.1 mg·L-1时, 试管苗根茎相连处稍有膨大, 没有愈伤组织生长, IBA浓度从0.1 mg·L-1升高到0.2 mg·L-1, 试管苗的生根率从84%提高到100%; NAA浓度为0.2 mg·L-1时, 试管苗根茎相连处明显膨大, 有少量愈伤组织生长, IBA浓度从0.1 mg·L-1升高到0.2 mg·L-1, 试管苗的生根率从88%降低到76%。综合考虑试管苗的生根质量、生根率、平均根数和不定根形成能力, 认为1/4MS + IBA 0.2 mg·L-1 +NAA 0.1 mg·L-1为杉木不定芽生根的最佳培养基, 此时, 生根率、平均根数和不定根形成能力分别可达100%、3.89和3.89。
2.4 不定芽和体胚发生的组织学观察 2.4.1 不定芽发生的组织学观察石蜡切片观察到杉木成熟合子胚上不定芽有2种发生方式:一种是表面发生, 另一种是内部发生。2种发生方式均未经过愈伤组织阶段, 直接从外植体表面或内部发生不定芽, 不定芽和母体常保持维管连系, 因此, 杉木成熟合子胚的不定芽发生为直接器官发生途径。
在激素诱导下, 外植体表皮及表皮下的3~4层细胞快速分裂而分生组织化, 细胞体积小, 核大, 细胞质浓厚, 核质比明显大于未分生组织化的表皮及表皮下细胞(图版Ⅰ-3); 随着分生组织细胞的分裂, 在外植体表面开始出现分生组织突起(图版Ⅰ-4); 分生组织突起两侧的细胞加速分裂而发育出叶原基, 分生组织突起和叶原基共同组成不定芽原基(图版Ⅰ-5); 不定芽原基进一步发育形成肉眼可辨不定芽。这种不定芽起源于外植体的表面几层细胞, 所以认为是表面发生方式, 该方式是杉木成熟合子胚不定芽发生的主要途径。
在激素的刺激下, 外植体内部的小维管束脱分化, 形成一团分生组织(图版Ⅰ-6), 分生组织进一步发育成具有叶原基的不定芽原基(图版Ⅰ-7), 不定芽原基在发育过程中增大, 最终冲出表层组织发育成肉眼可辨的不定芽。这种不定芽起源于外植体内部的小维管束, 所以是内部发生方式。
2.4.2 体胚发生的组织学观察石蜡切片观察到外植体表面有突起的球形胚(图版Ⅰ-11), 球形胚由核大、细胞质浓厚的小细胞组成; 球形胚的细胞分裂, 细胞数目增多, 而发育成柱状胚(图版Ⅰ-12); 柱状胚的顶端两侧细胞加速分裂, 形成子叶, 进一步发育成子叶胚。子叶胚的纵切片上可观察到明显的茎端分生组织、根端分生组织和V字形的维管组织(图版Ⅰ-13)。体胚从发生到发育成熟的整个过程中, 始终与母体组织没有维管连系。
3 讨论 3.1 基本培养基与不定芽和体胚发生研究表明, 基本培养基中NO3-和NH4+的含量是影响针叶树体细胞胚胎发生和不定芽分化的重要因素。一般情况下, 只有明显降低NO3-和NH4+的含量时, 才能促进体细胞胚胎的发育和诱导产生更多的分化芽(黄健秋等, 1994)。本试验共选用了MS、1/2MS、DCR、GD 4种基本培养基, 这4种基本培养基中NO3-和NH4+的总含量从高到低依次为:MS为59.8 mmol·L-1, GD为37.9 mmol·L-1, 1/2MS为29.9 mmol·L-1, DCR为18.2 mmol·L-1。杉木成熟合子胚在DCR培养基上不定芽和体胚发生频率均最高, 这是因为DCR培养基中NO3-和NH4+的总含量最低。
3.2 基因型与体胚发生频率外植体的基因型是影响体胚发生频率的内在因素。大量研究表明, 基因型不同, 诱导体胚发生的难易不同。唐巍等(1998)在研究火炬松(Pinus taeda)时发现, 8种不同基因型的火炬松成熟合子胚诱导胚性愈伤组织时, 不同基因型的诱导频率明显不同, HB、MA和MC 3种基因型的诱导频率最高, 分别可达8%~9.2%、17%~28.1%和6.7%~8%; 3种基因型的体细胞胚转化成再生植株的频率也不同, MA最高, 为18.4%, HB为10.5%, MC为6.1%。塞尔维亚云杉(Picea omorika) 5个品种在外植体大小和培养条件完全相同的情况下, 体细胞胚的诱导频率明显不同, 体胚诱导频率最高的可达18.7%, 最低只有1.3%(Jain et al., 1995)。本研究是以福建第二代种子园当年收获的优良杉木种子为试验材料, 虽然种子来源一致, 但由于杉木为异花授粉, 加之种子不是采自同一株母株, 所以每个种子代表一个基因型。在同一种培养基上, 大部分种子的合子胚发生不定芽, 少数发生体胚, 很少观察到同一外植体上既有不定芽又有体胚发生的现象, 说明只要培养条件基本合适, 杉木有大约2%的种子很容易诱导体胚发生, 这也是由这部分种子的基因型所决定的。
3.3 TDZ的效应TDZ是新合成的一种杂环芳香脲, 它是一种高活性的类细胞激动素, 对不定芽分化表现出很强的调控能力。据不完全统计, 已有近100种组织培养困难的木本植物, 使用TDZ后获得了再生植株(王关林等, 1997)。Mathur等(1999)在研究北美乔松(Pinus wallichiana)成熟合子胚器官发生与植株再生时发现, TDZ与6-BA配合使用, 可以提高北美乔松成熟合子胚不定芽的形成能力。本研究也发现, TDZ与6-BA配合使用, 可显著提高杉木成熟合子胚的体胚发生频率、不定芽诱导频率、平均不定芽数及不定芽形成能力。这可能是由于6-BA和TDZ的作用机理不同, 它们在植物细胞内可能有不同的识别位点和代谢途径, 从而产生不同的生物学效应。低浓度的TDZ与6-BA配合使用, 可以实现其生物学效应的互补, 产生更好的分化效果。
黄健秋, 卫志明. 1995a. 针叶树体细胞胚胎发生的研究进展. 植物生理学通讯, 31(2): 85-90. |
黄健秋, 卫志明, 许智宏. 1995b. 马尾松成熟合子胚的体细胞胚胎发生和植株再生. 植物学报, 37(4): 289-294. |
黄健秋, 卫志明, 许智宏. 1995c. 云南松成熟合子胚的体细胞胚胎发生研究. 实验生物学报, 28(4): 371-379. |
黄健秋, 卫志明. 1994. 松属树种的组织培养和原生质体培养. 植物学通报, 11(1): 34-42. |
阙国宁. 1980. 杉木组织培养的初步研究. 林业科学, 16(增刊): 137-140. |
唐巍, 杨映根, 桂耀林, 等. 1996. 松柏类植物体细胞胚胎发生的研究与应用. 植物学通报, 13(1): 25-31. |
唐巍, 欧阳藩, 郭仲琛. 1997a. 针叶树体细胞无性系研究和应用进展. 生物工程进展, 17(4): 2-9. |
唐巍, 欧阳藩, 郭仲琛. 1997b. 火炬松成熟合子胚培养直接器官发生和植株再生. 云南植物研究, 19(3): 285-288. |
唐巍, 欧阳藩, 郭仲琛. 1998. 火炬松(Pinus taeda L.)合子胚愈伤组织的器官发生和植株再生. 实验生物学报, 31(1): 87-91. |
王关林, 方宏筠, 那杰. 1997. 高活性细胞激动素TDZ在植物组织培养中的应用. 植物学通报, 14(3): 47-53. |
杨金玲, 桂耀林, 郭仲琛. 1999. 云杉属树种的体细胞胚胎发生. 植物学通报, 16(1): 59-66. DOI:10.3969/j.issn.1674-3466.1999.01.008 |
杨金玲, 桂耀林, 杨映根, 等. 1997. 白杄体细胞胚胎发生及其植株再生. 植物学报, 39(4): 315-321. |
朱鹿鸣, 金韵琴, 栾永华. 1980. 用组织培养法繁殖杉木优树. 江苏林业, (4): 47-49. |
Mathur G, Nadgauda R. 1999. In vitro plantlet regeneration from mature zygotic embryos of Pinus wallichiana A. B. Jacks. Plant Cell Rep, 19: 74-80. DOI:10.1007/s002990050713 |
Jain S, Gupta P K, Newton R. 1995. Somatic embryogenesis in woody plants. Kluwer Academic Pulishers, 3: 183-195. |
 2006, Vol. 42
2006, Vol. 42