文章信息
- 梅莉, 韩有志, 于水强, 史建伟, 王政权.
- Mei Li, Han Youzhi, Yu Shuiqiang, Shi Jianwei, Wang Zhengquan.
- 水曲柳人工林细根季节动态及其影响因素
- Impact Factors on Fine Roots Seasonal Dynamics in Fraxinus mandshurica Plantation
- 林业科学, 2006, 42(9): 7-12.
- Scientia Silvae Sinicae, 2006, 42(9): 7-12.
-
文章历史
- 收稿日期:2005-04-13
-
作者相关文章
2. 华中农业大学园艺林学学院 武汉 430070;
3. 山西农业大学林学院 太谷 030801
2. Horticulture and Forestry College, Huazhong Agriculture University Wuhan 430070;
3. Forestry College of Shanxi Agriculture University Taigu 030801
林木细根处于不断生长、衰老、死亡和再生长的动态过程(即细根周转)中(Norby et al., 2000), 该过程消耗陆地生态系统初级生产力的10%~75%(Bloomfield et al., 1996), 在多数森林生态系统中, 细根的这种消耗占初级生产力的一半以上(Vogt et al., 1996)。因此, 细根周转导致的对初级生产力的大量消耗影响了C在生态系统地上部分和地下部分的分配格局与过程(Nadelhoffer, 2000)。研究细根的动态是认识细根周转和C在森林生态系统循环中作用的关键(Norby et al., 2000)。
细根的动态主要表现为细根生物量的季节变化, 其过程受气候因子(Pregitzer et al., 2000)和土壤因子控制(Hendrick et al., 1993), 主要原因是细根的生理活动对水分、温度和养分等资源的有效性非常敏感(Vogt et al., 1996; 黄建辉等, 1999; 张小全等, 2001)。温带的气候和土壤具有典型的季节变化规律, 在温带地区, 有些森林生态系统中细根生物量高峰出现在春季(Burke et al., 1994)或夏季(Hendrick et al., 1993), 也有研究发现细根生物量在春季和秋季各出现1个高峰(陈光水等, 2004)。细根生物量出现2次高峰的树种, 意味着更多的C分配到根系中去(Nadelhoffer et al., 1992)。许多研究认为春季细根生物量的增加与树木生长旺季吸收养分和水分有关(Hendrick et al., 1993; Chapin et al., 2002), 但秋季细根生物量增加的原因很少得到解释。细根生物量在温带地区的季节变化, 不仅受气候和土壤等外部因素的控制, 可能还与树木生理功能(如养分和光合产物的分配与积累)的变化等有关。细根的根长密度(root length density, 简称RLD)和比根长(specific root length, 简称SRL)是2个反映根系功能的重要结构参数, 在反映细根生理功能方面可能比生物量参数更有意义(Robinson et al., 2003)。在考虑细根生物量季节变化时, 还需要与每一阶段细根表现出的功能联系起来, 即通过不同季节根长密度、比根长的变化, 从生理功能方面解释细根生物量增加或减少的原因。
水曲柳(Fraxinus mandshurica)是东北林区树木, 春季根系开始生长较早、树冠展叶较晚, 是珍贵的阔叶用材树种, 细根生物量季节变化及对C的消耗过程比较复杂。本文通过对野外林分生长季节初期至生长结束根系生物量的定期取样, 分析细根生物量的季节变化特点, 以及该变化过程与土壤速效氮、土壤温度和含水量的关系。同时将细根生物量参数与根长密度、比根长参数相结合, 目的是从根长密度和比根长的季节变化中探讨水曲柳林分细根季节变化的生理生态关系及C的分配策略。
1 研究地自然概况东北林业大学帽儿山实验林场尖砬沟森林培育实验站(127°30′—127°34′E, 45°21′—45°25′N)。该地属寒温带大陆性季风气候, 年均气温2.8 ℃, 年均降水量723 mm, 年均蒸发量1 094 mm, 无霜期120~140 d, ≥10 ℃积温2 526 ℃。样地设于山坡中上部, 海拔506. 3 m, 坡度15°左右, 土壤为暗棕壤, 平均土层厚度40 cm左右。林分为17年生人工水曲柳纯林, 株行距1.5 m×2.0 m, 样地面积为20 m ×30 m。目前水曲柳平均树高10.4 m, 平均胸径9.1 cm。
2 研究方法 2.1 取样和分级2002年5—10月的每月中下旬在样地内随机选择24个样点, 样点大小为20 m ×30 m, 共取样6次, 共计144个样点。每样点用内径为60 mm的土钻由上至下分3层(0~10、10~20和20~30 cm)钻取土芯样品。将取回的土芯样用40目筛网在流水中冲洗, 将洗净后的根系低温冷冻保存。样品带回实验室后, 根据根系形态区分水曲柳、灌木及杂草根系, 并将灌木和水曲柳根系去除, 将水曲柳根系按根系直径<1 mm、1~2 mm、2 ~5 mm和>5 mm分级(Smit et al., 2000)。本研究将直径小于1 mm的根定义为细根, 并根据外形、颜色、弹性等区别死根和活根(Wang et al., 1995; Smit et al., 2000)。
2.2 根系生物量、根长密度及比根长计算每个月取分级后各土层新鲜细根(<1 mm)的2/3生物量样品在65 ℃烘干至恒重(48 h), 在电子天平上(精度0. 001 g)称量干质量。另1/3的样品放在有网格纸的玻璃板上, 用镊子拉直两端测量长度(精确到0. 1 mm), 测长之后单独烘干称重, 该部分样品的长度和干质量之比为比根长(SRL)。然后将2部分根系样品干质量相加, 得到每一层土芯细根的生物量, 各样品的比根长和生物量的乘积即各层的根长密度(RLD)。将同一取样点上3个土层的生物量和根长密度相加, 得到各土芯生物量值和根长密度值, 计算各土芯不同直径级别根系的比根长, 最后计算24个土芯样品各参数的平均值, 并换算成单位面积的生物量(g·m-2)、根长密度(m·m-2)和比根长(m·g-1)。
2.3 土壤速效氮、土壤温度、土壤含水量分别用20目筛网筛出部分土壤, 迅速密封冷冻, 然后带回实验室分析土壤含水量、土壤硝态氮和铵态氮含量。硝态氮采用酚二磺酸比色法, 铵态氮采用KCl浸提-淀粉蓝比色法, 本研究硝态氮和铵态氮为24个土芯样品平均值。各月的土壤温度数据采用帽儿山生态站近6年气候观测平均值, 由于75%~80%的根系分布于0~20 cm土层内, 因此分析采用10 cm土层内的温度和含水量观测数据。
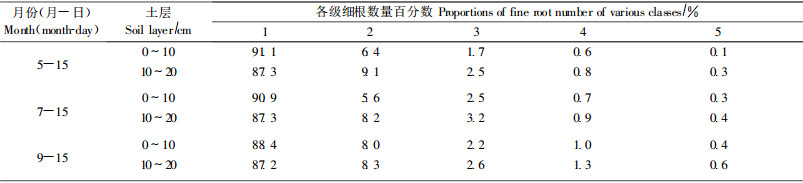
2.4 根序取样和根序测定2003年5月15日、7月15日和9月15日在水曲柳标准地内随机选取3个样点, 用平板利铲(20 cm×20 cm×20 cm)在每点分2层(0~10 cm, 11~20 cm)取样。小心去掉根系上的土壤, 拣出完整的根系, 编号装入塑料袋, 然后放置在1~3 ℃冷贮藏箱内。全部样品当天带回实验室放入-20 ℃冰箱保存。用2~3 ℃的去离子水洗去根系上的土壤颗粒和杂质, 然后放在装有去离子水冰块的培养皿中, 在低温下(2~3 ℃)区分各等级的细根。依据Pregizter等(2002)根序分级方法, 将每一取样点的根系, 分成若干根段(root segment), 按根段进行分析。将根系末梢的根定为1级细根, 然后是2级细根、3级细根等, 一直区分到5级细根, 用镊子取下每一个根, 按等级分别放入不同的装有冰水的培养皿中, 查数每一等级细根的数量。同时在装有测微尺的显微镜(×20)下, 测定每个根的长度和直径(精确到0. 01 mm)。
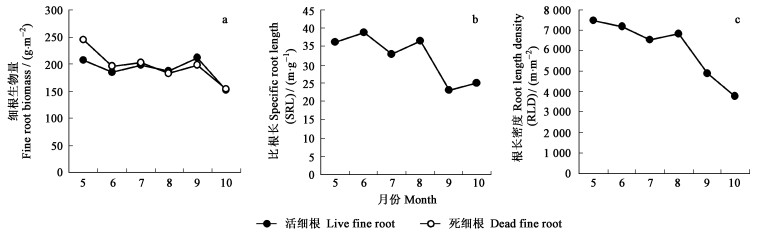
3 结果与分析 3.1 水曲柳细根季节动态从生长季开始到结束, 水曲柳活细根生物量出现2次高峰, 春季的(5月份) (205±8. 5)g·m-2和秋季的(9月份) (211±19.7)g·m-2(图 1a); 10月份为最低值, (150±11.3)g·m-2。5、6、7、8和9月活细根生物量之间在统计上没有显著差异(P<0. 05), 除6月份外, 各月份活细根生物量均与10月份的差异显著(P<0. 05)。死细根生物量与活细根生物量具有相同的季节变化规律, 5月份死根生物量显著高于其他月份、6、7、8和9月之间没有显著差异, 而10月份死细根生物量显著低于其他月份(P<0. 05)。细根的比根长和根长密度与其生物量的季节变化规律明显不同(图 1b, c), 5—8月, 平均活细根比根长为(36.4±1.7)m·g-1, 而且无显著差异。9—10月的比根长急剧减小到(24.9±1.8)m·g-1, 减小30%左右, 导致秋季比根长与春季和夏季之间存在显著差异(P<0. 05) (图 1b)。根长密度5—10月份处于下降状态(图 1c), 但是在统计上与比根长表现出的变化规律一致。9月份的活细根生物量最高(图 1a), 但是比根长和根长密度却比以前显著下降(P<0. 05) (图 1b, c), 说明春季和夏季细根的直径相对较小, 秋季的细根直径相对较粗(Smit et al., 2000), 反映秋季的细根与春季和夏季的细根可能具有不同的结构成分和生理功能(Eissenstat et al., 1997)。
|
图 1 水曲柳人工林细根生物量(a)、比根长(b)及根长密度(c)季节动态 Fig. 1 Seasonal dynamics of fine root biomass (a), SRL (b) and RLD (c)in F. mandshurica plantation |
水曲柳细根(直径<1 mm)包含1~4级根序, 主要由直径<(0. 26±0. 08)mm的1级根组成(占90%左右)。从春季(5月)到秋季(9月), 水曲柳1级根的数量下降了2%, 3级根, 平均直径(0. 47±0. 13)mm, 数量增加13%左右, 4级根, 平均直径(0. 86±0. 33)mm, 数量增加近40%(表 1)。不同根序细根长度研究表明, 0 ~10 cm土层1~4级单个根的平均根长由5月份的(36. 65±2. 24)mm减小到9月份的(27. 26±3. 06)mm (下降25%), 10~20 cm土层由(29. 91±2. 24)mm减小到(27. 19±2. 37)mm(下降10%), 这表明, 秋季(9月)比根长和根长密度下降(图 1)主要是由直径相对较粗的细根数量增加和单个根长度减小引起的。
|
|
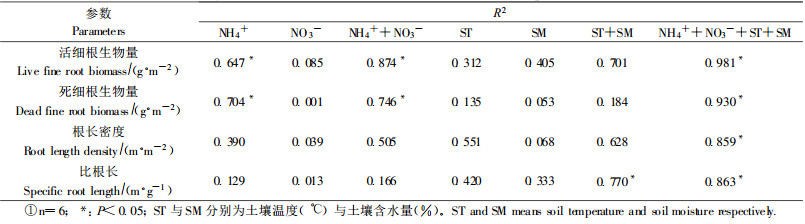
由于矿化速率不同, 土壤有效N含量在生长季内存在较大的变异(图 2), 这种变异控制着细根的动态过程(Nadelhoffer, 2000; King et al., 2002)。在水曲柳林内, 夏季有效N的含量较高, 春季和秋季相对较低(8. 8~22. 4 mg·kg-1), 其中铵态氮含量变化较小(2. 3~6. 7 mg·kg-1), 硝态氮含量变化较大(5. 5 ~19. 5 mg·kg-1)。回归分析表明, 铵态氮对细根季节动态的影响大于硝态氮, 其中细根生物量与铵态氮显著正相关(活根的R2=0. 647, P<0. 05;死根的R2=0. 704, P<0. 05) (表 2), 根长密度和比根长虽然与铵态氮正相关, 但是相关性不显著。二元线性回归分析表明, 铵态氮和硝态氮综合作用影响活细根和死细根生物量的季节变化, 影响力分别达到87%和75%。土壤有效氮对根长密度和比根长的影响仅为50%和17%。显然, 土壤氮的有效性季节变化影响细根的生长和死亡(Norby et al., 2000; Nadelhoffer, 2000), 其中铵态氮在综合影响中起主要作用。

|
图 2 生长季内水曲柳林地土壤有效氮的季节变化 Fig. 2 Seasonal variation of available nitrogen in Fraxinus mandshurica plantation soil |
|
|
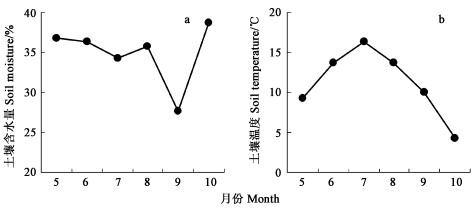
温度和水分既影响土壤养分有效性, 又影响细根的生长(Pregitzer et al., 2000; 张小全等, 2001)。土壤温度的季节性变化明显大于水分季节性变化(图 3)。试验地土壤(0~30 cm)含水量较高, 生长季含水量为35%~40%(除秋季相对干旱外), 土壤水分的季节变化受降雨量的影响较小。细根生长的季节动态与土壤10 cm处的水分含量除对活根生物量有一定影响外(R2=0. 405), 对其他参数的影响均较低(表 2)。土壤温度的季节变化明显, 生长季土壤10 cm处的月平均温度(4~17 ℃)对细根的作用(平均R2=0. 354)大于水分(平均R2=0. 215), 其中对根长密度和比根长的影响(分别为55%和42%)大于对生物量的影响(分别31%和13%), 但是这种影响均没有达到显著水平。二元线性回归分析表明, 土壤10 cm处的温度和水分综合作用对细根的动态有重要影响。其中对活细根生物量、根长密度和比根长的影响分别为70%、63%和77%(P<0. 05), 对死细根生物量影响很小(仅为18%)。
|
图 3 生长季内土壤10 cm深处含水量(a)和温度(b)的变化 Fig. 3 Variations of soil moisture (a) and temperature (b)in 10 cm soil depth |
单因子分析表明, 不同的土壤资源有效性对细根动态影响差别较大, 多元线性回归分析则显示, 土壤有效氮(铵态氮和硝态氮)、10 cm处土壤月平均温度和水分含量显著影响活细根生物量、死细根生物量、根长密度和比根长的季节动态(P<0. 05) (表 2)。98%的活细根生物量、93%的死细根生物量、86%的根长密度和比根长的季节变化可以通过土壤资源有效性的季节变化得到解释(表 2)。说明水曲柳细根生长、死亡、单位面积上的密度和形态结构主要受土壤资源有效性的综合作用的控制(Norby et al., 2000)。
4 结论与讨论 4.1 水曲柳细根的季节动态细根的生长是一个复杂的生理生态过程(Eissenstat et al., 1997), 春季细根生长先于叶生长(多为落叶阔叶树种)或与叶同步生长(多为常绿针叶树种) (Pregitzer et al., 2000)。前一种生长模式需要利用上一年根系中储存的碳水化合物(Pregitzer, 2003); 后一种模式主要利用新叶固定的光合产物, 细根生长在叶子完全展开后达到高峰。
水曲柳细根生物量在整个生长季内存在2个高峰(图 1a), 根据对帽儿山水曲柳根系生长观察, 4月末土壤表层刚开始解冻, 细根便开始生长, 5月下旬开始展叶, 根系生长早于叶子生长20~25 d。展叶前细根生长活动消耗的C主要依赖上一年秋季根系积累的碳水化合物。当新叶能够进行光合作用时, 新的光合产物及时分配到细根生长部位。9月中下旬, 树叶全部脱落, 此时细根的生物量增加, 3~4级根数量增加13%~ 40%(表 1), 比根长和根长密度显著下降(图 1b, c), 意味着细根直径增粗或组织密度增加。Pregitzer等(2002)研究表明, 相对较粗的细根中细胞N含量较低, 呼吸代谢较弱, 含有较高的非结构性碳水化合物, 有利于落叶后休眠前根系呼吸和下一年早春根系的生长(Langley et al., 2002)。水曲柳秋季细根由直径增粗或组织密度增加导致的生物量增加可能有2个功能:一是储存更多的碳水化合物用于下一年展叶之前较长一段时间根系生长需求(Pregitzer, 2003); 另一个功能是适应温度下降, 根组织次生增厚(包括提高根组织密度)、降低根系呼吸、增加自身抵抗能力和寿命(Pregitzer et al., 2000; Eissenstat et al., 1997)。Hendrick等(1993)的研究也有类似结果。春季水曲柳细根生物量和比根长较高(此时细根直径较小)是为了满足林木生长而高效率吸收养分和水分的需要(Eissenstat et al., 1997), 秋季生物量的增加(比根长较小, 因此细根直径较粗)是为了储存更多的碳水化合物适应下一年春季生长。不同季节, 根系通过生物量、比根长和根长密度的调节, 表现出不同的生理功能。
4.2 水曲柳细根季节变化与环境因子的关系土壤中的有效N主要来自有机质的矿化, 由于温度和水分的季节性变化, 导致N矿化的季节性差异(Pregitzer et al., 2000)。在帽儿山地区森林土壤水分常年充足的情况下, 土壤N的矿化随温度升高而增加。因此, 土壤温度和有效N的含量(尤其是铵态氮含量)成为影响水曲柳细根季节动态的主要因子(表 2)。Burton等(2000)对北美槭树(Acer saccharum)的研究表明, 春季细根的生长随着土壤温度增加而增加, 同时与N的有效性明显正相关。水曲柳细根季节动态主要是土壤有效性资源综合作用的结果(表 2), 这种综合作用可以解释93%~98%的生物量变化、86%的根长密度和比根长的变化。春季(5、6月)土壤温度较低(6~10 ℃), 但细根生长却迅速, Pregitzer等(2000)认为土壤积温是重要的影响因素、5月死根生物量达最高值, 是由于冬季细根分解较慢而造成死根积累(杨玉盛等, 2001)。夏季(7、8月)土壤温度和有效N的含量达到最高值, 此时树冠生长稳定, 细根生物量也处于相对稳定状态, 表明细根的生长与叶的光合能力有关。秋季林地土壤温度显著下降(4~10 ℃), N的矿化率也逐渐减慢(总有效氮含量9.5~10.5 mg·kg-1), 多数森林生态系统的活细根生物量伴随着树叶凋落而减少、死细根生物量增加(Hendrick et al., 1993; Eissenstat et al., 1997)。9月份水曲柳活细根生物量却达到第2个高峰(图 1a), 比根长和根长密度显著下降(图 1b, c), 说明细根中较细的根死亡, 生长出来的细根较短以及直径相对较粗, 这可能是9月份细根生物量高的原因。10月份细根生物量显著下降除了与温度和养分的迅速下降有关外, 还与落叶后C的供应结束有直接关系(Pregitzer et al., 2002)。
细根晚秋到翌年早春的动态常常被忽视(Pregitzer et al., 2000)。帽儿山地区4月份平均气温4. 8 ℃, 最高气温与最低气温相差-1. 9~11. 2 ℃, 土壤10 cm处平均温度1~2 ℃, 水曲柳细根生物量在4月份开始增加。2003年4月中旬, 水曲柳活细根生物量(179 g·m-2)和死细根生物量(129 g·m-2)分别高于2002年10月16%(151 g·m-2)和18%(106 g·m-2), 低于2002年5月13%(205 g·m-2)和47%(243 g·m-2)。Wang等(2003)对加拿大黑云杉(Picea mariana)林分研究表明, 土壤10 cm处温度在2 ℃时, 根系已开始呼吸。Teskey等(1981)研究发现, 土壤温度3 ℃时, 白栎(Quercus albus)细根伸长速度1. 8 mm·d-1, 意味着温带和北方森林地下细根在较低的温度下便开始生理活动和生长。
陈光水, 何宗明, 谢锦升, 等. 2004. 福建柏和杉木人工林细根生产力、分布及周转的比较. 林业科学, 40(4): 15-21. DOI:10.3321/j.issn:1001-7488.2004.04.003 |
黄建辉, 韩兴国, 陈灵芝. 1999. 森林生态系统根系生物量研究进展. 生态学报, 19(2): 270-277. DOI:10.3321/j.issn:1000-0933.1999.02.021 |
杨玉盛, 陈光水, 何宗明, 等. 2001. 杉木观光木混交林群落细根净生产力及周转. 林业科学, 37(专刊1): 35-41. |
张小全, 吴可红. 2001. 森林细根生产和周转研究. 林业科学, 37(3): 126-138. DOI:10.3321/j.issn:1001-7488.2001.03.021 |
Bloomfield J, Vogt K A, Wargo P M. 1996. Tree root turnover and senescence//Waisel A E Y, Kafkafi U. Plant Roots, The hidden half (2nd). New York: Marcel Dekker Press, 363-381
|
Burke M K, Raynal D J. 1994. Fine root growth phenology, production, and turnover in a northern hardwood forest ecosystem. Plant and Soil, 162(2): 135-146. |
Burton A J, Pregitzer K S, Hendrick R L. 2000. Relationships between fine root dynamics and nitrogen availability in Michigan northern hardwood forests. Oecologia, 125(3): 389-399. DOI:10.1007/s004420000455 |
Chapin F S Ⅲ, Matson P A, Mooney H. 2002. Principles of terrestrial ecosystem ecology. New York: Springer-Verlag, 123-147.
|
Eissenstat D M, Yanai R D. 1997.The ecology of root lifespan. Advance in ecological research. Academic Press, 27: 1-60
|
Hendrick R L, Pregitzer K S. 1993. Patterns of fine root mortality in two sugar maple forests. Nature, 361(1): 59-61. |
King J S, Albaugh T J, Allen H L, et al. 2002. Belowground carbon input to soil is controlled by nutrient availability and fine root dynamics in loblolly pine. New Phytologist, 154(3): 389-398. |
Langley J A, Hungate B A, Drake B G. 2002. Extensive below ground carbon storage supports roots and mycorrhizae in regenerating scrub oaks. Oecologia, 131(4): 542-548. DOI:10.1007/s00442-002-0932-6 |
Nadelhoffer K J, Raich J W. 1992. Fine root production estimates and below ground carbon allocation in forest ecosystem. Ecology, 73(4): 1139-1147. DOI:10.2307/1940664 |
Nadelhoffer K J. 2000. The potential effects of nitrogen deposition on fine-root production in forest ecosystems. New Phytologist, 147(1): 131-139. DOI:10.1046/j.1469-8137.2000.00677.x |
Norby R J, Jackson R B. 2000. Root dynamics and global change : seeking an ecosystem perspective. New Phytologist, 147(1): 3-12. DOI:10.1046/j.1469-8137.2000.00676.x |
Pregitzer K S, Deforest J L, Burton A J, et al. 2002. Fine root architecture of nine North American trees. Ecological Monographs, 72(2): 293-309. DOI:10.1890/0012-9615(2002)072[0293:FRAONN]2.0.CO;2 |
Pregitzer K S, King J S, Burton A J, et al. 2000. Responses of tree fine roots to temperature. New Phytologist, 147(1): 105-115. DOI:10.1046/j.1469-8137.2000.00689.x |
Pregitzer K S. 2003. Woody plants, carbon allocation and fine roots. New Phytologist, 158(3): 421-423. DOI:10.1046/j.1469-8137.2003.00766.x |
Robinson D, Hodge A, Fitter A.2003. Constraints on the form and function of root systems//Kroon H D, Visser E J W.Root ecology. Berlin: Springer-verlag, 1-26
|
Smit A L, Bengough A G, Engels C, et al. 2000. Root methods:a handbook. Berlin: Springer-Verlag.
|
Teskey R O, Hinckley T M. 1981. Influence of temperature and water potential on root growth of white oak. Physiologia Plantarum, 52: 363-369. DOI:10.1111/j.1399-3054.1981.tb06055.x |
Vogt K A, Vogt D J, Palmiotto P A, et al. 1996. Review of root dynamics in forest ecosystems grouped by climate, climatic forest type and species. Plant and Soil, 187(2): 159-219. |
Wang C K, Bond-Lamberty B, Gower ST. 2002. Soil surface CO2 flux in a boreal black spruce fire chronosequence. Journal of Geophysical Research, 108(D3): 8224. DOI:10.1029/2001JD000861 |
Wang Z Q, Burch W H, Mou P, et al. 1995. Accuracy of visible and ultraviolet light for estimating live root proportions with minirhizotrons. Ecology, 76(7): 2330-2334. DOI:10.2307/1941705 |
 2006, Vol. 42
2006, Vol. 42