文章信息
- 朱丽华, 吴小芹.
- Zhu Lihua, Wu Xiaoqin.
- 湿地松成熟合子胚直接器官发生及植株再生
- Plantlet Regeneration via Organogenesis from Mature Embryos of Pinus elliottii
- 林业科学, 2006, 42(8): 25-29.
- Scientia Silvae Sinicae, 2006, 42(8): 25-29.
-
文章历史
- 收稿日期:2004-04-15
-
作者相关文章
湿地松(Pinus elliottii)抗松针褐斑病育种研究已20余年,所建立的抗病种子园已进入结实阶段,但种子产量有限,在生产实践上迫切需要一条简便、快捷的技术体系来加快现有抗病材料的大量繁殖。植物组织培养技术是快速繁殖木本植物,尤其是繁殖优良树种的理想途径,同时也是通过遗传操作获得转基因植物,从而改良树种的前提条件(王明庥,2001;黄健秋等, 1995)。开展抗病湿地松组织培养技术的研究,将有利于加速抗病良种的推广进程。
植物组织培养植株再生最常见的途径是直接器官发生和体细胞胚胎发生。过去近20年里,松属树种体细胞胚胎发生研究取得了很大进展(Becwar et al., 1990; 黄健秋等,1995;Percy et al., 2000),但其应用却受体胚成熟与转化等问题的限制(Pullman et al., 2003;Stasolla et al., 2003)。器官发生是松属树种植株再生的另一条途径,通过采用各种不同的外植体,有许多松属树种已可以器官发生途径进行繁殖(Gonzzalez et al., 1998;Parasharami et al., 2003;Tang et al., 2005)。随着松属树种组培生产技术的发展,用组培再生植株进行人工造林正逐步成为现实,如美国、新西兰、加拿大等国已分别将火炬松(Pinus taeda)、辐射松(P. radiata)和海岸松(P. pinaster)的组培繁殖苗较大规模地应用于造林(沈惠娟,1992;Nairn, 1993;马常耕,1994;Handley et al., 1995;Menzies et al., 2001)。自从Sommer等(197 4)首次报道以湿地松子叶为外植体获得不定芽以来,国内外学者对其组织培养进行了较为深入的研究。目前以成熟胚(Brown et al., 1977;Perez-Bermudez et al., 1987;阙国宁等,1997)、子叶(Bronson et al., 1991)、实生苗(Burns et al., 1991;朱丽华等,2004)为外植体均已获得完整再生植株,未成熟胚体细胞胚胎发生也已成为现实(Newton,1995;唐巍等,1997)。然而,至今为止尚没有可用于大规模林业生产的湿地松微繁体系的报道。本研究采用含高浓度6-BA的液体培养基对湿地松胚外植体进行预处理,然后转移至固体培养基上促进不定芽发生,初步建立了湿地松组织培养植株再生体系。
1 材料和方法 1.1 供试湿地松种子及处理试验用的湿地松成熟种子购于福建顺昌。经4 ℃低温处理3~4周后取出,用0.1%高锰酸钾溶液浸泡12 h,流水冲洗1 h,冲洗完毕,在无菌条件下剥除种壳,经70%乙醇表面消毒30 s后置于0.1%升汞浸泡2~3 min,用无菌水冲洗4~5次后,将胚取出备用。
1.2 不定芽的诱导用含不同浓度6-BA (0、30、60、80、100、150 mg·L-1)的液体培养基浸泡处理湿地松离体胚(时间设12、24、36 h 3个水平),然后用灭菌滤纸吸干其表面水分,转入无激素GD、1/2GD固体培养基上培养。每个处理含30个胚,6周后统计有不定芽分化的外植体数,计算诱导率(有不定芽分化的外植体数/接种数)。
1.3 不定芽的伸长与生根将有不定芽分化的胚转入添加低浓度激素的伸长培养基中,待不定芽长至0.5~1.0 cm,将其切割成单个芽,接种在添加NAA(0.05 mg·L-1)的1/2GD生根培养基上进行不定根的诱导。
以上培养基中除生根培养基中蔗糖浓度为20 g·L-1外,其余均添加蔗糖30 g·L -1、水解酪蛋白(CH)500 mg·L-1、谷氨酰胺(Gln)450 mg·L-1、琼脂6 g·L-1(液体培养基不加),pH 5.8,121 ℃、0.105 MPa高温高压灭菌18 min。全部培养过程均在MDF-UTN光照培养箱中完成,温度(23±1) ℃,光照强度2 000 lx,每日光照16 h。
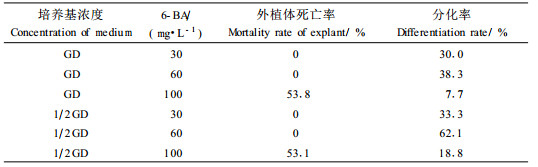
2 结果与分析 2.1 6-BA浓度及基本培养基使用浓度对湿地松胚不定芽分化的影响用含不同浓度6-BA的液体培养基浸泡湿地松种胚24 h,然后转移到无激素改良GD或浓度稀释1倍的1/2GD固体培养基上培养。3~4 d后,经30、60 mg·L-16-BA处理的胚100%转绿,子叶微微张开,20~26 d后部分胚外植体的子叶、子叶基部、胚轴等部位产生不定芽(图 1a)。经100、150 mg·L-1 6-BA处理的胚只有部分转绿,10 d后,经150 mg·L-16- BA处理的胚大部分已褐变死亡,故未列入统计。试验结果表明,基本培养基使用浓度对湿地松胚外植体不定芽的分化亦有一定影响:经同一浓度6-BA处理的外植体,转入1/2GD培养基中其不定芽分化率均高于转入GD培养基中的外植体(表 1)。

|
图 1 湿地松植株再生过程 Fig. 1 Various stages of plantlet regeneration in P. elliottii a.不定芽的形成;b.不定芽的伸长;c.不定根的形成;d.移栽至温室里的再生植株。 a. Adventitious buds formed from mature zygotic embryos; b. Adventitious buds enlongated on 1/2GD medium containing 0.05 mg·L-1NAA; c. Root was formed on the stem base 1 month after transfer to 1/2GD medium with 0.05 mg·L-1NAA; d. Regenerated plantlets in greenhouse. |
|
|
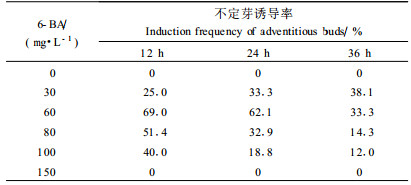
将湿地松离体胚用含不同浓度6-BA的液体培养基浸泡处理后,转移到无激素的1/2GD培养基中培养。6周后统计结果(表 2)表明,不定芽诱导不仅受6-BA浓度的影响,同时受处理时间的影响。经无激素液体培养基浸泡处理的湿地松种胚仅伸长长成无菌苗,未能诱导出不定芽;当液体培养基中6-BA浓度为30 mg·L-1时,随着浸泡时间的延长,不定芽诱导率有所上升,但诱导率最高不超过40%;浓度为60 mg·L-1的6-BA液体培养基浸泡处理12 h后,湿地松成熟胚不定芽诱导率达到最高,但随着浸泡时间的延长,不定芽诱导率逐渐下降;当液体培养基中6-BA浓度为80~100 mg·L-1时,随着浸泡时间的延长,不定芽诱导率急剧下降,褐变死亡率亦随浸泡时间的延长而上升;当液体培养基中6-BA浓度达到15 0 mg·L-1时,对湿地松成熟胚造成严重的毒害作用,外植体全部褐变死亡。
|
|
研究发现,胚外植体不定芽的数量、大小及发生部位与液体培养基中6-BA浓度有很大关系:经30 mg·L-16-BA浸泡处理的胚能诱导产生较健壮的芽,但该处理浓度下每个外植体平均分化芽的数量较少,发生部位为胚轴、子叶、子叶基部,以子叶基部腋芽萌发为主;在含60 mg·L-16-BA的液体培养基中浸泡24 h能得到数量最多的芽,但芽体比较小,1~2 mm的芽所占比例达80%,大于5 mm的芽仅占5%左右,在胚轴、子叶、子叶基部均有芽发生,以胚轴产生不定芽为主,子叶基部腋芽萌发占少数;经80~100 mg·L-1的6-BA浸泡处理过的胚,绝大部分在胚轴、子叶产生大量绿色结节并且玻璃化,极少分化产生有效芽(表 3)。因此,6-BA浸泡处理浓度以30~60 mg·L-1为宜,时间宜控制在12~24 h。
|
|
经处理的离体胚在无激素1/2改良GD培养基上培养1个月后,分化出大量不定芽。已分化的芽继续继代在1/2GD上,其生长正常但伸长比较缓慢;继代在添加GA3的1/2GD培养基中,则外植体逐渐变黄,培养一段时间后,一半以上的外植体死亡;1/2GD培养基中加入微量NAA (0.05 mg·L-1)或同时加入NAA(0.05 mg·L-1)与细胞分裂素(K T或6-BA 0.1 mg·L-1),比较有利于不定芽的伸长。经伸长培养后,已分化的不定芽可以分为3类:A类不定芽针叶正常,颜色嫩绿,表面具有蜡质层,具有明显可辨的茎段,长势旺盛(图 1b);B类不定芽针叶湿润,粘成一束,表面无蜡质层,茎段不明显,长势较弱;C类不定芽比较小,甚至只是些类似芽的结构,在继代培养中无法长成可切割的有效芽。其中A类不定芽数量最多,少数为C类,B类不定芽数量极少。经过2次继代后,每个胚平均可获得A类不定芽8~10个。
待芽长到1.0~1.5 cm高时,将其单个切下,继代到含6-BA的新鲜培养基上进行增殖。1个月后部分不定芽基部或叶腋有2~3个新芽产生。总的来说,不定芽的增殖较困难。这是下一步工作亟待解决的问题。
2.4 再生植株的形成将高1.0~1.5 cm的不定芽切割成单个,转入附加NAA0.05 mg·L-1的1/2GD的生根培养基中诱导不定根发生,1个月后生根率为50%(40/80)。所形成的不定根大多为单根,比较粗壮,较少有侧根发生,颜色为黄白色,根茎连接处基本无愈伤组织(图 1c)。试验结果表明,不定根的形成还与芽的生理状态有关,生长健壮的芽较利于根的发生,且根伸长较快;细弱的不定芽生根能力较差,根形成后生长亦较慢。
不定根形成后将其转移至无生长素的培养基上进行伸长生长,1个月后选择健壮的再生植株进行移栽。移栽前逐渐打开瓶盖炼苗5~7 d,然后将小苗取出后,用水洗去根部残留的琼脂培养基,移栽于装有蛭石与泥碳土等比例混合的基质的容器内。2个月后移栽成活率为60%左右(图 1d)。
3 结论与讨论本试验之所以采用含激素的液体培养基对外植体进行预处理,是考虑到在液体培养基中外植体与激素的接触更广泛,因而吸收可能会更充分。李正理等(1962)研究红松(Pinus koraiensis)后胚离体培养的结果表明,胚在萌发初期对营养的吸收是由子叶进行的,而在固体培养基上只有少数子叶接触到培养基。杜勒等(1996)的研究表明,液体培养基或者液体、固体混合培养基更有利于外植体吸收培养基中的营养物质及激素。
试验结果表明,采用含高浓度6-BA的液体培养基对湿地松成熟合子胚进行预处理, 然后转入无激素的培养基上培养, 的确比较容易诱导产生不定芽。不定芽诱导受6-BA浓度、处理时间的影响较大:经不含6-BA液体培养基处理的胚没有不定芽产生;在一定范围内,随着液体培养基中6-BA浓度的增高,不定芽诱导率、平均芽数均增高。较低浓度(30 mg·L-1)的6-BA处理诱导产生出较茁壮的芽;中等浓度(60 mg·L-1)的6-BA处理能诱导产生最大数量的芽,但芽体较小;6-BA浓度过高(>80 mg·L-1)不仅影响不定芽的诱导,甚至对供试的胚产生严重的毒害作用。Bronson等(1991)在湿地松离体子叶不定芽植株再生研究中也发现不定芽的大小以及数量与6-BA处理时间有关。而Von Arnold等(1981)的研究认为,产生不定芽的胚的比例与细胞分裂素浓度无关,但在一个外植体上形成芽的数量随着细胞分裂素浓度的提高而增加,其间的差异可能与所研究的松属树种不同有关。此外,6-BA浓度的高低还影响不定芽发生的部位。经30 mg·L-1 6-BA处理的胚,以子叶基部腋芽萌发为主,在子叶、胚轴处仅有少量不定芽发生;6-BA浓度达到60 mg·L-1时在整个胚的任何部位均可产生不定芽。何子灿等(1995)的研究也表明,金钱松(Pseudolarix amabilis)胚外植体表面不定芽发生的部位与6-BA浓度有关,Von Arnold等(1981)在小干松(Pinus contorta)胚不定芽研究中也有类似报道。
大量研究表明,基本培养基的成分及使用浓度对松属树种的器官分化有较大的影响。Bronson等(1991)对湿地松离体子叶不定芽发生的研究表明,BL和改良GD1培养基均能诱导产生大量不定芽,而RW培养基则不利于子叶分化不定芽。Von Arnold等(1981)在研究中发现,将LP培养基浓度扩大2倍或以上时,胚存活率极低;将培养基浓度稀释1/2~1/4则有利于不定芽的分化。Fukuda等(1989)在黑松(Pinus thunbergii)种胚外植体不定芽分化研究中发现,随着培养基浓度从1/4GD、1/2GD到2/3GD,不定芽分化率增加,在2/3GD培养基中分化率最高,达95%;在GD培养基中诱导率只有61%。本试验中,改良GD浓度稀释1倍(即改良1/2GD)更有利于湿地松胚不定芽分化。
本试验仅仅在湿地松胚不定芽诱导及植株再生方面做了一些探索,所建立的再生体系与大规模工厂化生产还有很长一段距离。今后的工作中一方面需要加强对不定芽扩大增殖的研究,另一方面应继续优化不定芽生根的培养基,从而提高生根率及根系的质量,增强再生植株的适应性,提高移栽成活率等。这些问题的突破无疑将使工厂化生产抗病湿地松成为可能。
杜勒, 竺莉红, 梁海曼. 1996. 无外源激素条件下液体和固体培养基对黄瓜子叶培养器官分化不同影响. 生物技术, 6(1): 17-19. |
何子灿, 柯善强. 1995. 外源激素对金钱松胚外植体愈伤组织的诱导及其器官发生的调节作用. 武汉植物学研究, 13(1): 81-86. |
黄健秋, 卫志明, 许智宏. 1995. 马尾松成熟合子胚的体细胞胚胎发生和植株再生. 科学通报, 40(1): 73-75. |
李正理, 张新英. 1962. 红松后胚离体培养的研究Ⅰ:不同培养方式下幼苗生长的比较观察. 植物学报, 10(2): 103-112. |
马常耕. 1994. 世界松类无性系林业发展策略和现状. 世界林业研究, (2): 11-18. |
阙国宁, 房建军, 葛万川, 等. 1997. 火炬松、湿地松、晚松组培繁殖的研究. 林业科学研究, 10(3): 227-232. DOI:10.3321/j.issn:1001-1498.1997.03.001 |
沈惠娟. 1992. 木本植物组织培养技术. 北京: 中国农业科技出版社, 28-57.
|
唐巍, 欧阳藩, 郭仲琛. 1997. 湿地松体细胞胚胎发生和植株再生. 植物资源与环境, 6(2): 8-11. |
王明庥. 2001. 林木遗传育种学. 北京: 中国林业出版社, 278-286.
|
朱丽华, 张艺, 吴小芹. 2004. 湿地松的组织培养及植株再生. 南京林业大学学报:自然科学版, 28(6): 47-51. |
Becwar M R, Nagmani R, Wann S R. 1990. Initiation of embryogenic cultures and somatic embryo development in loblolly pine. Can J For Res, 20: 810-817. DOI:10.1139/x90-107 |
Brown C L, Sommer H E. 1977. Bud and root differentiation in conifer cultures. Tappi, 60(6): 72-73. |
Bronson M R, Dixon R K. 1991. Cultural factors influencing adventitious shoot and plantlet formation from slash pine cotyledons. New Forests, 5(4): 277-288. DOI:10.1007/BF00118857 |
Burns J A, Schwarz O J, Schlarbaum S E. 1991. Multiple shoot production from seedling explants of slash pine (Pinus elliottii Engelm). Plant Cell Reports, 10(9): 439-443. DOI:10.1007/BF00233810 |
Fukuda T, Fujii Y, Kanamitsu K. 1989. Production of resistant pine against the nemotode disease through tissue culture techniques. Journal of the Japan Wood Research Society, 35(12): 1139-1143. |
Gonzzalez M V, Rey M, Tavazza R. 1998. In vitro adventitious shoot formation on cotyledons of Pinus pinea. HortScience, 33(4): 749-750. |
Handley L W, Becwar M R, Cheswick E E, et al. 1995. Research and development of commercial tissue culture systems in loblolly pine. Tappi, 78(5): 169-175. |
Menzies M I, Holden D G, Klomp B K. 2001. Rencent trends in nursery practice in New Zealand. New Forests, 22: 3-17. DOI:10.1023/A:1012027013173 |
Nairn B J. 1993. Commercial micropropagation of radiata pine//Ahuja M R. Micropropagation of Woody Plants. The Netherlands: Kluwer Acad Pub, 393-394 https://link.springer.com/chapter/10.1007%2F978-94-015-8116-5_23
|
Newton R J. 1995. Somatic embryogenesis in slash pine//Jain S M, Gupta P K, Newton R J. Somatic embryogenesis in woody plants. Dordrecht: Kluwer Acad Pub, 90-108
|
Percy R E, Klimmaszewska K, Cyr D R. 2000. Evaluation of somatic embryogenesis for clonal propagation of western white pine. Canadian Journal of Forest Research, 30(12): 1867-1876. DOI:10.1139/x00-115 |
Parasharami V A, Poonawala I S, Nadgauda R S. 2003. Bud break and plantlet regeneration in vitro from mature trees of Pinus roxburghii Sarg. Current Science, 84(2): 203-208. |
Perez-Bermudez P, Sommer H E. 1987. Factors affecting adventitious bud induction in Pinus elliottii Engelm. embryos cultured in vitro. Plant Cell, Tissue and Organ Culture, 11: 25-35. DOI:10.1007/BF00036573 |
Pullman G S, Johnson S, Peter G, et al. 2003. Improving loblolly pine somatic embryo maturation:comparison of somatic and zygotic embryo morphology, germination, and gene expression. Plant Cell, Tissue and Organ Culture, 21(8): 747-758. |
Sommer H E, Brown C L. 1974. Plantlet formation in Pine tissue culture. American Journal of Botany, 61: 5. |
Stasolla C, Yeung C E. 2003. Recent advances in conifers somatic embryogenesis:improving somatic embryo quality. Plant Cell, Tissue and Organ Culture, 74: 15-35. DOI:10.1023/A:1023345803336 |
Tang W, Newton R J. 2005. Plant regeneration from callus cultures derived from mature zygotic embryos in white pine (Pinus strobes L.). Plant Cell Reports, 24: 1-9. DOI:10.1007/s00299-005-0914-3 |
Von Arnold S, Eriksson T. 1981. In vitro study of adventitious shoot formation in Pinus contorta. Can J Bot, 59: 870-874. DOI:10.1139/b81-121 |
 2006, Vol. 42
2006, Vol. 42