文章信息
- 刘桂丰, 杨传平, 蔡智军, 程贵兰, 詹立平.
- Liu Guifeng, Yang Chuanping, Cai Zhijun, Cheng Guilan, Zhan Liping.
- 转betA基因小黑杨的耐盐性分析及优良转基因株系的选择
- Salt Tolerance of betA Transgenic Populus simonii×P. nigra and Selection for Superior Transgenic Plants
- 林业科学, 2006, 42(7): 33-36.
- Scientia Silvae Sinicae, 2006, 42(7): 33-36.
-
文章历史
- 收稿日期:2005-01-07
-
作者相关文章
2. 辽宁农业职业技术学院 熊岳 115214
2. Liaoning Agricultural Professional and Technical College Xiongyue 115214
盐逆境引起植物伤害的原因之一是渗透胁迫造成的次生盐害。甜菜碱作为次生代谢产物在植物中起到渗透调节作用,进而提高植物的耐盐性。许多高等植物,特别是藜科(Chenopodiaceae)和禾本科(Gramineae)植物,干旱或盐胁迫下常积累大量的甜菜碱(江香梅等,2002)。在植物中甜菜碱以胆碱为底物2步合成(Hanson et al., 1982;McCue et al., 1990):
在前期获得13个小黑杨转betA基因株系的基础上,选取生长正常的T1、T2、T3、T4、T5、T6、T7、T8、T9共9个株系,1个对照株系T0。每个株系剪取长15 cm、直径1 cm的插条75个,分别扦插于75个塑料桶内,10个株系一共扦插750桶,放入温室中培养。扦插用的基质为草炭土和沙子按3:1体积比均匀混合而成。待扦插苗的高度长至0.6 m左右时,进行0、10 0、140、170和200 mmol·L-1 5个浓度的NaCl盐胁迫处理,每个浓度重复3次,每小区5桶。在盐处理的第2、7、12、17、22天取叶片测定甜菜碱含量,并对测定结果进行方差和动态变化分析。同时在盐胁迫处理60 d后,观察各株系的盐害程度,并测量株高,综合分析其耐盐性。
盐害分级标准 0级:无盐害症状;1级:轻度盐害,有少部分叶尖、叶缘或叶脉变黄;2级:中度盐害,有大约1/2的叶尖、叶缘焦枯;3级:重度盐害,大部分叶尖、叶缘焦枯或部分叶片脱落;4级:极重度盐害,枝枯,叶片全部脱落。盐害指数计算公式为:盐害指数(D)=∑(盐害级值×相应盐害级值株数)/(总株数×盐害最高级值)×100%。
甘氨酸甜菜碱的提取、含量测定及标准曲线的绘制按李优琴等(1999)的方法。
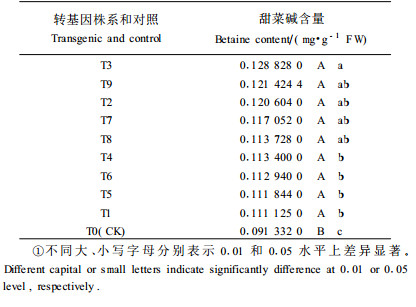
2 结果与分析 2.1 转基因株系及非转基因对照在盐胁迫下甜菜碱含量的多重比较分析对9个转基因株系和1个对照株系,经4种盐浓度处理,测定5个不同时间叶片的甜菜碱含量,并进行方差分析。结果10种试验材料的甜菜碱含量差异达到极显著水平(F0.01 =8.58)。多重比较(表 1)表明:在5%的显著水平下,除了转基因株系T3与T4、T6、T5、T1、T0之间差异显著外,其他的转基因株系之间无显著性差异,但各转基因株系与非转基因对照间差异均显著;在1%的显著水平下,各转基因株系之间无显著性差异,而各转基因株系均与非转基因对照间存在显著性差异,说明转入的外源基因在各转基因株系中均已表达。9个转基因株系的甜菜碱含量平均值超过非转基因株系的27.1%。甜菜碱含量最高的T3超过非转基因株系的39.1%,最低的T1甜菜碱含量也超过非转基因株系的19.6%。
|
|
在正常浇水的非盐胁迫条件下,在22 d内5次测定了9个转基因株系及对照的甜菜碱含量,将转基因株系甜菜碱含量的平均值与对照株系比较,结果转基因株系与对照株系的甜菜碱含量随着盐胁迫时间的增加均呈现增高—降低—再增高—再降低的动态变化趋势,但转基因株系的甜菜碱含量始终高于对照株系,说明转基因株系除了本底的甜菜碱合成外,转入的外源胆碱脱氢酶基因已经表达,从而增加了转基因株系甜菜碱的含量(图 1)。从图 1可以看出,转基因小黑杨在20 d的生长发育期内,甜菜碱含量有逐渐增加的趋势;而非转基因对照株系的甜菜碱含量增加不明显。

|
图 1 非盐胁迫条件下转基因株系与对照的甜菜碱含量动态变化 Fig. 1 The change of betaine content in transgenic and control plants under the normal growth condition |
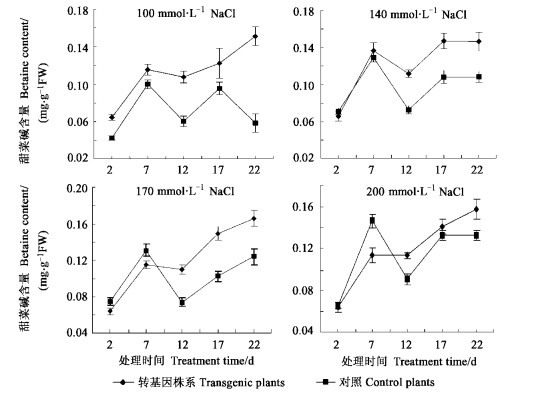
在不同盐胁迫条件下,9个转基因株系的平均甜菜碱含量,随着盐处理时间的延长,甜菜碱基本呈现逐渐增加的趋势(图 2)。在140、170和200 mmol·L-1的NaCl浓度条件下,在盐处理初期(7 d之前),非转基因对照的甜菜碱含量增加明显并且逐渐高于转基因株系,但到12 d之后,非转基因株系的甜菜碱含量一直低于转基因株系,这一表现是非转基因株系对高盐逆境的一种初期应急性反应;转基因株系对于这种高盐逆境反应迟钝,主要是由于外源基因的转入增加了甜菜碱含量,对高盐逆境较适应的结果。
|
图 2 各转基因株系与对照在不同盐胁迫条件下甜菜碱含量的变化 Fig. 2 Betaine content in transgenic and control plants under different salt stress conditions |
在连续给予盐胁迫40 d后,统计每个株系在4种不同盐浓度下的平均盐害指数(图 3)。由图 3可以看出,各转基因株系的盐害指数均较非转基因对照株系低。盐害指数最高的非转基因对照T0达到0.92;转基因各株系中,T5的盐害指数最低为0.67,T1、T3、T6盐害指数均为0.75,其余转基因各株系盐害指数均为0.81,转基因株系的平均盐害指数较对照低15.8%。因此各转基因株系均较非转基因对照的耐盐性高。

|
图 3 各转基因株系及对照的盐害指数 Fig. 3 The index of salt damages to transgenic plants and control plants |
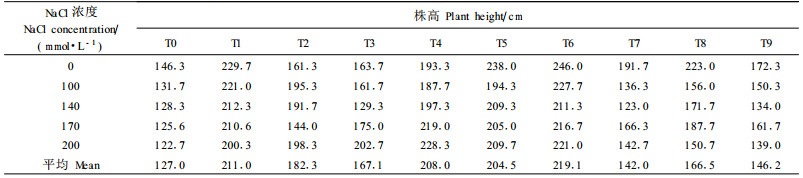
测定了各转基因株系经不同盐胁迫处理2个月后的株高(表 2)。方差分析表明,转基因株系及对照间差异达到极显著水平(F=14.22)。转基因株系在NaCl各浓度下的平均高度超过对照44.1%,其中T4、T6、T5、T1生长速度快、耐盐性高,可选作优良株系。
|
|
另外,在非盐处理下对照的株高也显著低于转基因株系。其原因是用于耐盐试验的9个转基因株系是从13个转基因株系中选择出来的表现正常、生长健壮的株系。未中选的4个转基因株系呈畸形状态,生长缓慢,这可能是外源基因随机插入造成某些基因破坏的结果;而被选择的9个株系,外源基因的插入未破坏原来基因的结构,反而增加了甜菜碱的含量,提高了细胞的渗透性,同时甜菜碱具有保护生物大分子稳定性的能力,这些均改善了转基因株系的代谢水平,使转基因株系株高在未进行盐处理的条件下较对照高。
3 讨论本研究所采用的betA基因来自大肠杆菌(Escherchia coli)基因组,它编码的胆碱脱氢酶能够由底物一步合成甜菜碱,因此广泛用于植物的耐盐转基因研究。Lilius等(1996)将betA基因导入烟草(Nicotiana tabacum),获得了耐盐性(300 mmol·L-1NaCl)提高80%(以质量计)的转基因植株。Holmstrom等(2000)将betA基因转入烟草,同样也获得了较强的耐盐性。王淑芳等(2001)将betA基因导入番茄(Lycopersicon esculentum)中,在150、200 mmol·L-1 NaCl处理下,转基因番茄与对照番茄相比叶片质膜透性分别低约14%、23%,统计分析表明,差异达显著水平。由于甜菜碱合成途径比较简单,遗传操作方便,所以甜菜碱合成酶基因被认为是重要、有希望的盐胁迫抗性基因之一。本研究通过农杆菌介导法将betA基因转入小黑杨基因组中,对9个转基因株系的耐盐性试验结果表明,转基因株系较非转基因株系的耐盐性显著提高,在140 mmol·L-1 NaCl处理40 d的条件下,转基因株系叶片受害较轻甚至看不出盐害,而非转基因对照叶片全部脱落。
转基因株系间生长量大小也存在明显差异。由于这些转基因株系来自于同一个无性系,原来基因型完全相同,遗传转化后它们的差异主要是由于外源基因插入位点不同造成的,这些材料为今后进一步研究外源基因的插入位点及其周围基因的结构功能提供了物质基础。
虽然由35S组成型启动子转录的外源胆碱脱氢酶基因(betA)不受外界环境所诱导,由该基因最终合成的甜菜碱也不受盐的影响,但转基因株系本底的与甜菜碱合成相关基因将被诱导,因此随着盐胁迫时间的增加,转基因株系的甜菜碱含量增加。由于本底基因与外源基因的双重作用,转基因株系的甜菜碱含量较对照高(图 2),耐盐性也较对照高(图 3)。
郭北海, 张艳敏, 李洪杰, 等. 2000. 甜菜碱醛脱氢酶(BADH)基因转化小麦及其表达. 植物学报, 42(3): 279-283. DOI:10.3321/j.issn:1672-9072.2000.03.012 |
何锶洁, 董伟, 李慧芬, 等. 1999. 转甜菜碱醛脱氢酶基因玉米及其耐盐性研究. 高技术通讯, (2): 50-52. |
江香梅, 黄敏仁, 王明庥. 2002. 植物甜菜碱合成途径及基因工程研究进展. 中国生物工程杂志, 22(4): 49-56. |
李银心, 常凤启, 杜立群, 等. 2000. 转甜菜碱醛脱氢酶基因豆瓣菜的耐盐性. 植物学报, 42(5): 480-484. |
李优琴, 高家骅, 周维仁, 等. 1999. 比色法测定合成甜菜碱的含量. 江苏农业学报, 15(2): 127-128. |
梁峥, 马德钦, 汤岚, 等. 1997. 菠菜甜菜碱醛脱氢酶基因在烟草中的表达. 生物工程学报, 13(3): 236-240. |
刘凤华, 郭岩, 谷冬梅, 等. 1997. 转甜菜碱醛脱氢酶基因植物的耐盐性研究. 遗传学报, 24(1): 54-58. |
王淑芳, 王峻岭, 赵彦修, 等. 2001. 胆碱脱氢酶基因的转化及转基因番茄耐盐性的鉴定. 植物生理学报, 27(3): 248-252. DOI:10.3321/j.issn:1671-3877.2001.03.010 |
杨传平, 刘桂丰, 梁宏伟, 等. 2001. 耐盐基因betA转化小黑杨的研究. 林业科学, 37(6): 34-38. DOI:10.3321/j.issn:1001-7488.2001.06.007 |
Hanson A D, Hitz W D. 1982. Metabolic responses of mesophytes to plant water deficits. Annu Rev Plant Physiol, 33: 163-203. DOI:10.1146/annurev.pp.33.060182.001115 |
Holmstrom K O, Somersalo S, Mandal A, et al. 2000. Improved tolerance to salinity and low temperature in transgenic tobacco producing glycine betaine. J Exp Bot, 51(343): 177-185. DOI:10.1093/jexbot/51.343.177 |
Lilius G, Holmberg N, Bulow L. 1996. Enhanced NaCl stress tolerance in transgenic tobacco expressing bacterial choline dehydrogenase. Bio Technol, 14: 177-180. |
McCue K F, Hanson A D. 1990. Drought and salt tolerance: towards understanding and application. Tibtech, 8: 358-362. DOI:10.1016/0167-7799(90)90225-M |
 2006, Vol. 42
2006, Vol. 42