文章信息
- 孔祥波, 张真, 王鸿斌, 王艳军, 孔庆辉.
- Kong Xiangbo, Zhang Zhen, Wang Hongbin, Wang Yanjun, Kong Qinghui.
- 枯叶蛾科昆虫性信息素的研究进展
- Investigation on Sex Pheromones in Lasiocampidae: Advance and Prospect
- 林业科学, 2006, 42(6): 115-123.
- Scientia Silvae Sinicae, 2006, 42(6): 115-123.
-
文章历史
- 收稿日期:2004-12-24
-
作者相关文章
2. 内蒙古克什克腾旗林业局森防站 克什克腾 025350;
3. 山东省荣成市埠柳镇人民政府 荣成 264322
2. Station of Control and Quarantine of Forest Pest, Keshiketeng Banner Forestry Bureau, Inner Mongolia Keshiketeng 025350;
3. People Government of Buliu Town, Rongcheng, Shandong Province Rongcheng 264322
枯叶蛾科(Lasiocampidae)属于鳞翅目(Lepidoptera), 包括许多重大的森林害虫, 其中松毛虫属(Dendrolimus)的一些种类就是它们的代表。全世界共有30余种松毛虫, 分布在中国的27种松毛虫中, 危害严重、分布较广的有6种, 即:马尾松毛虫(Dendrolimus punctatus)、落叶松毛虫(D. superans)、油松毛虫(D. tabulaeformis)、云南松毛虫(D. houi)、赤松毛虫(D. spectabilis)和思茅松毛虫(D. kikuchii)(侯陶谦, 1987; 陈昌洁, 1990)。这类害虫是我国最严重的森林害虫, 种类多、分布广、繁殖力极强。猖獗时, 针叶全部被食尽, 似火烧一般, 轻者成片枯黄, 影响松林健康成长, 重者使松林大面积枯死, 故有“不冒烟的森林火灾”之称。寻找有效的种群监测手段是对松毛虫进行综合治理的重要一环。
自从1959年鳞翅目昆虫家蚕(Bombyx mori)的性信息素(蚕蛾醇, bombykol)被鉴定以来(Butenandt et al., 1959), 由于其化学结构比较简单以及在害虫监测和防治中具有广阔的应用前景, 引起了研究人员的极大关注。到目前为止已鉴定出9个目90多个科1 500多种昆虫性信息素的化学结构(Voerman, 1988; Daly et al., 1998), 其中已有400多种鳞翅目昆虫性信息素得到鉴定。由于昆虫性信息素(sex pheromone)涉及到生物生殖这一基本行为, 因此, 它们具有种属专一性。这些化合物在同一地域发生的昆虫近缘种种间生殖隔离中发挥着重要作用。昆虫近缘种的种间生殖隔离策略的一个重要方面是依赖于不同物种所具有的多组分性信息素的种的特异性, 这种特异性的获得是通过性信息素成分、比例、释放速率等方面的差异而得以实现(Roelofs, 1995; Baker et al., 1981)。昆虫性信息素的研究已是化学生态学中具有理论意义和实际应用价值的重要领域。松毛虫性信息素的研究在我国始于20世纪60年代, 但由于腺体中性信息素成分的含量极微, 结构鉴定非常困难, 在二十多年中都未获得重大突破。自20世纪80年代以来, 随着分析手段的提高, 有一些种类的信息素组分陆续得以鉴定。因此, 笔者就枯叶蛾科昆虫性信息素种的特异性、生物合成及其应用现状综述如下。
1 枯叶蛾科昆虫性信息素通讯系统 1.1 松毛虫属昆虫性信息素种的特异性昆虫性信息素的一个主要特征是具有高度种属专一性, 其通常利用多组分性信息素成分作为种内化学通讯信道(Klun et al., 1975; Silverstein et al., 1976; Linn et al., 1986; Jurenka et al., 1993; Roelofs, 1980, 1995)。用多种信号化合物进行通讯, 容易实现种属专一性。共地域发生的近缘种昆虫之间实现种间生殖隔离主要是依赖于不同物种所具有的多组分性信息素的种的特异性, 而不是依赖于性信息素中某一特定的化合物成分, 因为只有完整的性信息素才能激起同种昆虫其他个体的最大行为反应(Linn et al., 1986; 1988; Löfstedt et al., 1991)。多组分性信息素不同组分的比例、几何异构体、光学异构体的细微差异等都能导致性信息素生物活性的很大改变(Silverstein, 1979; Seybold, 1993; Mori, 1996)。同一物种昆虫性信息素也存在着地理种群的差异(Klun et al., 1975; Roelofs et al., 1985; Seybold et al., 1995; Miller et al., 1997)。这些现象都反映出昆虫利用性信息素作为化学通信信道的复杂性, 性信息素化学结构和活性间的微妙关系以及结构和种间生殖隔离的奥秘。
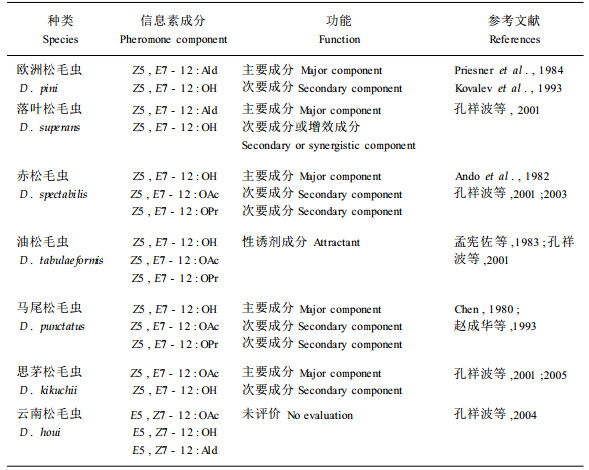
目前, 枯叶蛾科昆虫中对松毛虫属昆虫性信息素的研究最为全面(表 1)。例如马尾松毛虫, 从1973到1980年, 人们就对马尾松毛虫性引诱现象进行了初步观察, 并对其性信息素成分进行了鉴定, 最终确定马尾松毛虫性信息素组分是由顺-5, 反-7-十二碳二烯醇(Z5, E7-12:OH)、顺-5, 反-7-十二碳二烯乙酸酯(Z5, E7-12:OAc)和顺-5, 反-7-十二碳二烯丙酸酯(Z5, E7-12:OPr)3种成分组成, 并初步确定这3种成分在腺体中的比例是5:3:2(中国科学院动物研究所昆虫外激素组, 1973; 中国科学院动物研究所昆虫外激素组等, 1976; 1979)。进一步的研究表明:马尾松毛虫性信息素中各成分比例的变化与芜菁夜蛾(Agrotis segetum)中的情况一样, 不同个体间的比例有较大的差异(Löfstedt et al., 1985), 这3种成分比例的变化对马尾松毛虫诱蛾效果影响不大; 利用腺体提取和毛细柱气相色谱技术确定马尾松毛虫性信息素3种主要成分的平均比例是47:39:14 (赵成华等, 1993)。对马尾松毛虫性信息素受体系统研究发现5种特异细胞, 每种细胞分别对Z5, E7-12:OH、反-5, 顺-7-十二碳二烯醇(E5, Z7-12:OH)、Z5, E7 -12:OAc、反-5, 顺-7-十二碳二烯乙酸酯(E5, Z7-12:OAc)和Z5, E7-12:OPr产生反应(Priesner et al., 1984)。通过对马尾松毛虫性信息素腺体中的脂肪酰分析, 发现腺体中除含有大量的顺-5, 反-7-十二碳二烯脂肪酰(Z5, E7-12:Acyl)性信息素前体外, 还含有少量的反-5, 顺-7-十二碳二烯脂肪酰(E5, Z7-12:Acyl) (赵成华等, 1993)。马尾松毛虫性信息素腺体提取物中还发现顺-5-十二碳烯乙酸酯(Z5-12:OAc)和顺-5-十二碳烯醇(Z5-12:OH)2种单烯化合物。E5, Z7 -12:OH及其乙酸酯和丙酸酯加上2个单烯化合物对Z5, E7-12:OH及其乙酸酯和丙酸酯有明显的增效作用(赵成华等, 1993)。当人工合成的信息素生物合成激活神经肽(PBAN)或脑提取物注入去头的马尾松毛虫雌蛾腹部后, Z5, E7-12:OH的含量较正常雌蛾有很大的增长; 同时也发现了顺-5, 反-7-十二碳二烯醛(Z5, E7-12:Ald), 其含量可达每腺体1.1 ng(Zhao et al., 2002)。然而当诱芯中(诱芯成分:Z5, E7-12:OH及其乙酸酯和丙酸酯)加20%的Z5, E7-12:Ald时, 对这种诱芯的诱蛾效果有明显的抑制作用; 当Z5, E7-12:Ald的含量为5%时, 其抑制效果不甚明显。
|
|
与马尾松毛虫相比, 欧洲松毛虫(D. pini)性信息素的主要成分是Z5, E7-12:Ald, 而Z5, E7-12:OH可能是由于含量太低而未得到检测(Priesner et al., 1984)。但Löfstedt 1985年分析欧洲松毛虫性信息素腺体提取物时发现腺体中有少量的Z5, E7 -12:OH存在, 还发现了顺-5-十二碳烯醛(Z5-12:Ald)和Z5-12:OH的前体物质顺5-十二碳烯酸(Z5-12:COOH)(赵成华, 1986, 私人通讯)。Kovalev等(1993)使用选择性离子监测的办法发现欧洲松毛虫性信息素腺体提取物中有Z5, E7-12:OH存在, 并且证明其对Z5, E7-12:Ald的诱蛾效果有很好的增效作用, 最终确定Z5, E7-12:OH是欧洲松毛虫性信息素的次要成分。田间试验证明:反-5, 顺-7-十二碳二烯醛(E5, Z7-12:Ald)或Z5, E7-12:OAc在诱芯中的含量(1%时对Z5, E7-12:Ald的诱蛾活性有强烈的抑制作用(Priesner et al., 1984)。欧洲松毛虫单细胞记录研究表明:其雄虫触角有4种不同的细胞受体类型, 每1种受体类型只能感知一种特定的化合物, 这4种不同的细胞受体类型所对应的4种特定化合物分别是Z5, E7-12:Ald、E5, Z7-12:Ald、E5, Z7-12:OH和Z5, E7-12:OAc。这说明雄虫触角不但存在感知性信息素成分的细胞受体, 而且还存在感知性信息素抑制剂的细胞受体。马尾松毛虫雄虫触角内5种细胞感受器中仅有2种细胞感受器与欧洲松毛虫相似。雄虫触角不同类型细胞感受器同时存在的事实一方面说明了信息素系统的复杂性及其在近缘种生殖隔离中的重要作用; 另一方面说明了昆虫触角的化学感受器不仅是识别本种昆虫特有的性信息素成分, 而且还有探测其他种昆虫或寄主植物所产生的化学信号的功能。
落叶松毛虫(D. superans)可能的性引诱剂是醛(64%Z5, E7-12:Ald, 10%Z5- 12:Ald, 18%反-7-十二碳烯醛(E7-12:Ald)和8%反-6-十二碳烯醛(E6-12:Ald))和醇(64%Z5., E7-12:OH, 10% Z5-12:OH, 18%反-7-十二碳烯醇(E7 -12:OH)和8%反-6-十二碳烯醇(E6-12:OH))的混合物, 而Z5, E7-12:OAc对Z5, E7-12:Ald有明显的抑制作用(Klun et al., 2000)。该田间性诱剂筛选试验的不足之处是, 其使用的诱芯成分中Z5, E7-12:Ald和Z5, E7-12:OH的纯度仅为64%, 其中还含有Z5-12:Ald和Z5-12:OH(此2种成分为双烯化合物中的杂质), 低纯度的样品可能对田间诱蛾有影响。笔者研究落叶松毛虫(D. superans)性信息素单腺体提取物时发现了Z5, E7-12:OH、Z5, E7-12:Ald、Z5-12:Ald和Z5-12:OH 4种腺体成分, 以98:100: 69:80的比例存在(孔祥波等, 2001; Kong et al., 2001); 通过生物测定确认了Z5, E7-12:OH和Z5, E7-12:Ald是落叶松毛虫的性信息素成分。Khrimian等(2002)进一步证明了Z5, E7-12:OH和Z5, E7-12:Ald的诱蛾效果与活雌蛾的诱蛾效果一致。
赤松毛虫主要的性信息素成分是Z5, E7-12:OH, 在腺体内也发现了E5, E7-12:OH, 两者之比大约是5:1, 但发现只有前者有诱蛾活性, 而未发现后者对前者的增效作用(Ando et al., 1982)。进一步研究表明:赤松毛虫性信息素腺体中Z5, E7-12:OH和Z5, E7-12:OAc及Z5, E7-12:Ald以100:3.2 :5.6的比例存在。Z5, E7-12:OH、Z5, E7-12:OAc和Z5, E7-12:OPr(1:1:1配比)对赤松毛虫的诱蛾效果是Z5, E7-12:OH的3倍(孔祥波等, 2001; Kong et al., 2001)。最终证明Z5, E7-12:OAc和Z5, E7-12:OPr是赤松毛虫的次要性信息素成分(孔祥波等, 2003)。油松毛虫的性信息素成分还没有鉴定, 但其触角电位(EAG)研究表明, Z5, E7-12:OAc、Z5, E7-12:OH和Z5, E7-12:OPr均能激起很强的EAG反应(伍德明, 1982), 其在腺体中以100:47:29的比例存在(孔祥波等, 2001)。田间试验证明这3种成分在诱蛾时都是必需的(孟宪佐等, 1983)。
思茅松毛虫性信息素腺体中含有Z5, E7-12:OAc和Z5, E7-12:OH, 以100:22的比例存在(孔祥波等, 2001; 2005)。思茅松毛虫气相色谱和触角电位联用(GC-EAD)研究发现雄虫触角对Z5, E7-12:OAc反应最强, 对Z5, E7-12:OH反应较弱。Z5, E7-12:OAc和Z5, E7-12:OH的比例接近腺体成分的比例时, 诱蛾效果最好; 当这2种成分的比例远离腺体成分的比例时, 诱蛾效果下降(数据未发表)。
在云南松毛虫性信息素腺体中发现E5, E7-12:OH及其相应的醛和乙酸酯3种腺体成分, 但未评价其生物活性(孔祥波等, 2004)。云南松毛虫雄虫触角中肯定存在对Z5, E7-12:Ald, E5, Z7-12:Ald, Z5, E7-12:OAc, E5, Z7-12:OAc, E5, Z7-12:OH 5种化合物反应敏感的细胞受体(数据未发表)。
根据性信息素成分的差异, 将松毛虫属昆虫性信息素分为2种类型:第1种类型性信息素是以Z5, E7-12:Ald为主要成分, 它不含任何酯类成分。欧洲松毛虫和落叶松毛虫性信息素均属此类(Priesner et al., 1984; Kovalev et al., 1993; 孔祥波等, 2001)。第2种类型性信息素是以Z5, E7-12:OH或Z5, E7-12:OAc为主要成分, 但不含相应的醛。分布于东北和华北的赤松毛虫(Ando et al., 1982; 孔祥波等, 2001; 2003), 分布于华北、陕西和四川的油松毛虫(孟宪佐等, 1983; 孔祥波等, 2001)和分布于淮河以南各省区的马尾松毛虫的性信息素均属此类(Chen, 1980; 赵成华等, 1993)。已发现第1种类型性信息素中的二烯醛成分是第2种类型性信息素的抑制剂, 而第2种类型性信息素中的乙酸酯成分又是第1种类型性信息素的抑制剂。目前研究发现云南松毛虫的性信息素成分可能是由反-5, 顺-7-十二碳二烯醇、醛和酯组成, 它可能是松毛虫属昆虫中第3种性信息素类型的代表。另外, 从几种主要性信息素成分在不同种松毛虫性信息素腺体内含量的变化来看, 其遵循一定的规律, 似乎与不同种松毛虫种群的地理分布有着必然的联系。例如Z5, E7-12:Ald在几种松毛虫性信息素成分中的变化规律是:从欧洲松毛虫以其作为主要性信息成分到落叶松毛虫、赤松毛虫, Z5, E7-12:Ald在性信息素腺体内的含量逐渐降低, 性信息素的功能逐渐减弱; 相反其作为性信息素抑制剂的潜能在赤松毛虫、马尾松毛虫和思茅松毛虫中逐渐加强; 发展到云南松毛虫, 其从顺反的构型转变到了反顺的构型。对松毛虫性信息素成分进行系统的分析, 获得各组分间的精确比例; 阐明某些性信息素成分的变化规律及在生殖隔离中扮演的角色; 进一步研究雄虫触角细胞受体的种类; 明确雌雄虫间性信息素协同进化的关系; 可为阐明各种松毛虫性信息素, 研制高效“仿生”诱芯以及性信息素生态遗传等方面提供重要的信息; 并从性信息素进化的角度阐明本属物种间的演化关系奠定基础。
1.2 天幕毛虫属昆虫性信息素种的特异性(表 2)|
|
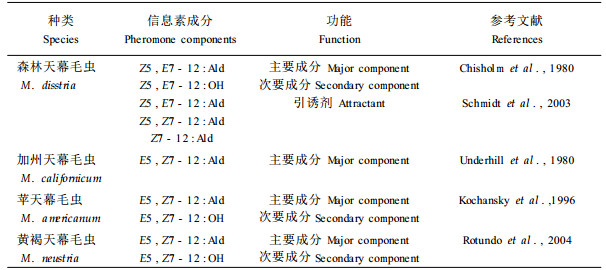
分布于北美的森林天幕毛虫(Malacosoma disstria)的性信息素成分是Z5, E7-12:Ald和Z5, E7-12:OH, 在其性信息素腺体中还发现了饱和的十二醛(Chisholm, 1980)。田间试验表明:单用Z5, E7-12:OH或Z5, E7-12:Ald都有很好的田间诱蛾效果, 两者以10:1或3:1的配比配制的诱芯诱蛾活性最高。在Z5, E7-12:OH(1.0 μg)和Z5, E7-12:Ald(0.1 μg)的诱芯中加入Z5, E7-12:OAc 5 ng, 在此浓度下没有发现其对醇和醛两组分诱芯有明显的增效或抑制作用。但是进一步的研究发现活雌蛾的引诱效果明显高于Z5, E7-12:OH和Z5, E7-12:Ald配制的诱芯; Z5, E7-12:Ald, 顺-5, 顺-7-十二碳烯醛(Z5, Z7-12:Ald)和顺-7-十二碳烯醛(Z7-12:Ald)3种成分以100:1:10的比例混合对森林天幕毛虫有很好的诱蛾效果(Schmidt et al., 2003)。但是在高释放速率[>64 μg·(24 h)-1]的情况下, 这3种成分单用或相互之间混用都能对森林天幕毛虫活雌蛾的引诱效果有很好的抑制作用(Chisholm et al., 1982; Palaniswamy et al., 1983)。加州天幕毛虫(M. californicum)的主要性信息素成分是E5, Z7-12:Ald, 且单用具有很好的诱蛾活性(Underhill et al., 1980)。E5, Z7-12:OH单用没有诱蛾活性, 与E5, Z7-12:Ald以1:1或1:10的比例混合, 对醛有一定的增效作用, 但在腺体提取物中只检测到醛的成分而未发现醇。苹天幕毛虫(M. americanum)的性信息素系统由E5, Z7 -12:Ald和E5, Z7-12:OH组成。单用E5, Z7-12:Ald, 其诱蛾效果不稳定, 但这2种成分以(2~5):1的比例配制的诱芯均有很好的诱蛾活性(Kochansky et al., 1996)。向E5, Z7-12:Ald的诱芯中加少量的E5, Z7-12:OAc(10%), 酯对醛没有抑制作用; 当E5, Z7-12:OAc与E5, Z7-12:Ald 1:1配比时, 酯对醛有很强的抑制。黄褐天幕毛虫(M. neustria)的性信息素腺体中含有Z5, E7-12:Ald、E5, Z7-12:Ald、Z5, E7-12:OH、E5, Z7-12:OH、Z5, E-12:OAc和E5, Z7-12:OAc 6种成分, 以0.3:1.6:0.1:1.0:0.8:0.6的比例存在。E5, Z7-12:Ald或Z5, E7-12:Ald与E5, Z7 -12:OH(3:1)配制的诱芯有很好的田间诱蛾活性(Konyukhov et al., 1988)。Rotundo等(2004)进一步指出E5, Z7-12:Ald是黄褐天幕毛虫的主要性信息素成分, E5, Z7-12:OH是次要成分。这2种成分以3:1或9:1的比例混合有很好的诱蛾活性, 以1:1的比例混合时, E5, Z7-12:OH对E5, Z7-12:Ald的诱蛾效果有一定的抑制作用。森林天幕毛虫以Z5, E7-12:Ald和Z5, E7-12:OH作为性信息素成分, 东部天幕毛虫以E5, Z7-12:Ald和E5, E7-12:OH作为性信息素成分。这2种松毛虫除成虫发生期稍有差异外, 性信息素通讯系统的差异是实现种间生殖隔离的重要条件之一。加州天幕毛虫和苹天幕毛虫的主要性信息素成分相同, 地理分布上仅有少量的交错发生区, 目前还未深入地探讨它们生殖隔离的机理。
枯叶蛾科松毛虫属和天幕毛虫属昆虫性信息素成分都有一个共同特点:性信息素分子是由12个碳原子组成的直链化合物且含1~2个碳碳双键, 双键都位于5位或5, 7位, 碳链末端具有醇、醛、酯官能团。这说明枯叶蛾科昆虫的性信息素系统既有同源性, 又有复杂、精细的变化, 以便更有效的进行种内化学通讯, 更好的调控近缘种的种间生殖隔离。到目前的研究水平, 松毛虫属昆虫都以顺-5, 反-7-十二碳二烯醇、醛、乙酸酯或丙酸酯作为性信息素成分; 天幕毛虫属昆虫有的以顺-5, 反-7-十二碳二烯醇、醛或乙酸酯作为性信息素, 有的以其反-5, 顺-7异构体作为性信息素成分。
2 松毛虫性信息素的生物合成路径及PBAN调控机制近20年来, 昆虫性信息素的生物合成, 生物合成的内分泌调控机理, 有关的分子水平的研究和化学通讯系统生态遗传等方面的研究都取得了一定的进展(Blum 1987; Prestwich et al., 1987; Cardé et al., 1997), 特别是鳞翅目昆虫性信息素的生物合成及内分泌调控的研究十分详细系统。在研究松毛虫属昆虫性信息素成分组成的基础上, 进一步对性信息素的生物合成机理进行研究, 对阐明本属昆虫性信息素间的关系具有重要意义。目前本属昆虫中仅马尾松毛虫性信息素生物合成路线已被阐明, 其他种类松毛虫的性信息素生物合成路径可由马尾松毛虫推导。通过阐明松毛虫性信息素的生物合成规律, 对从性信息素演化规律的角度揭示本属昆虫的系统发生规律, 在理论和应用上都具有重要的意义。枯叶蛾科昆虫主要性信息素成分的差别在于它们具有不同的末端官能团或分子构型。在其他蛾类昆虫中已经阐明它们各自的共轭双烯类性信息素的生物合成路径(Bjostad et al., 1984; Yamaoka et al., 1984; Martiner et al., 1990; Fang et al., 1995), 这些性信息素分子的共轭双烯形成机理各不相同。现以马尾松毛虫为例阐述松毛虫属昆虫5, 7位共轭双烯性信息素的生物合成路径。
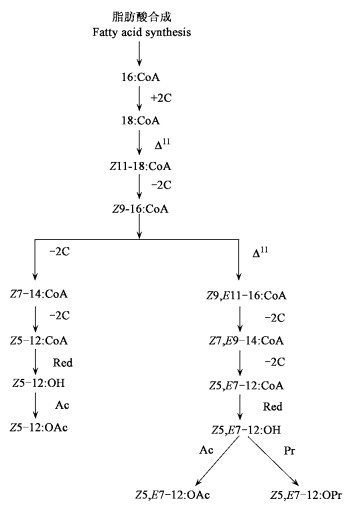
马尾松毛虫性信息素前体是具有相似结构的脂肪酸, 对其分析可为推导性信息素体内生物合成路径提供重要信息。利用气相色谱(GC)、气相色谱-质谱联用(GC-MS)及微量化学反应技术分析马尾松毛虫性信息素腺体中与性信息素结构有关的脂肪酸化合物, 根据结果进行了一系列放射性和稳定性同位素标记试验, 初步得出马尾松毛虫性信息素成分的生物合成路径(Zhao et al., 1999; 2004)。首先是十六碳脂肪酰(16:Acyl)经体内脂肪酸合成系统合成; 再经碳链加长(elongation)生成十八碳脂肪酰(18:Acyl); 18:Acyl经Δ11脱饱和化(Δ11 desaturation)生成顺-11-十八碳烯酰(Z11-18:Acyl); 然后Z11-18:Acyl经碳链缩短生成顺-9-十六碳烯酰(Z9-16:Acyl); 由Z9-16:Acyl直接经碳链缩短生成顺-7-十四碳烯酰(Z7-14:Acyl), 顺-5-十二碳烯酰(Z5-12:Acyl), 最后经还原生成顺-5-十二碳烯醇(Z5-12:OH)和经乙酰化生成顺-5-十二碳烯乙酸酯(Z 5-12:OAc)两个单不饱和性信息素次要成分。由Z9-16:Acyl再经Δ11脱饱和化生成顺-9, 反-11-十六碳烯酰(Z9, E11-16:Acyl), 然后经两次碳链缩短生成顺-5, 反-7-十二碳二烯酰(Z5, E7-12:Acyl), 经还原生成Z5, E7-12:OH, 再经乙酰化或丙酰化生成Z5, E7-12:OAc或Z5, E7-12:OPr性信息素成分(图 1)。
|
图 1 马尾松毛虫性信息素的生物合成途径(Zhao et al., 2004) Fig. 1 Pheromone biosynthetic pathway of D. punctatus (Zhao et al., 2004) Δ11:脱饱和化Desaturation; -2C:碳链缩短Chain shortening; Red:还原Reduction; Ac:乙酰化Acetylation; Pr:丙酰化Propionylation |
自从Raina等人从美洲棉铃虫(Helicoverpa zea)上发现性信息素生物合成激活神经肽(PBAN)并将其分离、鉴定以来(Raina et al., 1989), 有关PBAN作用机理的研究成为20世纪90年代昆虫性信息素研究的热点之一。现已在4种昆虫中阐明了PBAN的氨基酸序列(Rania et al., 1989; Kitamura et al., 1989; 1990; Duportets et al., 1998; Choi et al., 1998), 并证明PBAN之间有同源性且物种间无作用特异性。最新研究表明, PBAN与抑制神经肽(PSP)(即雄蛾性附腺因子)是控制蛾类性信息素体内生物合成的“开关”物质(司胜利等, 2000)。PBAN类似物对调控马尾松毛虫性信息素的生物合成起重要作用, 它是通过体液直接作用于性信息素腺体的。利用同位素标记性信息素前体物质的方法, 通过监测标记前体在性信息素成分中的结合率, 以此研究PBAN类似物调控性信息素的生物合成。研究表明, 去头的马尾松毛虫雌蛾性信息素的生成量显著降低; 如果注射Hez-PBAN或雌、雄蛾脑提取物, 则性信息素的生成量又恢复到正常水平。随着脑提取物刺激浓度的提高(0.25~4头当量), 性信息素生成量也逐渐升高, 性信息素的生成量与所用的刺激量之间呈线性关系。In vitro试验表明, 性信息素腺体在2头当量的脑提取物刺激下培育1 h时, 性信息素的生成量最高。性信息素腺体离体培养介质中Ca2+的存在对性信息素的生成是必需的(Zhao et al., 2002)。
3 松毛虫性信息素的应用 3.1 性信息素载体的选择在制备高效的“仿生”诱芯时, 选择合适的载体材料是十分重要的。由于松毛虫性信息素化学结构的特点, 有的诱芯载体对性信息素成分中共轭双键的几何构型易发生异构化作用, 对醇类性信息素易发生氧化作用, 使性信息素的诱蛾效果明显下降或完全失去诱蛾活性。对载体材料的选择通常有2点要求:1)能将性信息素均匀有效的释放到大气中。2)对性信息素有适当的保护, 使之不易被环境因子如光、氧气或其他化学因素所降解。
目前通常使用的一种诱芯载体是天然橡胶制成的橡胶塞。这种载体能对饱和的或含单烯结构的醇、醛、酯类性信息素成分提供有效的保护和化学稳定性。但共轭双烯类性信息素(如松毛虫性信息素)在这种诱芯载体中易发生异构化作用而转变为无活性的其它异构体, 有时这些异构体对性信息素还有抑制作用, 从而给田间应用带来不利的影响(荆慧荣等, 1996)。另外性信息素在这种载体中的散放性能也不稳定。松毛虫性信息素成分在硅橡胶中的异构化速度很慢, 但是用它作为性信息素诱芯时常常会由于散放性能不佳而使田间诱蛾活性下降(高伟等, 2001)。马尾松毛虫性信息素在不同类型诱芯中的稳定性研究表明, 与常用的天然橡胶诱芯相比, 诱芯中加入抗氧化剂(topanol CA), 提高性信息素的纯度, 或将载体换为硅橡胶等处理均不能明显提高诱芯的诱蛾效果。然而将载体改为复合橡胶(氯化丁基橡胶和天然橡胶的混合体)后, 诱芯诱蛾效果比天然橡胶诱芯提高了1倍以上(高伟等, 2001)。这是因为这种橡胶以酚醛树酯作硫化剂, 其含硫量为零, 而天然橡胶的含硫量为0.8%。硫是共轭双烯化合物异构化的催化剂, 以复合橡胶制成的诱芯在田间使用时, 共轭双烯类性信息素异构化程度很低。研究表明, 复合橡胶诱芯中只有12%~16%的不同性信息素成分发生异构化, 而在天然橡胶诱芯中异构化高达69%~87%(高伟等, 2001)。复合橡胶中氯化丁基的含量为30% ~70%, 这降低了性信息素的释放速率。这说明复合橡胶诱芯之所以具有较高的诱蛾效果, 主要由于在这种诱芯中, 共轭二烯性信息素更稳定, 释放速率较为缓慢且均匀。
3.2 松毛虫性信息素在预测预报上的应用自20世纪70年代以来, 杀虫剂对环境及天敌的负面效应已越来越受到人们的重视。寻找高效、低毒的杀虫剂、生物制剂, 对害虫种群进行综合治理是人们的共识。性信息素的应用在害虫综合治理(IPM)体系中占有重要地位。它不仅能有效监测害虫种群动态, 确定虫口密度, 也能成为大规模诱捕和迷向法防治害虫的重要措施。
松毛虫的林间监测是一项长期的系统工程。国家“六五”、“七五”攻关项目, 1991年联合国援越项目(赵成华, 1991, 私人通讯), 1994年联合国援华项目中都提出利用松毛虫性信息素进行种群监测。它具有灵敏度高、专一性强、无毒、无污染、使用方便和操作简单等优点。目前国内外农林部门已广泛采用性信息素监测害虫种群动态, 至今已有几十种性信息素测报剂型投放市场成为商品(杜家纬, 1988)。利用马尾松毛虫性信息素诱芯对安徽省宣州、潜山2地松毛虫种群动态进行监测, 结果表明:复合橡胶诱芯的有效性可持续40 d, 特别是在林间极低到中等虫口密度的情况下, 监测效果非常明显。性诱剂的诱蛾量与田间调查的幼虫数量有很大的关联性(张爱兵等, 2001)。zhang等(2003)进一步评价了诱捕器的悬挂高度、坡向、布点数量等因素与松毛虫诱蛾量以及种群动态变化的关系, 这为根据性诱剂的监测效果推测松毛虫的种群动态, 为其进一步大范围应用奠定了基础。但性信息素的诱蛾效果在很大程度上还受气候、降雨、风向等生态因子的影响。在诱捕器的空间配置、悬挂诱捕器的代表性立地的选择以及如何根据诱蛾的数量预报危害程度和级别等方面都需要多年的数据积累和系统研究。
4 展望枯叶蛾科昆虫中许多种是重要的森林害虫, 对该科昆虫性信息素进行全面系统的研究有利于我们更全面的了解该科昆虫的化学通讯机制及种间生殖隔离机理。目前性信息素在害虫监测研究中的主要方向应该是:1)对该科其它种昆虫进行性信息素结构鉴定, 以阐明多种昆虫的性信息素成分及其在种间生殖隔离中的作用。2)考虑生态环境因子的影响, 建立诱捕器诱捕量与林间种群密度的动态关系。提出防治指标, 为准确预测预报建立数学模型。3)性信息素的研究已从定性定量研究阶段逐步深入到分子水平的研究上, 这必将为从性信息素进化的角度提出生物物种进化方向、物种间相互关系提供坚实的理论基础, 推动昆虫性信息素的研究向着纵深方向发展。
陈昌洁. 1990. 松毛虫综合管理. 北京: 中国林业出版社, 5-8.
|
杜家纬. 1988. 昆虫信息素及其应用. 北京: 中国林业出版社.
|
高伟, 赵成华, 施再喜. 2001. 马尾松毛虫性信息素在不同类型诱芯中的稳定性. 昆虫学报, 44(2): 213-220. DOI:10.3321/j.issn:0454-6296.2001.02.014 |
侯陶谦. 1987. 中国松毛虫. 北京:科学出版社: 7-14. |
荆慧荣, 刘孟英. 1996. 几种橡胶载体对马尾松毛虫性信息素几何构型异构化的影响. 昆虫学报, 39(2): 126-131. DOI:10.3321/j.issn:0454-6296.1996.02.002 |
孔祥波, 赵成华, 高伟. 2001. 4种松毛虫性信息素成分及在近缘种生殖隔离中的作用. 科学通报, 46(17): 1435-1439. DOI:10.3321/j.issn:0023-074X.2001.17.007 |
孔祥波, 赵成华, 孙永平, 等. 2003. 赤松毛虫性信息素次要组分的鉴定——组分、电生理和田间效果. 昆虫学报, 46(2): 131-137. |
孔祥波, 赵成华, 张真, 等. 2004. 松毛虫性信息素共轭双键定位方法的研究. 色谱, 22(2): 97-100. DOI:10.3321/j.issn:1000-8713.2004.02.001 |
孔祥波, 张真, 王鸿斌, 等. 2005. 松毛虫性信息素微量成分鉴定方法的研究. 色谱, 23(4): 370-373. DOI:10.3321/j.issn:1000-8713.2005.04.009 |
孟宪佐, 王怀敏. 1983. 油松毛虫性诱剂的合成与林间活性试验. 林业科学, 19(2): 137-140. |
司胜利, 许少甫, 杜家纬. 2000. 烟夜蛾雄蛾性附腺因子对雌蛾性信息素合成的抑制作用. 昆虫学报, 43(2): 120-126. DOI:10.3321/j.issn:0454-6296.2000.02.002 |
伍德明. 1982. 四种松毛虫对性外激素成分及其类似物的触角电位反应. 森林病虫通讯, 1: 24. |
张爱兵, 谭声江, 高伟, 等. 2001. 应用性外激素监测马尾松毛虫发生数量的初步研究. 昆虫知识, 38(3): 211-214. DOI:10.3969/j.issn.0452-8255.2001.03.014 |
赵成华, 李群, 郭星宇, 等. 1993. 马尾松毛虫性引诱外激素的新成分:化学结构鉴定和田间试验. 昆虫学报, 36(2): 247-250. DOI:10.3321/j.issn:0454-6296.1993.02.022 |
中国科学院动物研究所昆虫外激素组. 1973. 马尾松毛虫成虫性引诱现象的初步观察. 昆虫学报, 16(1): 94-96. |
中国科学院动物研究所昆虫外激素组., 江西省森林病虫害防治试验站昆虫组., 中国科学院吉林应用化学研究所松毛虫外激素组. 1976. 马尾松毛虫性引诱外激素活性组分的柱层析分离. 昆虫学报, 19(4): 377-382. |
中国科学院动物研究所昆虫外激素组, 中国科学院吉林应用化学研究所松毛虫外激素组, 江西省森林病虫害防治试验站昆虫组. 1979. 马尾松毛虫性外激素的触角电位(EAG)活性组分E5, E7-12: OH的分离、鉴定与合成. 科学通报, 21: 1004-1008. |
Ando T, Vu M H, Yoshida S, et al. 1982. (5 Z, 7E)-5, 7-Dodecadien-1-ol: Female sex pheromone of the Pine Moth Dendrolimus spectabilis Butler. Agric Biol Chem, 46(3): 709-715. |
Baker T C, Eyer W, Roelofs W L. 1981. Sex pheromone dosage and blend specificity of response by male Oriental Fruit Moths. Entomol Exp Appl, 30: 269-279. DOI:10.1111/j.1570-7458.1981.tb03110.x |
Bjostad L B, Linn C E, Du J W, et al. 1984. Identification of new sex pheromone components in Trichoplusia ni predicted from biosynthetic precursors. J Chem Ecol, 10: 1309-1323. DOI:10.1007/BF00988113 |
Blum M S. 1987. Biosynthesis of arthropod exocrine compounds. Ann Rev Entomol, 32: 381-413. DOI:10.1146/annurev.en.32.010187.002121 |
Butenandt A, Beckfman R, Stamm D, et al. 1959. Uber den sexuallockstoff des seidenspinners Bombyx mori reinderstellung und konstitution. Z Naturforsch, 14: 283-284. |
Cardé R T, Minks A K. 1997. Insect pheromone research: new directions. New York: Chapman and Hall.
|
Chen T M. 1980. Orally presented in the 15th International Congress of Entomology held at Kyoto, Japan, August 3-9
|
Chisholm M D, Underhill E W, Steck W, et al. 1980. (Z)-5, (E)-7-Dodecadienal and (Z)-5, (E) -7-Dodecadien-1-ol, sex pheromone components of the Forest Tent Caterpillar, Malacosoma disstria. Environ Entomol, 9: 278-282. DOI:10.1093/ee/9.3.278 |
Chisholm M D, Palaniswamy P, Underhill E W. 1982. Orientation disruption of male forest tent caterpillar, Malacosoma disstria(Hübner) (Lepidoptera: Lasiocampidae), by air permeation with sex pheromone components. Environ Entomol, 11: 1248-1250. DOI:10.1093/ee/11.6.1248 |
Choi M Y, Tanaka M, Kataoka H, et al. 1998. Isolation and identification of the cDNA encoding the pheromone biosynthesis activating neuropeptide and additional neuropeptides in the oriental tobacco budworm, Helicoverpa assulta(Lepidoptera: Noctuidae). Insect Biochem Molec Biol, 28: 759-766. DOI:10.1016/S0965-1748(98)00065-4 |
Daly H V, Doyen J T, Purcell A H. 1998. Introduction to insect biology and diversity. Oxford: Oxford University Press, 680.
|
Duportets L, Dadenne C, Dufour M C, et al. 1998. The pheromone biosynthesis activating neuropeptide (PBAN) of the black cutworm mot, Agrotis ipsilon: immunohistochemistry, molecular characterization and bioassay of its peptide sequence. Insect Biochem Molec Biol, 28: 591-599. DOI:10.1016/S0965-1748(98)00033-2 |
Fang N, Teal P E A, Doolittle R E, et al. 1995. Biosynthesis of conjugated olefinic systems in the sex pheromone gland of female tobacco hornworm moths, Manduca sexta(L.). Insect Biochem Molec Biol, 25: 39-48. DOI:10.1016/0965-1748(94)00044-I |
Jurenka R A, Roelofs W L. 1993. Biosynthesis and endocrine regulation of fatty acid derived pheromones in moths. //Stanley-Samuelson D W, Nelson D R eds. Insect Lipids: Chemistry, Biochemistry, and Biology. University of Neraska Press, Lincoln, Nebraska, 353-388
|
Khrimian A, Klun J A, Hijji Y, et al. 2002. Synthesis of (Z, E)-5, 7-dodecadienol and (E, Z)-10, 12-hexadecadienol, lepidoptera pheromone components, via zinc reduction of enyne precursors, Test of pheromone efficacy against the Siberian moth. J Agric and Food Chem, 50(22): 6366-6370. DOI:10.1021/jf020472s |
Kitamura A, Nagasawa H, Kataoka H, et al. 1990. Amino acid sequence of pheromone biosynthesis activation neuropeptide-Ⅱ (PBAN-Ⅱ) of the silkworm, Bombyx mori. Agric Biol Chem, 54: 2495-2497. |
Kitamura A, Nagasawa H, Kataoka H, et al. 1989. Amino acid sequence of pheromone biosynthesis activating neuropeptide (PBAN) of the silkworm, Bombyx mori. Biophys Res, 163: 520-526. DOI:10.1016/0006-291X(89)92168-2 |
Klun J A. 1975. Insect sex pheromones: intraspecific pheromonal variability of Ostrinia nubilalis in North America and Europe. Environ Entomol, 4: 891-894. DOI:10.1093/ee/4.6.891 |
Klun J A, Baranchikov Y N, Mastro V C, et al. 2000. A sex attractant for the Siberian Moth Dendrolimus superans sibiricus(Lepidoptera: Lasiocampidae). J Entomol Sci, 35(2): 158-166. DOI:10.18474/0749-8004-35.2.158 |
Kochansky J, Hill A, Neal J W, et al. 1996. The pheromone of the eastern tent caterpillar, Malacosoma americanum(F.) (Lepidoptera: Lasiocampidae). J Chem Ecol, 22(12): 2251-2261. DOI:10.1007/BF02029544 |
Kong X B, Zhao C H, Gao W. 2001. Identification of sex pheromones of four economically important species in genus Dendrolimus. Chinese Sci Bull, 40: 2077-2082. |
Konyukhov V P, Kovalev B G. 1988. Sex pheromone of lackey moth (Malacosoma neustrium L). Females Bioorg Khim, 14: 268-272. |
Kovalev B G, Bolgar T S, Zubov P A, et al. 1993. Identification of additional components of the sex pheromone of dendrolimus pini. Chemistry of Natural Compounds (Historical Archive), 29(1): 135-136. DOI:10.1007/BF00631042 |
Linn C E Jr, Campbell M G, Roelofs W L. 1986. Male moth sensitivity to multicomponent pheromones: critical role of female-released blend in determining the functional role of components and active space of the pheromone. J Chem Ecol, 12: 659-668. DOI:10.1007/BF01012100 |
Linn C E Jr, Hammpond A, Du J W, et al. 1988. Specificity of male response to multicomponent pheromones in noctuid moths Trichoplusia ni and Pseudoplusia includens. J Chem Ecol, 14: 47-57. DOI:10.1007/BF01022530 |
Löfstedt C, Herrebout W, Menken S B J. 1991. Sex pheromones and their potential role in the evolution of reproductive isolation in small ermine moths. Chemoecol, 1: 1-9. |
Löfstedt C, Lanne S B, Lofqvist J, et al. 1985. Individual variation in the pheromone of the turnip moth Agrotis segetum. J Chem Ecol, 11(9): 1181-1196. DOI:10.1007/BF01024107 |
Martiner T, Fabrias G, Camps F. 1990. Sex pheromone biosynthetic pathway in Spodoptera littoralis and its activation by a neurohormone. J Biol Chem, 265: 1381-1387. |
Miller D R, Gibson K E, Raffa K F, et al. 1997. Geographic variation in response of pine engraver, Ips pini, and associated species to pheromone, lanierone. J Chem Ecol, 3(23): 2013-2031. |
Mori K. 1996. Molecular asymmetry and pheromone science. Biosci Biotech Biochem, 60: 1925-1932. DOI:10.1271/bbb.60.1925 |
Palaniswamy P, Chisholm M D, Underhill E W, et al. 1983. Disruption of forest tent caterpillar (Lepidoptera: Lasiocampidae) orientation to baited traps in aspen groves by air permeation with (5Z, 7E)-5, 7-dodecadienal. J Econ Entomol, 76: 1159-1163. DOI:10.1093/jee/76.5.1159 |
Prestwich G D, Blomquist G J. 1987. Pheromone Biochemistry. Academic Press, Orlando, Florida
|
Priesner E, Bogenschutz H, Albert R, et al. 1984. Identification and field evaluation of a sex pheromone of the European Pine Moth. Z Naturforsch:C, 39: 1192-1195. DOI:10.1515/znc-1984-11-1236 |
Raina A K, Jaffe H, Kempe T G, et al. 1989. Identification of a neuropeptide hormone that regulates sex pheromone production in female moths. Science, 244: 796-798. DOI:10.1126/science.244.4906.796 |
Roelofs W L. 1995. Chemistry of sex attraction. Proc Natl Acad Sci USA, 92: 44-49. DOI:10.1073/pnas.92.1.44 |
Roelofs W L. 1980. Pheromones and their chemistry//Locke M and Smith D S eds. Insect Biology in the Future. Academic Press, New York, 583-602
|
Roelofs W L, Du J W, Tang X H, et al. 1985. Three European corn borer populations in New York based on sex pheromones and voltinism. J Chem Ecol, 11: 829-836. DOI:10.1007/BF01012071 |
Rotundo G, Germinara G S, Cristofaro A D. 2004. Chemical, electrophysiological, and behavioral investigations on the sex pheromone of Lackey Moth, Malacosoma neustrium. J Chem Ecol, 30(10): 2057-2069. DOI:10.1023/B:JOEC.0000045595.75746.42 |
Seybold S J. 1993. Role of chirality in olfactory-directed behavior: Aggreation of pine engraver bettles in the genus Ips(Coleoptera: Scolytidae). J Chem Ecol, 19: 1809-1831. DOI:10.1007/BF00982310 |
Seybold S J, Ohtsuka T, Wood D L, et al. 1995. Enantiomeric composition of ipsdienol: A chemotaxonomic character for north american populations of Ips spp. in the pini subgeneric group (Coleoptera: Scolytidae). J Chem Ecol, 21: 995-1016. DOI:10.1007/BF02033804 |
Schmidt B C, Roland J, Wakarchuk D. 2003. Evaluation of synthetic pheromones for monitoring forest tent caterpillar (Lepidoptera: Lasiocampidae) Populations. Environ Entomol, 32(1): 214-219. DOI:10.1603/0046-225X-32.1.214 |
Silverstein R M. 1979. Enantiomeric composition and bioactivity of chiral semiochemicals in insects//Ritter F J eds. Chemical Ecology: Odour Communication Ⅰ Animals. Elsevier/North Holland biomedical Press, Amsterdam, 133-146
|
Silverstein R M, Young J C. 1976. Insects generally use multi-component pheromones//Beroza M eds. Pest Management with Insect Sex Attractants and Other Behavior-Controlling Chemicals. ACS Symposium Series No. 23. American Chemical Society, Washington, D C, 1-29
|
Underhill E W, Chisholm M D, Steck W. 1980. (E)-5, (Z)-7-Dodecadienal, a sex pheromone component of the western tent caterpillar, Malacosoma californicum (Lepidoptera, Lasiocampidae). Can Entomol, 112: 629-631. DOI:10.4039/Ent112629-6 |
Voerman S. 1988. The pheromone bank: a collection of unsaturated compounds indispensable for discovery of sex attractants for Lepidoptera. Agric Ecosys Environ, 21: 31-41. DOI:10.1016/0167-8809(88)90137-5 |
Yamaoka R, Taniguchi Y, Hayashiya K. 1984. Bombykol biosynthesis from deuterium-labeled (Z)-11-hexadecenoic acid. Experientia, 40: 80-81. DOI:10.1007/BF01959112 |
Zhang A B, Wang Z J, Tan S J, et al. 2003. Monitoring the masson pine moth, Dendrolimus punctatus(Walker) (Lepidoptera: Lasiocampidae) with synthetic sex pheromone-baited traps in Qianshan County, China. Appl Entomol Zool, 38(2): 177-186. DOI:10.1303/aez.2003.177 |
Zhao C H, Adlof R O, Löfstedt C. 2004. Sex pheromone biosynthesis in the pine caterpillar moth, Dendrolimus punctatus (Leptidoptera: Lasiocampidae): pathways leading to Z5-monoene and 5, 7-conjugated diene components. Insect Biochemistry and Molecular Biology, 34: 261-271. DOI:10.1016/j.ibmb.2003.10.005 |
Zhao C H, Li Q, Gao W. 2002. Stimulation of sex pheromone production by PBAN-like substance in the pine caterpillar moth, Dendrolimus punctatus(Lepidoptera: Lasiocampidae). Arch Insect Biochem Physiol, 49(3): 137-148. DOI:10.1002/arch.10010 |
Zhao C H, Li Q, Adlof R O, et al. 1999. Biosynthesis and PBAN regulation of 5, 7-conjugated diene sex pheromone in the Pine Caterpillar Moth, Dendrolimus punctatus (Lepidoptera: Lasiocampidae). First Asia-Pacific Conference on Chemical Ecology, Nov. 1-4, Shanghai, China, 54-55
|
 2006, Vol. 42
2006, Vol. 42