文章信息
- 杜丽, 叶要妹, 包满珠.
- Du Lix, Ye Yaomeix, Bao Manzhux.
- 香樟未成熟合子胚体胚发生及植株再生研究
- Study on Somatic Embryogenesis and Plant Regeneration of Immature Zygotic Embryo of Cinnamomum camphora
- 林业科学, 2006, 42(6): 37-39.
- Scientia Silvae Sinicae, 2006, 42(6): 37-39.
-
文章历史
- 收稿日期:2004-11-19
-
作者相关文章
2. 南阳师范学院 中英·南阳洛桑昆虫生物学联合实验室 南阳 473000
2. China-UK Nanyang Normal University-Rothamsted Research Joint Lab of Insect Biology Nanyang Normal University Nanyang 473000
香樟(Cinnamomum camphora)因含有特殊的香气和挥发油, 且耐湿、抗腐、祛虫、保存期长, 是贵重家具、高级建筑、造船和雕刻等的理想用材。近年来, 香樟在园林绿化中的应用越来越多。香樟组织培养再生途径, 无论是器官发生还是胚状体再生都没有成功报道。因为体胚发生途径有材料一致、容易处理、不受季节和植物发育阶段的限制等优点(贺红等, 1998), 因此也就成为农杆菌介导的基因转化体系中常用的再生手段(Mondal et al., 2001; Das et al., 2002)。体胚发生已有较多研究(Reidiboym-Talleux et al., 1999; Canhoto et al., 1999; Garin et al., 1999; Merkle et al., 2000; Vendrame et al., 2001; 闫国华等, 2002), 其中诱导未成熟合子胚的体胚发生较为常见。本文以香樟未成熟果实中的幼胚为材料, 对体胚发生作了系统的研究, 同时初步探讨了从胚性愈伤组织诱导植株再生的方法, 为建立体胚再生系统及应用生物技术改良香樟奠定基础。
1 材料与方法 1.1 材料7月中旬选取华中农业大学校园中1株性状优良、植株健壮香樟上的未成熟果实, 直径约1 cm左右, 经70%酒精浸泡45 s, 再用0.1%HgCl2溶液浸泡10 min后, 用无菌水冲洗3~5次, 在无菌条件下切开果实, 取出幼胚, 接种于培养基上。
1.2 体胚发生诱导方法将幼胚接种于培养基1[MS+1.0 mg·L-1 BA+ 0.1 mg·L-1 2, 4-D+700 mg·L-1 CH(水解酪蛋白)], 另加琼脂粉7.5 g·L-1, 蔗糖30 g·L-1, 诱导幼胚产生子叶状体胚。培养基保持121 ℃灭菌20 min之前pH调至6.0。(24±2) ℃, 暗培养。
1.3 香樟体胚的增殖、继代培养、诱导胚性愈伤组织及植株再生由香樟幼胚在培养基1诱导所得的体细胞胚, 切割分离后转到与培养基1相同的继代培养基上培养, 每4~6周转1次, 在黑暗中继代培养。将胚性愈伤组织转入培养基2[MS + 1 000 mg·L-1 ME(麦芽提取物) + 1.0 mg·L-1 NAA, 蔗糖30 g·L-1, 琼脂粉为7.5 g·L-1]进行体胚诱导, 6周之后将培养物转入促使其发育的培养基3(MS + 0.1 g·L-1 NAA + 3.0 g·L-1 BA + 1 mL·L-1Km-8p有机物), 4周之后将长大的体胚转入培养基4(MS + 0.1 mg·L-1 NAA+1.0 mg·L-1 BA+1.0 mg·L-1 GA3), 诱导不定芽的生长。培养4周之后将诱导出的不定芽切离母体转入培养基5(MS + 0.1 mg·L-1 NAA + 0.5 mg·L-1 BA + 0.5 mg·L-1 GA3)诱导其生长, 之后将茎切段(长度为2~3 cm)转入培养基6(MS + 1.0 mg·L-1 IBA)诱导生根, 形成完整植株。培养温度为(24±2)℃, 每天光照16 h, 光照强度为1 000 lx左右。
2 结果与分析 2.1 香樟幼胚体胚的发生将幼胚接种于培养基1上, 接种10 d左右, 环绕幼胚胚轴开始直接形成白色子叶状的结构, 一个月后统计体胚诱导率为76.7%, 平均体胚诱导数为3.09。香樟幼胚诱导获得的体胚的子叶大都多于2个, 甚至3~5个子叶聚合生长在一起, 不容易分离开来(图版Ⅰ-1)。

|
图版Ⅰ |
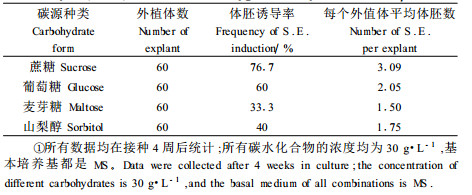
在进行碳源种类对体胚影响试验中, 不同碳源浓度都是30 g·L-1, 基本培养基是MS, 激素和有机附加物为1.0 mg·L-1 BA + 0.1 mg·L-1 2, 4-D + 700 mg·L-1 CH。在本试验中, 蔗糖的体胚诱导率和平均体胚数分别为76.7%和3.09;麦芽糖对于香樟体胚发生的诱导效果不如蔗糖, 诱导率只有33.3%;山梨醇和麦芽糖一样无论是体胚诱导率还是平均体胚数都低于蔗糖, 平均体胚数不足2(表 1)。在培养的过程中, 接种在以山梨醇和麦芽糖作为碳源的培养基上的外植体, 容易褐化死亡, 不适于香樟幼胚的体胚发生, 而Reidiboym-Talleux等(1999)在野樱桃(Prunus avium)诱导体胚发生中报道麦芽糖能够促进体胚发生和萌发, 这与本试验的结果不相符, 可能是碳源种类对于不同物种的体胚诱导作用并不相同。结果表明, 蔗糖是香樟体胚诱导的最佳碳源。
|
|
将子叶状结构切割分离继代后, 次生胚不但可以从体胚切割伤口形成, 而且从子叶的各个位置都有次生胚的出现(secondary somatic embryogenesis), 继代10个月后, 其中一部分的子叶状结构逐渐由白色的较大颗粒结构(图版Ⅰ-2)代替, 白色颗粒的形成随着继代次数的增加, 颗粒越来越小, 结构越来越紧密。同样培养基继代1~2年后, 一部分颗粒开始体积膨大愈伤化, 并逐渐在这些雪花状愈伤组织的表面形成细小分散的黄色颗粒状结构(图版Ⅰ-3); 这种雪花状的愈伤组织不能进行多次继代增殖, 容易褐化; 黄色颗粒(图版Ⅰ-4)则可以通过每隔15 d继代到培养基1上使状态得到保持, 如果黄色颗粒长时间不继代, 一个月后, 大多数黄色颗粒中会出现较大的白色颗粒(图版Ⅰ-5), 这些白色颗粒又会发育成白色子叶状结构(图版Ⅰ-6)。香樟的胚性材料(胚性愈伤组织和次生子叶胚)通过这种途径可以相互转化。5个胚性系(embryogenic line)就这样从同一来源的未成熟合子胚上多次增殖后建立并命名为L9, L11, L14, L22和L23 (来源于记号为9、11、14、22和23的高产合子胚)。其中L9胚性细胞系有子叶胚和胚性愈伤组织2种状态, 其余的4个胚性系均保持在子叶胚阶段。
2.4 诱导胚性愈伤组织再生植株将胚性愈伤组织(图版Ⅰ-4)转入培养基2进行体胚诱导, 2周之后愈伤组织中开始逐渐有白色的颗粒出现, 颗粒进一步发育形成较细小子叶状体胚, 6周之后, 50%以上的培养物可以诱导出体胚, 将诱导获得的细小的体胚转入培养基3, 4周之后将长大的体胚转入培养基4, 这时观察到体胚再生的2种途径, 在体胚子叶间的胚芽经诱导后能够直接萌发(图版Ⅰ-7), 另外体胚同时能够诱导产生丛生芽(图版Ⅰ-8), 总共诱导萌发率可达17.5%~33.3%(数据未列出)。培养4周之后将诱导出的不定芽切离母体转入培养基5进一步生长(图版Ⅰ-9), 之后转入生根诱导, 形成完整植株。
在光学显微镜下观察体胚发生过程的组织切片, 发现香樟的体胚发生和合子胚的发育过程很为相似。原胚起源于孤立的、核质稠密的细胞(图版Ⅰ-10), 逐渐分化成为球形胚、心形胚(图版Ⅰ-11)、鱼雷胚, 并最终形成具有子叶结构的子叶胚(图版Ⅰ-12)。不过在观察中, 香樟的体胚发生, 多为多个(3~5个)子叶的结构, 这种不正常的胚状体也可能是香樟的胚状体再生频率低的原因之一。
3 讨论在本研究中发现, 诱导胚性材料再生, 无论起始材料是子叶阶段的体胚还是胚性愈伤组织, 都必须体胚达到完全成熟, 才能诱导体胚萌发, 否则体胚只会形成一些没有茎的畸形肉质化叶片, 或者褐化死亡, 或者在上面重新形成次生胚, 这种现象被定义为早熟萌发(precocious germination)。由于早熟萌发中的体胚试图跳过正常体胚发育的某些阶段, 故而形成畸形的苗子(Raemakers et al., 1995)。幼小的体胚不经过成熟培养, 直接转入培养基4, 只是诱导出更多的次生胚, 如果使用活力更强的细胞分裂素如TDZ, 就会诱导体胚畸形萌发。只有经过长时间的成熟培养, 体胚完全长大、成熟, 才有可能出现体胚萌发。
促进体胚成熟通常有以下一些手段, 如, 增加培养基中的渗透压(Ramarosandratana et al., 2001), 添加乙烯抑制剂(Mandal et al., 2001), 添加ABA(Torres et al., 2001), 干燥处理(Gorbatenko et al., 2001)和饥饿处理(Lee et al., 2001)。在本试验中是添加足量的有机成分(Km-8p有机物), 使得体胚在充足的养分下能够充分发育, 然后转入萌发培养基中就可诱导体胚的萌发。
本试验通过对香樟幼胚的诱导成功地得到胚状体和胚性愈伤组织, 多次继代后, 胚性材料都能保持很高的增殖速度, 同时胚性愈伤组织经过体胚诱导、体胚成熟、体胚萌发等步骤的处理, 成功地诱导获得了体胚的再生植株。利用胚性材料进行基因转化体系的构建, 尚待进一步研究。
贺红, 潘瑞炽, 韩美丽, 等. 1998. 红江橙体胚发生及影响因素的研究. 广西植物, 18(4): 343-346. |
闫国华, 周宇. 2002. 桃幼胚离体培养再生植株的研究. 园艺学报, 29(5): 480-482. DOI:10.3321/j.issn:0513-353X.2002.05.018 |
Canhoto J M, Lopes M L, Cruz G S. 1999. Somatic embryogenesis and plant regeneration in myrtle (Myrtaceae). Plant Cell Tissue Organ Cult, 57: 13-21. DOI:10.1023/A:1006273128228 |
Das D K, Reddy M K, Upadhyaya K C, et al. 2002. An efficient leaf-disc culture method for the regeneration via somatic embryogenesis and transformation of grape (Vitis vinifera L.). Plant Cell Rep, 20: 999-1005. DOI:10.1007/s00299-002-0441-4 |
Garin E, Grenier E, Grenier-De March G. 1999. Somatic embryogenesis in wild cherry (Prunus avium). Plant Cell Tissue Organ Cult, 48: 83-91. |
Gorbatenko O, Hakman I. 2001. Desiccation-tolerant somatic embryos of Norway spruce (Picea abies) can be produced in liquid cultures and regeneration into plantlets. Int J Plant Sci, 162: 1211-1218. DOI:10.1086/323416 |
Lee E K, Cho D Y, Soh W Y. 2001. Enhanced production and germination of somatic embryos by temporary starvation in tissue cultures of Daucus carota. Plant Cell Rep, 20: 408-415. DOI:10.1007/s002990100338 |
Mandal A K A, Gupta S D, Chatterji A K. 2001. Factors affecting somatic embryogenesis from cotyledonary explants of sunflower. Biol Plant, 44: 503-507. DOI:10.1023/A:1013722116224 |
Merkle S A, Battle P J. 2000. Enhancement of embryogenic culture initiation from tissues of mature sweetgum trees. Plant Cell Rep, 19: 268-273. DOI:10.1007/s002990050010 |
Mondal T K, Bhattacharya A, Ahuja P S, et al. 2001. Transgenic tea [Camellia sinensis (L.) O. Kuntze cv. Kangra Jat] plants obtained by Agrobacterium-mediated transformation of somatic embryos. Plant Cell Rep, 20: 712-720. DOI:10.1007/s002990100382 |
Raemakers C J J M, Jacobsen E, Visser R G F. 1995. Secondary somatic embryogenesis and applications in plant breeding. Euphytica, 81: 93-107. DOI:10.1007/BF00022463 |
Ramarosandratana A, Harvengt L, Bouvet A, et al. 2001. Effects of carbohydrate source, polyethylene glycol and gellan gum concentration on embryonal-suspensor mass (EMS) proliferation and maturation of maritime pine somatic embryos. In Vitro Cell Dev Biol Plant, 37: 29-34. DOI:10.1007/s11627-001-0006-1 |
Reidiboym-Talleux L, Diemer F, Sourdioux M, et al. 1999. Improvement of somatic embryogenesis in wild cherry (Prunus avium): Effect of maltose and ABA supplements. Plant Cell Tissue Organ Cult, 55: 199-209. |
Torres A C, Ze N M, Cantliffe D J. 2001. Abscisic acid and somatic induction of synchronous somatic embryo development of sweet potato. In Vitro Cell Dev Biol Plant, 37: 262-267. DOI:10.1007/s11627-001-0047-5 |
Vendrame W A, Holliday C P, Merkle S A. 2001. Clonal propagation of hybrid sweetgum (Liquidambar styraciflua×L. formosana) by somatic embryogenesis. Plant Cell Rep, 20: 691-695. DOI:10.1007/s00299-001-0394-z |
 2006, Vol. 42
2006, Vol. 42