文章信息
- 郑阳霞, 季静, 王罡, 杨婉身.
- Zheng Yangxia, Ji Jing, Wang Gang, Yang Wanshen.
- 宁夏枸杞八氢番茄红素合成酶基因的克隆与序列分析
- Cloning and Sequence Analysis of Phytoene Synthase cDNA from Lycium barbarum
- 林业科学, 2006, 42(5): 138-141.
- Scientia Silvae Sinicae, 2006, 42(5): 138-141.
-
文章历史
- 收稿日期:2004-11-22
-
作者相关文章
2. 四川农业大学生命科学与理学院 雅安 625014
2. College of Biology and Science, Sichuan Agricultural University Ya'an 625014
类胡萝卜素是植物叶绿体光合作用的辅助色素,并能保护叶绿素免受高温强光的破坏(Bartley et al., 1995)。现在越来越多的医学研究表明,类胡萝卜素与人类健康密切相关。约有10%的类胡萝卜素是维生素A的前体(Krinsky,1989)。据统计,每年有70多个国家的3 000多万儿童因缺乏维生素A而造成致命性疾病(Cheryl et al., 1997)。此外,类胡萝卜素在防癌抗癌、预防心血管疾病、增强人体免疫力等方面起着重要的作用(陶俊等,2002)。通过对菲律宾、加拿大和中国的食道癌患者的调查已证明β-胡萝卜素能延缓疾病的进程(韩雅珊,1999)。由于类胡萝卜素在许多植物中含量较低,并且难以用化学方法合成。因此,利用基因工程手段调控类胡萝卜素的代谢积累,进而大量生产类胡萝卜素已成为研究者们所共识的研究方向之一。目前通过基因工程手段已获得转类胡萝卜素合成酶基因的“金大米”和“金油菜” (陶俊等,2002)。
植物体内类胡萝卜素均通过异戊二烯化合物或萜类化合物合成。代谢主链上有5种酶参与,分别是八氢番茄红素合成酶(PSY)、八氢番茄红素脱饱和酶(PDS)、ξ-胡萝卜素脱饱和酶(ZDS)、番茄红素β-环化酶(LycB)和番茄红素ε-环化酶(LycE)。随着分子生物学研究手段的发展,编码这些酶的基因已从番茄(Lycopersicon esculentum)、烟草(Nicotiana tabacum)、辣椒(Capsicum annuum)、拟南芥(Arabidopsis thaliana)、玉米(Zea mays)等植物中陆续分离鉴定(陶俊等,2002;Cunningham et al., 1998)。据报道宁夏枸杞(Lycium barbarum)的总类胡萝卜素含量为2.952 7 mg·g-1(李忠等,1999),其含量之高为植物所罕见。目前有关枸杞类胡萝卜素合成酶基因的克隆还未见报道。因此选择宁夏枸杞作为试验材料,进行八氢番茄红素合成酶基因(phytoene synthase,PSY)的克隆,可为进一步利用基因工程手段生产类胡萝卜素奠定基础。
1 材料与方法 1.1 材料质粒载体pGEM-T vector system为Promega公司产品,TaqDNA聚合酶、dNTP和DNA marker 2000购自大连宝生物工程有限公司,X-gal和IPTG为北京鼎国生物技术有限责任公司产品,其他化学常规试剂为国产分析纯。大肠杆菌菌株JM109及宁夏枸杞叶片cDNA文库由解放军军需大学植物基因工程研究中心提供。
1.2 PCR模板的制备采用液体培养法提取λ噬菌体DNA(萨姆布鲁克等,2002)。
1.3 PCR体外扩增根据番茄、辣椒、拟南芥、玉米等植物PSY基因的保守序列设计一对引物:引物1(正向)GAA TTC ATG TCT ATT TGT ACG CTA TGG GTT GTT;引物2(反向)GC GGC CGC TCA TGT TTG GGG TAT CAT AAA AGA。在25μL反应体系中,加入10×PCR Buffer(Mg2+15 mmol·L-1) 3.0 μL,dNTP(各2.5 mmol·L-1)2.5 μL,引物1(20 μmol·L-1)和引物2(20 μmol·L-1)各1.5 μL,TaqDNA聚合酶(5 U·μL-1) 0.5 μL,模板DNA 2.5 ng。反应条件:94 ℃ 3 min→(94 ℃1 min→55 ℃1 min→72 ℃2 min)30→72 ℃ 10 min。扩增反应在德国UNOII Biometra DNA扩增仪上进行。反应结束后在1%琼脂糖凝胶上电泳检查。
1.4 扩增产物的克隆与DNA序列测定采用北京鼎国生物技术发展中心的DNA片段回收试剂盒回收PCR扩增产物。回收产物与pGEM-T载体进行连接,连接产物转化大肠杆菌JM109。在含氨苄青霉素的培养基上进行蓝白斑筛选。随机挑取白色菌落,用碱裂解法小量提取质粒DNA,并进行PCR和双酶切(SacⅠ, NcoⅠ)鉴定。由华大基因上海鼎安生物科技有限公司用DNA荧光自动序列分析仪进行序列测定。
2 结果与分析 2.1 PSY基因的体外扩增与克隆用PCR技术从cDNA文库中扩增出一条特异性片段,大小约1.3 kb,与预期大小相符(图 1)。经过多次重复,均得到相同的结果,初步证明PCR扩增成功。将该片段纯化后,克隆至pGEM-T载体,转化JM109。通过PCR和双酶切鉴定,筛选出插入片段在1.3 kb的重组质粒(图 1)。成功构建的重组质粒命名为pGEM-PSY。

|
图 1 凝胶电脉图谱 Fig. 1 Gel electrophoresis map 1, 4, 6 DNA Marker 2000; 2 PCR产物PCR product; 3质粒pGEM-PSY的PCR扩增鉴定Identification of pGEM-PSY by PCR; 5质粒pGEM-PSY的酶切鉴定Identification of pGEM-PSY by restriction enzymes digestion. |
重组质粒pGEM-PSY的DNA序列分析结果表明,分离克隆的PSY基因cDNA全长1 292 bp,阅读框位于7~1 284 bp之间,共编码425个氨基酸(图 2)。与其他植物PSY基因核苷酸序列同源性比较发现,与番茄(A21360)(Ray et al., 1987)、辣椒(X68017)(Romer et al., 1993)、拟南芥(L25812)(Scolnik et al., 1994)、玉米(U32636)(Buckner et al., 1996)、黄水仙(Narcissus pseudonarcissus)(X78814)(Schledz et al., 1996)、甜瓜(Cucumis melo)(Z37543)(Karvouni et al., 1995)的同源性分别为78%,80%,77%,75%,79%,80%。另外,该基因所编码的氨基酸序列与其他植物的同源性高达70%~80%,肽链长度相仿,由410~425个氨基酸组成,且其中存在4个高度保守序列(图 2斜黑体部分)。说明所获得基因序列是宁夏枸杞PSY基因。

|
图 2 宁夏枸杞PSY基因cDNA序列和由此推导的氨基酸序列 Fig. 2 The nucleotide sequence and the deduced amino acid sequence of PSY from L.barbarum 斜黑体字母指高度保守序列。 The inclined and black letters point to the highly conservative sequence. |
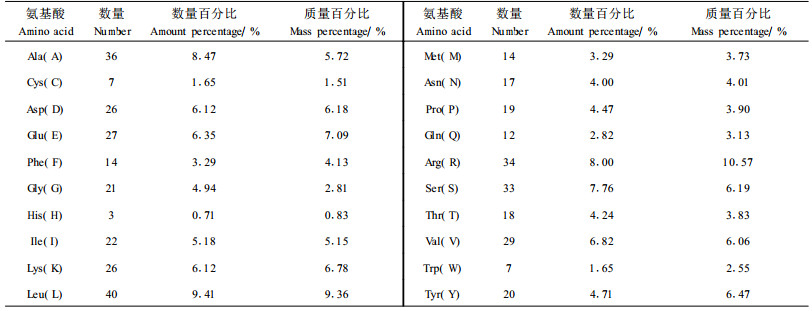
用Antheprot软件对PSY基因编码的蛋白质的基本特性和氨基酸组成进行分析。结果为,相对分子质量是48 327,等电点为8.825。在pH 7.0时,电荷为6.983。蛋白质氨基酸的组成分析结果见表 1。
|
|
对PSY基因编码的蛋白质进行二级结构预测分析,结果(图 3)表明该蛋白富含α-螺旋(helix),高达54.3%,其次无规卷曲(coil),为40%,而β-折叠(strand)只有5.6%。

|
图 3 PSY基因编码的蛋白质二级结构预测分析 Fig. 3 Secondary structure prediction of protein by PSY H:α-螺旋Helix; C:无规卷曲Coil; E:β-折叠Strand. |
目前已建立多种方法克隆基因。构建cDNA文库是其中比较常规的一种。利用探针从文库中筛选基因是一件比较烦琐的工作,易受假阳性的干扰;而且有时所获取的克隆还不完整,需要重新筛选。PCR扩增克隆基因仍是目前最为快速、简便的方法。程奇等(1994)和刘建喜等(2001)研究发现在已建立cDNA文库的基础上,利用PCR反应可以快速地克隆cDNA,这在本试验中进一步得到证实。由于PCR反应存在非特异扩增,可以通过提高退火温度、增加引物长度来提高cDNA序列的精确性。
PSY催化2个NFDA2牛儿基NFDA2牛儿基焦磷酸(GGPS)缩合形成八氢番茄红素,它是整个类胡萝卜素合成途径中第1个类胡萝卜素分子。来自其他植物的研究表明PSY是类胡萝卜素生物合成途径中的第1个限速酶(Welsch et al., 2000),其活性的高低会影响类胡萝卜素的生物合成。季静等(2002)将来自龙胆草(Rabdosia ternifolia)的5个类胡萝卜素合成酶基因导入烟草,并对转基因烟草中的类胡萝卜素含量进行测定。结果表明PSY基因对烟草的叶黄素、β-胡萝卜素含量影响较大。因此PSY基因是基因工程的首选目标。枸杞是我国重要的药用经济林木,总类胡萝卜素含量居植物之首,因此从枸杞中克隆类胡萝卜素合成酶基因对提高植物中的类胡萝卜素含量可能具有更大的优势。本试验利用PCR技术从宁夏枸杞cDNA文库中成功地分离了PSY全长cDNA,其核苷酸序列和推导的氨基酸序列与其他植物具有很高的同源性,分别达到75%和70%以上。宁夏枸杞PSY基因的分离,为通过基因工程方法调控类胡萝卜素的代谢和积累,创造类胡萝卜素含量更高的品系,改善果蔬的营养价值奠定基础。
程奇, 于晓兰, 章力建, 等. 1994. 从水稻叶绿体基因文库中快速克隆叶绿体基因. 中国农业科学, 27(3): 7-11. |
韩雅珊. 1999. 类胡萝卜素的功能研究进展. 中国农业大学学报, 4(1): 5-9. DOI:10.3321/j.issn:1007-4333.1999.01.002 |
季静, 王罡. 2002. 来自龙胆草的5个类胡萝卜素生物合成相关酶基因对类胡萝卜素生物合成量影响的分析. 农业生物技术学报, 10(3): 62-63. |
李忠, 彭光华, 张声华. 1999. 枸杞子中的类胡萝卜素的组成及含量. 植物资源与环境, 8(4): 57-58. |
刘建喜, 林爱星, 李雪辉, 等. 2001. 用PCR法从cDNA文库中快速克隆基因. 农业生物技术学报, 9(3): 279-281. DOI:10.3969/j.issn.1674-7968.2001.03.019 |
萨姆布鲁克J, 拉塞尔D W.2002.分子克隆实验指南.3版.黄培堂, 王嘉玺, 朱厚础, 等译.北京: 科学出版社, 238-241
|
陶俊, 张上隆, 徐昌杰, 等. 2002. 类胡萝卜素合成的相关基因及基因工程. 生物工程学报, 18(3): 276-281. DOI:10.3321/j.issn:1000-3061.2002.03.004 |
Bartley G E, Scolnik P A. 1995. Plant carotenoid: pigment for photoprotection, visual attraction and human health. Plant Cell, 7: 1027-1038. |
Buckner B, Miguel P S, Janick-Buckner D, et al. 1996. The y1 gene of maize codes for phytoene synthase. Genetics, 143(1): 479-488. |
Cheryl L, Rock. 1997. Caroteniods:biology and treatment. Pharmacology and Therapeutics, 75(3): 185-197. DOI:10.1016/S0163-7258(97)00054-5 |
Cunningham F X, Gantt E. 1998. Genes and enzymes of carotenoid biosynthesis in plants. Annu Rev Plant Physiol Plant Mol Biol, 49: 557-583. DOI:10.1146/annurev.arplant.49.1.557 |
Karvouni Z, John I, Taylor J E, et al. 1995. Isolation and characterisation of a melon cDNA clone encoding phytoene synthase. Plant Mol Biol, 27(6): 1153-1162. DOI:10.1007/BF00020888 |
Krinsky N I. 1989. Carotenoids chemistry and biochemistry. New York: Plenum press, 279-291.
|
Ray J A, Bird C R, Manuders M, et al. 1987. Sequence of pTOM5, a ripening related cDNA from tomato. Nucl Acid Res, 24: 10587. |
Romer S, Hugueney P, Bouvier F, et al. 1993. Expression of the genes encoding the early carotenoid biosynthetic enzymes in Capsicum annuum. Biochem Biophys Res Commun, 196(3): 1414-1421. DOI:10.1006/bbrc.1993.2410 |
Scolnik P A, Bartley G E. 1994. Nucleotide sequence of an Arabidopsis thaliana cDNA for phytoene synthase. Plant Physiol, 104(4): 1471-1472. DOI:10.1104/pp.104.4.1471 |
Schledz M, Babili S, von Lintig J, et al. 1996. Phytoene synthase from Narcissus pseudonarcissus: functional expression, galactolipid requirement, topological distribution inchromoplasts and induction during flowering. Plant J, 10(5): 781-792. DOI:10.1046/j.1365-313X.1996.10050781.x |
Welsch R, Beyer P, Hugueney P, et al. 2000. Regulation and activation of phytoene synthase, a key enzyme in carotenoid biosynthesis, during photomorphogenesis. Planta, 211(6): 846-854. DOI:10.1007/s004250000352 |
 2006, Vol. 42
2006, Vol. 42