文章信息
- 郭剑芬, 杨玉盛, 陈光水, 林鹏, 谢锦升.
- Guo Jianfen, Yang Yusheng, Chen Guangshui, Lin Peng, Xie Jinsheng.
- 森林凋落物分解研究进展
- A Review on Litter Decomposition in Forest Ecosystem
- 林业科学, 2006, 42(4): 93-100.
- Scientia Silvae Sinicae, 2006, 42(4): 93-100.
-
文章历史
- 收稿日期:2004-08-31
-
作者相关文章
2. 厦门大学生命科学学院 厦门 361005;
3. 福建农林大学林学院 福州 350002
2. Life Science College of Xiamen University Xiamen 361005;
3. Forestry College of Fujian Agriculture and Forestry University Fuzhou 350002
森林凋落物是森林植物在其生长发育过程中新陈代谢的产物,在森林生态系统养分循环中起着重要作用。凋落物分解是生态系统物质循环和能量转换的主要途径,通过分解逐步把养分归还给土壤,因而分解过程和速率对森林土壤肥力有重要影响。通过凋落物的分解归还到大气中的C量是全球C预算中一个重要的组成成分。Raich等(1992)估计全球因凋落物分解(包括枯死根)释放的CO2量为68 Gt C·a-1,约占全球年C总流通量的70%。因此,森林凋落物分解研究已愈来愈引起林学、生态学、微生物学、土壤学家以及森林经营工作者的重视(田大伦等, 1989; 杨玉盛等,2004a; 赵其国等, 1991; Berg, 2000)。早在1876年,德国的Ebermayer就开始研究凋落物在养分循环中的作用,而后,国外许多学者大量报道世界范围内森林凋落物的分解及养分释放(Berg et al., 1993; Edmonds et al., 1995; Singh et al., 1999)。而我国直到20世纪80年代后才有类似研究报道。随着全球碳循环问题受到广泛关注,凋落物的分解对森林生态系统碳预算具有重要科学意义。
1 森林凋落物分解过程通过森林凋落物和林木枯死细根的分解作用,向大气释放CO2并提供给植物和微生物养分,这是森林生态系统自肥的重要机制之一(Pausas et al., 2004; Yang et al., 2004)。森林凋落物的分解既有物理过程,又有生物化学过程,一般由淋溶作用(凋落物中可溶性物质通过降水而被淋溶)、自然粉碎作用(主要由腐食动物的啃食完成,但非生物因素如土壤干湿交替、冻融作用亦可使枯叶破碎)、代谢作用(由腐生微生物的活动把复杂的有机化合物转化成简单无机化合物)等共同完成。淋溶作用是处于湿润环境的新近凋落物质量损失的一个重要过程。凋落物通过土壤动物粉碎后,不仅增加了凋落物表面积,而且为微生物生长繁殖提供了能量和养分。随后,凋落物碎屑在分解者(主要为真菌、细菌、放线菌)及各种酶系统作用下发生生物降解。凋落物分解过程中先后出现分解速率较快和较慢2个阶段,具有较明显的时间模式(胡肄慧等, 1987; 邱尔发等,2005;许新健等, 1995; Edmonds et al., 1995)。Pausas等(2004)发现陆生森林凋落叶在第1年中干质量损失30%~7 0%,而后4~5年损失了20%~30%,其损失量与时间呈指数关系。初期出现较快分解速率,与水溶性物质和易分解的碳水化合物的快速淋失和降解有关,N、P、S等元素的浓度对此阶段分解速率起着主要影响作用。随着分解继续,木质素等难分解物质不断累积(达到45%~51%),凋落物的进一步分解受抑制,分解速率明显减慢(代静玉等,2004;Taylor et al., 1989; Aerts, 1997)。此外,凋落物分解还存在空间异质性,这与根系、水分、土壤动物等在土壤空间上的分布差异有关,例如沼泽森林落叶分解就快得多。分解大多数发生在凋落物富集的土壤表面(即有机质层),该层温度和湿度变化大,分解主要受真菌影响;而矿质土壤温度和湿度较为稳定,且全土中养分缺乏,微生物活性低。
凋落物在分解过程中元素发生迁移,其主要模式有:1)淋溶-富集-释放;2)富集-释放;3)直接释放。然而,不同树种和生态系统的养分固定和释放模式有所差异,不是所有凋落物类型在分解过程中都存在这3个阶段。针叶和木质凋落物的淋溶阶段可能不明显或不存在(Berg, 2000),如在马尾松(Pinus massoniana)、非洲圆柏(Juniperus procera)等落叶的分解过程中,N浓度呈现先升后降趋势(莫江明等, 1996; Lisanework et al., 1994)。而在樟子松(Pinus sylvestris var. mongolica)落叶分解过程中,N浓度始终保持下降趋势(沈海龙等,1996)。Xuluc-Tolosa等(2003)对次生雨林4个树种凋落物分解的研究发现,分解过程中N和P浓度先减少后增加。但养分分解并不是简单的遵循初始浓度越小就越容易富集、富集量也越大的规律,还与元素在植物组织中的存在形式和位置有关,可能有2种情况:一是在植物体内极易转移被再利用的元素(如N和P),它们在落叶前转移到植物体的其他部分,造成凋落物中的低浓度;另一种是难分解的有机物组分(如Ca和Mg),微生物很难利用,所以也要先进行富集。易淋溶的K元素在分解过程中浓度不断下降,这已从国内外大量研究结果中得到证明(田大伦等, 1989; 肖慈英等,2002;杨玉盛等, 2004a; Bubb et al., 1998)。
2 影响森林凋落物分解的因素凋落物分解速率的大小通常受多种因素的影响。Aerts(1997)对陆地生态系统气候、落叶化学性质与落叶分解作用之间的相关性进行了综述,认为凋落物分解主要受气候、凋落物性质、微生物和土壤动物的影响,其他一些研究也得到类似的结果(胡肄慧等, 1987; 彭少麟等,2002;许新健等,1995; Berg et al., 1993; Singh et al., 1999; Pausas et al., 2004)。
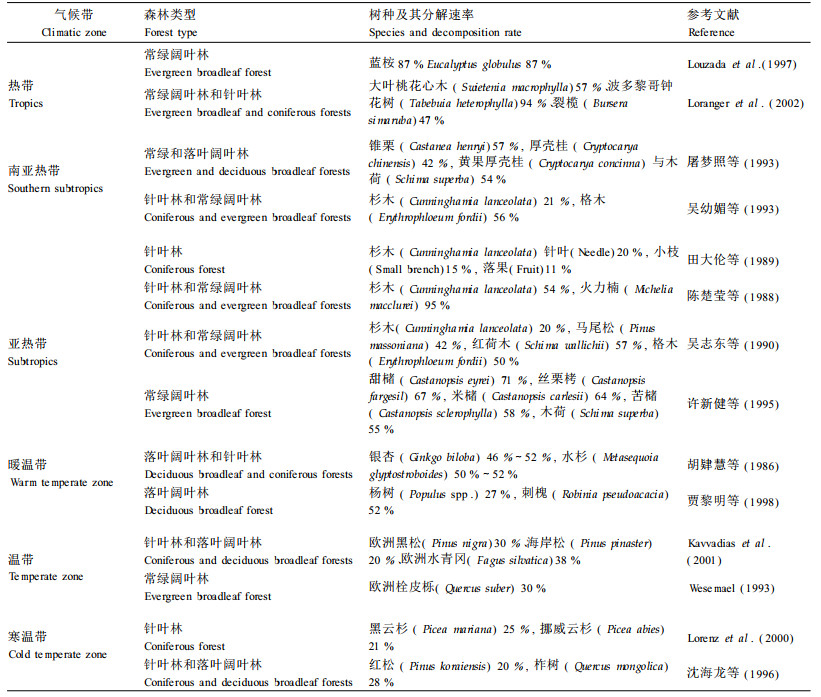
2.1 气候对凋落物分解的影响在凋落物分解调节的等级模型中,气候是最基本的影响因素,而且常用AET(actual evapot ranspiration)作为指标(Aerts, 1997)。Van der Drift(1963)试图通过监测荷兰Zutphen附近森林凋落物分解速率的年变化来建立它与气候的关系。Aerts(1997)对凋落物分解与AET间的相关性进行了回归分析,发现凋落物分解与AET一般呈指数关系,热带地区AET对凋落物分解的影响最为显著。一些学者通过纬度形成的气温梯度研究温度对森林凋落物分解速率的影响,也有通过海拔形成的气温梯度进行研究的(Vitousek et al., 1994)。Berg等(1993)对寒带至亚热带及地中海区域松类凋落物的分解状况进行研究,发现气候在大尺度上对凋落物分解的影响十分明显,而凋落物质量只在局部区域尺度上起作用。各气候带中凋落物的分解速率顺序为热带>亚热带>温带>寒温带(表 1),热带森林凋落物年均分解速率为30%~90%,是温带森林的3倍,而亚热带凋落物年分解速率一般为40%~70%。凋落物分解速率呈现明显的气候地带性,与其不同生境中温度、湿度等变化紧密相关。Vitousek等(1994)在太平洋热带岛屿Mauna Loa的研究表明:随海拔升高,气温降低,凋落物的分解速率呈指数降低。Hornsby等(1995)在不同温度下测定枯枝落叶的分解,发现分解速度随温度的升高而加快。Singh等(1999)的研究结果进一步证明了温度对分解有明显作用,同时也受湿度的影响。水分通过淋溶作用直接影响凋落物的分解速率,也可能通过影响微生物分解者而影响凋落物的分解速率。正是由于热带地区持续高温和年降水量大,其分解速率远高于寒带,凋落物在一年内即分解殆尽。而在一些温带生态系统中,高降雨量的嫌气条件反而使凋落物分解减慢(Vitousek et al., 1994)。此外,枯枝落叶层的干湿交替也对凋落物的分解产生影响。Mondini等(2002)发现,枯枝落叶层干湿交替减少了微生物的数量,在一定程度上降低了分解率。同时,干湿交替促进了细菌对活性底物(如半纤维素)的分解,而不利于真菌对难分解复合物(如木质素)的分解。Pausas等(2004)报道,土壤水分含量高(如:矿质土壤中水分含量达到干土质量的100%~150%)造成了分解速率的下降,是因为湿润土壤中的水分阻碍了分解者的氧气供给。
|
|
凋落物(包括枯死根)分解释放的CO2量约占C年总流通量的70%,因此,全球变暖引起AET的变化将通过影响凋落物分解途径而间接影响全球C预算。但利用AET变化来预测凋落物分解速率需在其他条件(凋落物化学性质、土壤微生物状况)不变的情况下进行,这种理想状态又不可能存在。因而,目前还未能准确估算出凋落物分解而释放到大气中的CO2量。此外,在大气N沉降强烈的地区,大气N沉降的增加会加快凋落物分解和营养的释放(Edmonds et al., 1995)。但Berg等(2000)观察到N沉降对凋落物分解会起减缓作用。全球变化中大气CO2浓度升高对森林生态系统产生的施肥效应,会使凋落物C/N比增加,分解速率下降。气候除了对凋落物分解产生直接影响外,还通过影响凋落物质量、微生物和土壤动物的活动而间接调节凋落物的分解速率,总之气候对凋落物分解的影响作用是多重的。
2.2 凋落物质量对分解的影响从全球尺度解释各森林类型凋落物分解速率的差异,凋落物质量只处于次要地位(Aerts, 1997),但在同一气候带内因AET变化较小,凋落物质量对分解则起主要作用。Swift等(1989)将凋落物的化学属性称之为“基质质量(substrate quality)”,定义为凋落物的相对可分解性,依赖于构成组织的易分解成分(N、P等)和难分解有机成分(木质素、纤维素、半纤维素、多酚类物质等)的组合情况、组织的养分含量和组织的结构,其中基质C的性质是控制凋落物分解的主要化学因素。在外界环境一致条件下,因基质质量差异可造成凋落物分解率5~10倍的变化。虽然凋落物各种化学性质影响分解,但它们之间的相对重要性尚不清楚。N、P和木质素浓度、C/N、C/P、木质素与养分比值是常见的凋落物质量指标,其中C/N比和木质素/N比最能反映凋落物分解速率(王希华等,2004;Berg, 2000; Sariyildiz et al., 2003)。
凋落物化学性质对分解的影响与分解阶段有关。Taylor等(1989)研究发现,分解前期由N制约凋落物分解速率,后期由木质素浓度或木质素/N比制约分解速率。Aerts等(1997)发现,几种苔草属(Carex)植物凋落物的分解初期(3个月内)主要受与P相关的凋落物质量参数的影响,而后分解速率又与酚类物质/N比,酚类物质/P比,木质素/N比明显相关。Berg(2000)对温带常绿树种凋落叶分解的研究得出了相同的结论。他们发现,凋落叶中N、P、K初始浓度高使得初期分解较快,而后期分解放慢。Aerts(1997)对这一现象作出了解释,其原因主要有:1)分解过程中木质素浓度升高,且N可与木质素及其降解产物形成难分解的复合物;2)N对起降解作用的真菌的群落活性及组成产生影响。但目前对其他气候带的凋落物类型(特别是木质素含量低的凋落物)是否也存在这种规律尚不清楚,而且分解初期和后期的凋落物元素动态可能发生变化。因而,需从较长时间尺度来探讨不同气候带中凋落物的化学性质对其分解速率的影响。
在自然状态下,凋落物不可能从其他有机物质中分离出来孤立分解,而是不同凋落物协同分解(肖慈英等,2002)。凋落物在混合分解过程中,不仅发生量变,也会发生质变,其化学成分进行着转移或转化,而且不同化学成分的损失存在差异(刘强等,2005)。胡肄慧等(1987)研究了华北地区几种主要树种枯叶分解过程中化学成分的变化,结果表明:分解122~150 d时有机成分中的粗脂肪、可溶性糖、单宁、有机碳等的含量发生显著变化,可溶性物质的含量大幅度降低,而纤维素、木质素含量则相对增大。伴随着凋落物的分解养分不断发生释放,这对森林生态系统生产力的维持具有重要意义。营养元素释放受分解前营养元素浓度及凋落物最小碳与营养元素比值的影响(在暖温带气候条件下尤为明显)。Edmonds等(1995)对太平洋冷杉( Abies amabilis)的研究结果表明:当落叶中N和木质素含量分别为4.5 g·kg-1和40%时,N处于明显的富集阶段;而当这二者的含量分别为24.9 g·kg-1和25%时,N发生分解矿化。而Taylor等(1989)则认为,叶片凋落物早期元素分解速率大约有80%是由C/N比决定的,但对于初始木质素含量较高(>20%)的凋落物,C/N比则不能准确预测分解速率。Ritter(2005)还发现,在凋落物分解过程中,在碳与营养元素比低于临界值后才发生非有机态营养元素的释放,因为高于这个值后,微生物因得不到充足的养分而限制了凋落物分解及养分释放。例如,N发生固定和释放的C/N比临界值为20:1~30:1,然而这个临界值因凋落物种类不同而有所差异(Aber et al., 1980)。
2.3 土壤状况对凋落物分解的影响土壤是影响森林凋落物分解速率的另一类环境因子。不同的土壤理化性质及微生物区系将不同程度地影响凋落物分解。一般认为,营养贫瘠土壤上的植物,其凋落物分解慢。这是因为土壤中的养分含量越低,凋落物的C/N比越高,耐分解化合物的含量越多,凋落物分解越慢(Sariyildiz et al., 2003)。Vitousek等(1986)研究发现,肥沃的热带低地土壤中N矿化和硝化速率明显比温带森林土壤的快。温度作为影响生命活动的主导因子,无论对微生物的数量、酶活性,还是对凋落物的分解作用,均起着主导作用。McHale等(1998)研究发现凋落物分解率与土壤温度显著相关(r为0.819 6,P 0.01)。Pausas等(2004)比较了地表和地下不同生态环境分解速率的差异。地表由于温度较高,蒸发量大,使枯枝落叶持水量减少;而地下10 cm深度的温度一般仅低于地表 2~3 ℃,由于土层覆盖使枯枝落叶保持湿润状态,有利于微生物的分解。再者,土壤微生物和土壤动物大都集中分布在0~10 cm土层中,通过粉碎作用及对凋落物中难分解成分的生物降解而影响凋落物的分解速率。他们还发现,微节肢动物多的山茱萸(Cornus officinalis)叶较松针和栎叶分解速度快。土壤中酶活性高低直接影响着微生物对凋落物的分解,同时微生物群落组成又影响着酶的类型及生产率。据调查,许多微生物能产生蛋白质酶和纤维素酶,而只有部分微生物(主要是真菌)才能产生木质素降解酶,这也是木质素分解慢的一个重要原因。研究pH值对凋落物分解的影响常得出较一致的结果,即土壤pH值越低(4.5~5.7),分解越慢。Micks等(2004)认为阳离子淋溶、酸沉降及土壤有机质演替过程中有机酸累积均可造成土壤酸化,从而影响了细菌数量及凋落物的分解速率。
另一方面,凋落物分解状况又对土壤各种性状产生极大的影响。凋落物分解越快,并且转化为土壤腐殖质的过程越强烈,对改善土壤状况的影响就越明显,从而使土壤的物理结构得以改善,有效养分不断得到补充,生态系统生产力稳定地维持在较高的水平上。当分解过程缓慢时,凋落物大量累积,往往使土壤酸性增加,造成无机营养元素淋溶作用加剧,土壤养分状况恶化,最终使生产力降低。
3 森林凋落物分解研究的方法凋落物分解作用的研究相当活跃,研究方法各有特色。尼龙网袋法(litter bag method)操作简单,是野外测定森林凋落物分解速率最常用的方法,但有学者指出网袋的隔离作用及其形成的小环境限制了土壤动物、微生物的活动,从而使凋落物的分解活动减缓(张雪萍等,2000)。目前还未见报道网袋法测定的分解速率与自然状态下的有多大差异。在温带和暖温带地区,土壤小动物对凋落物的分解过程影响较小,但在热带、亚热带地区,土壤动物对凋落物的摄食往往对分解作用起着相当重要的作用。例如,福建杉木产区,杉木林的凋落物是白蚁的主要食物来源之一,特别是在夏秋干旱少雨季节(何宗明等, 2003)。由此可见,通过网袋法测定杉木凋落物的分解速率必然会出现结果偏小的误差。此外,网袋材料的孔径和强度对分解速率也有很大影响。网孔愈小,通气性愈差,且妨碍小动物的破碎活动,结果差异也愈大。为使研究手段尽量反映野外条件,以获得接近自然状态的结果,卢俊培等(1989)同时采用网袋和网罩法比较山地雨林凋落物的分解速率,结果表明:采用尼龙纱罩,土壤中动物翻动泥土所造成的干扰较少,从而凋落叶分解质量损失的速度在任何时段都是网罩法快于网袋法,同时也说明对不容易分解的山地雨林凋落物及其所处温度较低的环境而言,方法选择是十分重要的。
除野外试验方法外,缩微试验也得到了广泛应用(廖利平等, 1997)。Taylor等(1989)用缩微系统检验氮与木质素含量对分解速率的影响,结果证明了氮的含量与碳氮比是分解速率的最佳预测指标。还有的人工制造枯落物,模拟其分解作用。应用缩微系统把试验纳入人为控制的环境下,使试验严格准确。但是室内控制一定条件来模拟凋落物分解,与野外林地复杂的实际情况有一定差距,因而,在室内研究得出的结果有待于在室外条件下进一步验证。
目前普遍采用的衡量凋落物分解速率大小的指标主要有CO2释放速率、凋落物分解系数(k值)及质量损失率。这些指标便于不同凋落物分解速率的比较,但不足的是,它们都使分解过程过于简单化,无法得到分解速率的精确值。许多学者采用数学模型模拟凋落物分解过程及外界因素(如CO2浓度升高、酸沉降、施肥等)对分解的影响,其中Olson(1963)指数方程W/W0=e-kt是描述凋落物分解过程中质量损失率变化的最常见模型。而有些研究者发现线性回归模型模拟效果更好,还有人提出了“最适"指数曲线模型(Antonov et al., 1995),这些模型已在研究中得到广泛应用。
4 森林凋落物分解未来研究方向森林凋落物研究已有近百年的历史,早期研究主要探讨纯林或混交林凋落物组成、产量波动与分布,最近则重点探讨森林凋落物分解在养分循环中的作用,并对分布在热带、温带、寒带等不同气候带的天然林凋落物进行了较为深入的研究(Pedersen et al., 1999; Norgrove et al., 2000; Kavvadias et al., 2001; Ritter, 2005)。凋落物分解构成了森林生态系统生物地球化学循环的一个重要组成部分,分解速率对生态系统生产力有着重要影响。凋落物的分解还是森林地表层生物量和养分含量的主要决定因素,并显著影响着土壤的理化性质。随着全球气候变化日益受到人们的重视,凋落物分解释放出CO2对温室效应的贡献、全球变暖对凋落物动态的影响等亦日渐受到关注(Hirschel et al., 1997; Korner, 1999)。如前所述,凋落物分解受诸如凋落物质量、气候和土壤等非生物因素及土壤微生物和土壤动物等生物因素的制约。全球变暖直接或间接引起这些因素的改变,从而影响凋落物分解速率。直接作用是气温上升影响森林生态系统小气候作用于凋落物分解过程;间接作用通过影响全球植被的分布、森林群落结构和物候的变化作用于凋落物分解过程。但目前由于凋落物分解研究方法不统一,研究结果可比性较差;而且无法准确确定因凋落物分解向大气释放的CO2数量及凋落物质量差异对分解的影响。此外,对不同土地利用方式和不同气候带中森林凋落物分解的比较研究仍很少见。与国外相比,我国凋落物分解研究起步较晚,但也对不同森林类型凋落物的分解速率及养分动态作了一些报道(卢俊培等, 1989; 林鹏等, 1990; 莫江明等, 1996; 沈海龙等, 1996; 贾黎明等, 1998; 杨玉盛等, 2004b),认识到凋落物分解在维持土壤肥力,促进系统养分循环等方面发挥着重要作用,但对目前CO2浓度升高环境下的森林凋落物分解状况及营林活动对分解的影响却很少涉及。
未来的研究应进行多途径的探索,如进行长期的定位观测,积累时间序列的数据;在纬向热量梯度带内进行时空互代的研究;在不同气候带之间进行凋落物交互分解试验的研究;原地增温试验等等。采用相对统一的研究方法,获得可比性强的数据进行综合,以形成一个全球凋落物分解的总体数量格局;深化对凋落物分解机理的研究,建立包含多个分解因子的数量模型,优化主要以单一因素建立的分解速率方程;从广度和深度上加强对全球变化及凋落物分解之间相互影响的研究。此外还应关注营林措施(如林分皆伐、造林、施石灰和肥料等)对凋落物分解与养分释放的影响。
陈楚莹, 王开平, 张家武, 等. 1988. 杉木火力楠混交林生态系统中营养元素的积累、分配和循环的研究. 生态学杂志, 7(4): 7-13. |
代静玉, 秦淑平, 周江敏. 2004. 水杉凋落物分解过程中溶解性有机质的分组组成变化. 生态环境, 13(2): 207-210. DOI:10.3969/j.issn.1674-5906.2004.02.019 |
何宗明, 陈光水, 刘剑斌, 等. 2003. 杉木林凋落物产量、分解率与储量的关系. 应用与环境生物学报, 9(4): 352-356. DOI:10.3321/j.issn:1006-687X.2003.04.005 |
胡肄慧, 陈灵芝, 陈清朗, 等. 1987. 几种树木枯叶分解速率的试验研究. 植物生态学与地植物学学报, 11(2): 124-132. |
胡肄慧, 陈灵芝, 孔繁志, 等. 1986. 两种中国特有树种的枯叶分解速率. 植物生态学与地植物学学报, 10(1): 35-43. |
贾黎明, 方陆明, 胡延杰. 1998. 杨树刺槐混交林及纯林枯落叶分解. 应用生态学报, 9(5): 463-467. |
廖利平, 杨永辉. 1997. 森林叶凋落物混合分解的研究Ⅰ.缩微(Microcosm)实验. 应用生态学报, 8(5): 459-464. DOI:10.3321/j.issn:1001-9332.1997.05.003 |
林鹏, 卢昌义, 王恭礼, 等. 1990. 海南岛河港海莲红树林凋落物动态的研究. 植物生态学与地植物学学报, 14(1): 69-73. |
刘强, 彭少麟, 毕华, 等. 2005. 热带亚热带森林凋落物交互分解的养分动态. 北京林业大学学报, 27(1): 24-32. DOI:10.3321/j.issn:1000-1522.2005.01.006 |
卢俊培, 刘其汉. 1989. 海南岛尖峰岭热带林凋落叶分解过程的研究. 林业科学研究, 2(1): 25-32. |
莫江明, 布朗, 孔国辉, 等. 1996. 鼎湖山生物圈保护区马尾松林凋落物的分解及其营养动态研究. 植物生态学报, 20(6): 534-542. |
彭少麟, 刘强. 2002. 森林凋落物动态及其对全球变暖的响应. 生态学报, 22(9): 1534-1544. DOI:10.3321/j.issn:1000-0933.2002.09.024 |
邱尔发, 陈卓梅, 郑郁善, 等. 2005. 麻竹山地笋用林凋落物发生、分解及养分归还动态. 应用生态学报, 16(5): 811-814. DOI:10.3321/j.issn:1001-9332.2005.05.007 |
沈海龙, 丁宝永, 沈国舫, 等. 1996. 樟子松人工林下针阔叶凋落物分解动态. 林业科学, 32(5): 393-402. |
田大伦, 朱小年, 蔡宝玉, 等. 1989. 杉木人工林生态系统凋落物的研究Ⅱ:凋落物的养分含量及分解速率. 中南林学院学报, 9(增): 45-55. |
屠梦照, 姚文华, 翁轰, 等. 1993. 鼎湖山南亚热带常绿阔叶林凋落物的特征. 土壤学报, 30(1): 35-41. |
王希华, 黄建军, 闫思荣. 2004. 天童国家森林公园常见植物凋落叶分解的研究. 植物生态学报, 28(4): 457-467. DOI:10.3321/j.issn:1005-264X.2004.04.003 |
吴幼媚, 彭桂华. 1993.杉格人工林生物物质循环特点及混交效益的研究//王宏志.中国南方混交林研究.北京: 中国林业出版社, 170-175
|
吴志东, 彭福泉, 车玉萍, 等. 1990. 我国南亚热带几种人工林的生物物质循环特点及其对土壤的影响. 土壤学报, 27(3): 250-260. |
肖慈英, 黄青春, 阮宏华. 2002. 松、栎纯林及混交林凋落物分解特性研究. 土壤学报, 39(5): 763-767. DOI:10.3321/j.issn:0564-3929.2002.05.022 |
许新建, 陈金耀, 俞新妥. 1995. 武夷山六种杉木伴生树种落叶养分归还的研究. 福建林学院学报, 15(3): 213-217. |
杨玉盛, 郭剑芬, 陈银秀, 等. 2004a. 福建柏和杉木人工林凋落物分解及养分动态的比较. 林业科学, 40(3): 19-25. |
杨玉盛, 郭剑芬, 林鹏, 等. 2004b. Nutrient dynamics of decomposing leaf litter in natural and monoculture plantation forests of Castanopsis kawakamii in subtropical China. 生态学报, 24(2): 201-208. |
张雪萍, 张毅, 侯威岭, 等. 2000. 小兴安岭针叶凋落物的分解与土壤动物的作用. 地理科学, 20(6): 552-556. DOI:10.3969/j.issn.1000-0690.2000.06.011 |
赵其国, 王明珠, 何园球. 1991. 我国热带亚热带森林凋落物及其对土壤的影响. 土壤, 23(1): 8-15. DOI:10.3321/j.issn:1009-2242.1991.01.005 |
Aber J D, Melillo J M. 1980. Litter decomposition: measuring relative contributions of organic matter and nitrogen to forest soils. Canadian Journal of Botany, 58: 416-421. DOI:10.1139/b80-046 |
Aerts R. 1997. Climate, leaf chemistry and leaf litter decomposition in terrestrial ecosystems: a triangular relationship. Oikos, 79: 439-449. DOI:10.2307/3546886 |
Aerts R, Caluwe H De. 1997. Nutritional and plant mediated controls on leaf litter decomposition of Carex species. Ecology, 78: 244-260. DOI:10.1890/0012-9658(1997)078[0244:NAPMCO]2.0.CO;2 |
Antonov G, Antonov I. 1995. A mathematical model of the rate of decomposition of the forest residue litter. Nauka-za-Gorata, 32(4): 43-47. |
Berg B. 2000. Litter decomposition and organic matter turnover in northern forest soils. Forest Ecology and Management, 133: 13-22. DOI:10.1016/S0378-1127(99)00294-7 |
Berg B, Berg M P, Bottner P. 1993. Litter mass loss rates in pine forests of Europe and Eastern United States: some relationships with climate and litter quality. Biogeochemistry, 20: 127-153. DOI:10.1007/BF00000785 |
Berg B, Matzner E. 2000. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems. Environmental Reviews, 5: 1-25. |
Bubb K A, Xu Z H, Simpson J A. 1998. Some nutrient dynamics associated with litterfall and litter decomposition in hoop pine plantations of southern Queensland, Australia. Forest Ecology and Management, 110: 343-352. DOI:10.1016/S0378-1127(98)00295-3 |
Edmonds R L, Thomas T B. 1995. Decomposition and nutrient release from green needles of western hemlock and Pacific silver fir in an old-growth temperate rain forests, Olympic National Park Washington. Canadian Journal of Botany, 25: 1049-1057. |
Hirschel G, Korner C, Arnone J A. 1997. Will rising atmospheric CO2 affect leaf litter quality and in situ decomposition rates in native plant communities?. Oecologia, 110(3): 387-392. DOI:10.1007/s004420050173 |
Hornsby D C, Lockaby B G, Chappelka A H. 1995. Influence of microclimate on decomposition in loblolly pine stands: a field microcosm approach. Canadian Journal of Forest Research, 25(10): 1570-1577. DOI:10.1139/x95-171 |
Kavvadias V A, Alifragis D, Tsiontsis A, et al. 2001. Litterfall, litter accumulation and litter decomposition rates in four forest ecosystems in northern Greece. Forest Ecology and Management, 144: 113-127. DOI:10.1016/S0378-1127(00)00365-0 |
Korner C. 1999. Quality, decomposition and isopod consumption of tree litter produced under elevated CO2. Oikos, 85(2): 271-281. DOI:10.2307/3546493 |
Lisanework N, Michelsen A. 1994. Litterfall and nutrient release by decomposition in three plantations compared with a natural forest in the Ethiopian highland. Forest Ecology and Management, 65: 149-164. DOI:10.1016/0378-1127(94)90166-X |
Loranger G, Ponge J F, Imbert D, et al. 2002. Leaf decomposition in two semi-evergreen tropical forests: influence of litter quality. Biology and Fertility of Soils, 35: 247-252. DOI:10.1007/s00374-002-0467-3 |
Lorenz K, Preston C M, Raspe S, et al. 2000. Litter decomposition and humus characteristics in Canadian and German spruce ecosystems: information from tannin analysis and 13C CPMAS NMR. Soil Biology and Biochemistry, 32: 779-792. DOI:10.1016/S0038-0717(99)00201-1 |
Louzada J N C, Schoereder J H, Marco Jr P D. 1997. Litter decomposition in semideciduous forest and Eucalyptus spp. crop in Brazil: a comparison. Forest Ecology and Management, 94: 31-36. DOI:10.1016/S0378-1127(96)03986-2 |
McHale P J, Mitchell M J, Bowles F P. 1998. Soil warming in a northern hardwood forest: trace gas fluxes and leaf litter decomposition. Canadian Journal of Forest Research, 28(9): 1365-1372. DOI:10.1139/x98-118 |
Micks P, Downs M R, Magill A H, et al. 2004. Decomposing litter as a sink for 15N-enriched additions to an oak forest and a red pine plantation. Forest Ecology and Management, 196: 71-87. DOI:10.1016/j.foreco.2004.03.013 |
Mondini C, Contin M, Leita L, et al. 2002. Response of microbial biomass to air-drying and rewetting in soils and compost. Geoderma, 105: 111-124. DOI:10.1016/S0016-7061(01)00095-7 |
Norgrove L, Hauser S. 2000. Leaf properties, litter fall, and nutrient inputs of Terminalia ivorensis at different tree stand densities in a tropical timber-food crop multistrata system. Canadian Journal of Forest Research, 30(9): 1400-1409. DOI:10.1139/x00-063 |
Olson J S. 1963. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 44: 323-331. |
Pausas J G, Casals P, Romanyà J. 2004. Litter decomposition and faunal activity in Mediterranean forest soils: effects of N content and the moss layer. Soil Biology and Biochemistry, 36: 989-997. DOI:10.1016/j.soilbio.2004.02.016 |
Pedersen L B, Hansen J B. 1999. A comparison of litterfall and element fluxes in even aged Norway spruce, Sitka spruce and beech stands in Denmark. Forest Ecology and Management, 114: 55-70. DOI:10.1016/S0378-1127(98)00381-8 |
Raich J W, Schlesinger W H. 1992. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate. Tellus, 44B: 81-99. |
Ritter E. 2005. Litter decomposition and nitrogen mineralization in newly formed gaps in a Danish beech (Fagus sylvatica) forest. Soil Biology and Biochemistry, 37: 1-11. DOI:10.1016/j.soilbio.2004.06.010 |
Sariyildiz T, Anderson J M. 2003. Interactions between litter quality, decomposition and soil fertility: a laboratory study. Soil Biology and Biochemistry, 35: 391-399. DOI:10.1016/S0038-0717(02)00290-0 |
Singh K P, Singh P K, Tripathi S K. 1999. Litterfall, litter decomposition and nutrient release patterns in four native tree species raised on coal mine spoil at Singrauli, India. Biology and Fertility of Soil, 29: 371-378. DOI:10.1007/s003740050567 |
Swift M J, Anderson J M. 1989. Decomposition//Lieth H. Ecosystems of the World, 14B. Tropical rain forest ecosystems; biogeographical and ecological studies. Amsterdam: Elsevier, 547-569
|
Taylor B R, Parkinson D, Parsons W F J. 1989. Nitrogen and lignin content as predictor of litter decay rates: a microcosm test. Ecology, 70: 97-104. DOI:10.2307/1938416 |
Van der Drift J. 1963. The disappearance of litter in mull and mor in connection with weather condition and the activity of the macrofauna//Doeksen J. Soil organisms. Holland: North-Holland Publishing Company, 124-132
|
Vitousek P M, Sanford R L. 1986. Nutrient cycling in moist tropical forest. Annual Review Ecology and Systtematics, 17: 137-167. DOI:10.1146/annurev.es.17.110186.001033 |
Vitousek P M, Turner D R, Parton W J, et al. 1994. Litter decomposition on the Mauna Loa environment matrix, Hawaii I: patterns, mechanisms, and models. Ecology, 75(2): 418-429. DOI:10.2307/1939545 |
Wesemael B V. 1993. Litter decomposition and nutrient distribution in humus profiles in some Mediterranean forests in southern Tuscany. Forest Ecology and Management, 57: 99-114. DOI:10.1016/0378-1127(93)90165-J |
Xuluc-Tolosa F J, Vester H F M, Ramírez-Marcial N, et al. 2003. Leaf litter decomposition of tree species in three successional phases of tropical dry secondary forest in Campeche, Mexico. Forest Ecology and Management, 174: 401-412. DOI:10.1016/S0378-1127(02)00059-2 |
Yang Y S, Guo J F, Chen G S, et al. 2004. Litterfall, nutrient return, and leaf-litter decomposition in four plantations compared with a natural forest in subtropical China. Annals of Forest Science, 61: 465-476. DOI:10.1051/forest:2004040 |
 2006, Vol. 42
2006, Vol. 42