文章信息
- 张晓燕, 赵广杰, 刘志军.
- Zhang Xiaoyan, Zhao Guangjie, Liu Zhijun.
- 木质生物质的生物分解及生物转化研究进展
- Research Progress of Biodegradation and Bioconversion of Wooden Biomass
- 林业科学, 2006, 42(3): 85-93.
- Scientia Silvae Sinicae, 2006, 42(3): 85-93.
-
文章历史
- 收稿日期:2005-07-08
-
作者相关文章
2. 河北农业大学林学院 保定 071001
2. Forestry College of Hebei Agricultural University Baoding 071001
木质生物质指的是植物通过光合作用生成的有机资源,主要由纤维素、半纤维素和木质素3种高分子物质构成,如树木、农作物秸秆等。全世界每年由光合作用生成的木质生物质约2 000亿t,相当于全世界每年消费能源的10倍,其中树木固定的木质生物质占整体的90%~95%(赵广杰,2004)。这是非常宝贵的自然资源,贮存着巨大的能量。
然而,我国目前却存在着对木质生物质资源的严重浪费。如我国木材加工工业采伐、加工剩余物每年就达到1 000万t(刘家建,1995);农业生产中的剩余物(农作物秸秆)每年也多于5亿t(吴坤等,2000),有效利用的只占很少一部分,大部分被浪费掉。同时在人们的日常生活中还会有大量弃置不用的木质材料,我国年产废弃木质材料360万t,如废旧家具、木制包装,建筑施工时遗弃的废木料(每年300万m3),道路及城市园林绿化系统更新的树木等(王珊珊等,2004)。这些废弃木质材料的处理要花费大量的资金,占用大量的土地。因此有专家提出关于废弃木质材料回收及再生利用的建议(崔积常等,2004)。在美国,把废弃的木质材料称为“第四种森林”,是倒在地上的森林(王珊珊等,2004)。这些材料如果能被再次利用,势必产生巨大的经济效益和社会效益。
随着经济和社会的发展以及人口的增长,对粮食和能源的需求也在逐渐增长,面对着不可更新的化石资源面临枯竭,粮食和能源危机成了当前人类发展所面临的重要问题。用微生物酶可以将木质生物质材料分解转化,得到葡萄糖和各种低聚糖作为人类的营养品和保健品,得到菌体蛋白可以作为人类食品和动物饲料,葡萄糖继续发酵还可得到乙醇、甲烷等清洁燃料。因此,木质生物质作为一种可更新的有机资源,对于解决粮食和能源问题以及城市废弃木质资源有双重意义。同时这种木质材料的生物转化过程又不会对环境造成污染,有很好的发展前景,近些年来愈来愈受到人们的关注和重视。\=
1 木质生物质各组分的生物分解 1.1 多糖的生物分解木材中的多糖指的是纤维素和半纤维素。纤维素是一切植物体的主要组成部分,由β-D-葡萄糖通过β-1, 4糖苷键相结合而形成的链状高分子聚合物,聚合度在7 000~10 000之间,占植物体干质量的50%左右,地球上每年由光合作用生成的纤维素约1 100亿t(张全福等,1994;Kubicek et al., 1993),是最丰富的木质生物质资源。半纤维素是一类非均一多糖的总称,常带有短的侧链。构成半纤维素主链的糖基主要有D-木糖、D-葡萄糖、D-甘露糖等;构成侧链的糖基主要有D-木糖、D-半乳糖、D-葡萄糖、L-阿拉伯糖、D-半乳糖醛酸、D-葡萄糖醛酸基等。木聚糖是一类含量最多的半纤维素,在针叶树材中,甘露聚糖也占了相当的比例(Thompson,1983)。半纤维素在自然界中的分布仅次于纤维素,占植物体干质量的20%~30%。
1.1.1 纤维素和半纤维素降解酶的种类及其作用机理纤维素酶是一组相互关联, 通过协同作用降解纤维素的酶系, 包括3类酶(Thomas,1985;高培基等,1988)。
1) 内切β-1, 4-葡聚糖酶(endo-β-1, 4 glucanase, EC3.2.1.4, 简称EG, 属CX酶)
EG作用于纤维素分子内部的非结晶区,随机水解β-1, 4糖苷键,将长链纤维素分子截短,产生大量带有非还原性末端的小分子纤维素和可溶性纤维寡聚糖,终产物是葡萄糖和纤维二糖;EG能水解膨胀的纤维素和水溶性的纤维素衍生物,不能单独作用于结晶的纤维素。
2) 外切β-1, 4-葡聚糖酶(exo-β-1, 4 glucanase, EC3.2.1.91),又称纤维二糖水解酶(cellobiohydrolase,简称CBH,属C1酶)
CBH作用于纤维素分子链非还原性末端,水解β-1, 4糖苷键,每次切下一个纤维二糖分子,故又称纤维二糖水解酶。它对无定形纤维素和微晶纤维素有较强作用,单独作用于结晶纤维素时酶活力较低,效果较弱,但该酶能同EG协同作用,彻底水解结晶纤维素。
有些真菌还能产生另外一类外切β-1, 4-葡聚糖酶(EC3.2.1.74),可从纤维糊精的非还原端依次释放葡萄糖,同EG没有协同作用,不能水解结晶纤维素,而只能水解EG作用产生的纤维寡聚糖。因而也属CX酶。
3) β-葡萄糖苷酶(β-1, 4 glucosidase, EC3.2.1.21),又称纤维二糖酶(简称CB)
β-葡萄糖苷酶水解纤维二糖和水溶性的纤维寡聚糖生成葡萄糖(姚荣等,1996)。虽然它对纤维素大分子无作用,但它可以消除上述2种酶催化反应终产物的抑制作用,从而大大促进反应进程。因此,β-葡萄糖苷酶在纤维素酶系中具有非常重要的作用,纤维素酶系统具有“协同作用”是它的一个显著特点。
总之,纤维素酶解时,无定形区纤维素仅EG即可水解,但结晶纤维素要求EG和CBH协同作用才可水解。因此,在纤维素酶解糖化过程中,EG与CBH的比值会显著影响纤维素的溶解速度。这3类酶分解纤维素的机理如图 1所示。
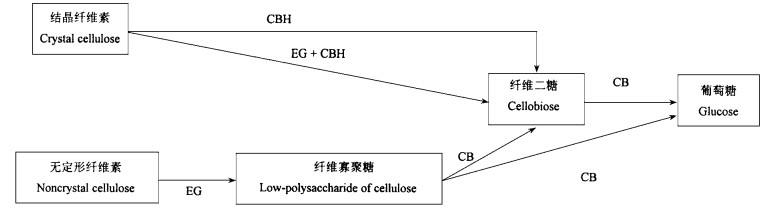
|
图 1 纤维素酶系对纤维素的作用方式 Fig. 1 Function mode of cellulase system to cellulose |
半纤维素由于其结构的复杂性,它的完全降解需要多种酶的共同作用。半纤维素酶是一组复合酶系的总称,主要包括内切酶、外切酶和分枝酶3类(刘同军等,1998):内切酶可随机切断主链内的糖苷键而生成寡糖,如β-木聚糖酶作用于木聚糖主链的木糖苷键而水解木聚糖,β-甘露聚糖酶作用于甘露聚糖主链的甘露糖苷键而水解甘露聚糖;外切酶主要是一些糖苷酶,如β-葡萄糖苷酶、β-木糖苷酶、β-甘露糖苷酶等,它们以外切机制作用于寡糖,生成各种单糖;由于半纤维素常带有一定的支链取代基,所以还需要分枝酶参与,如阿拉伯糖苷酶、半乳糖苷酶等。这3类酶协同作用才能最大限度地水解半纤维素。
1.1.2 降解纤维素和半纤维素的微生物在自然界中,细菌、放线菌、真菌、原生动物等都能产生纤维素酶和半纤维素酶。但细菌、放线菌和原生动物产生的纤维素酶和半纤维素酶量很少,而且多数不能分泌到细胞外,属胞内酶。Pierre等(1992)和Anatole等(1990)的研究表明直接从细菌培养液中提取纤维素酶是不可行的。霉菌、担子菌等真菌能产生大量的胞外纤维素酶和半纤维素酶,尤以木霉属(Trichoderma)和曲霉属(Aspergillus)的产量居上。所以在产纤维素酶的真菌中, 研究最多的是木霉和曲霉, 如绿色木霉(Trichoderma viride)、里氏木霉(T. reeaei)、康氏木霉(T. koningli)、黑曲霉(Aspergillus niger)、米曲霉(A. terreus)等(Thomas,1992;余世袁,2000)。
1.2 木质素的生物降解木质素是由3种苯丙烷单元(愈创木基丙烷、紫丁香基丙烷、对羟苯基丙烷)通过醚键和碳-碳键相连接的复杂的无定形网状高聚物,在木本植物中的含量占到了植物体干质量的27%~32%,草本植物中占14%~25%,与纤维素和半纤维素共同被称为植物体内的“三素”(陶用珍等,2003)。在植物体内,木质素与半纤维素经共价键结合,将纤维素分子包埋在中间,增加了细胞壁的强度,保护了细胞壁上的多糖成分,使之不易被微生物降解(付伟等,2004)。同时木质素本身的降解过程也与一般生物多聚物酶催化的水解反应明显不同,而是一系列酶催化和非酶催化的非特异性氧化还原过程。由于结构的复杂性,其降解酶类的合成需由水解碳水化合物提供能量,木质素的包被作用又阻碍着纤维素多糖的降解,所以木质素降解构成了自然界碳循环的限速步骤(卢雪梅等,1996)。
1.2.1 木质素降解酶的种类及其作用机理目前,关于木质素降解酶的研究工作主要集中在白腐菌所产生的酶系,研究得最多的有3种:木质素过氧化物酶(Lignin Peroxidase, LiP)、锰过氧化物酶(Manganese Peroxidase, MnP)和漆酶(Laccase),它们分别代表一系列的同功酶。通常白腐菌降解木质生物质原料分为2个阶段:首先菌丝分泌纤维素酶和半纤维素酶降解聚糖类以提供真菌生长所需的营养物,然后才降解木质素。木质素的微生物降解在很大程度上是一种氧化过程(管莜武等,1998)。
1) 木质素过氧化物酶(LiP)和锰过氧化物酶(MnP)
LiP和MnP都是带有糖基的胞外血红素蛋白,又称血红素过氧化物酶(Heme Peroxidase)。两者都需要H2O2催化,MnP还要有Mn2+的参与(陈立祥等,2003)。菌丝在生长过程中分泌出LiP和MnP,由于酶的催化作用,木质素结构中的苯环发生单电子氧化反应形成苯氧自由基,随后发生一系列非酶催化的自由基反应而降解,包括甲氧基的脱除,侧链上Cα-Cβ,Cβ-Cγ及烷基芳基醚键的断裂,直至苯环的裂解等。木质素的降解产物再被菌丝体吸收,进一步氧化成CO2和H2O(管莜武等,1998;Michael et al., 1993)。由于MnP的氧化还原电位较低,只能氧化酚型结构的木素。而Lip有非常高的氧化还原电势, 是迄今为止发现的唯一一种可以单独氧化降解非酚型木素结构的过氧化物酶。
2) 漆酶(Laccase)
大部分真菌除产生LiP和MnP外,还能产生漆酶。漆酶是含铜的氧化酶,分漆树漆酶和真菌漆酶2类(季立才等,1997)。由于漆酶的含量较高,难以得到它的X射线衍射图,所以它的三维空间构象还不十分清楚(吴坤等,2000;陈立祥等,2003)。但作为一种多酚氧化酶,它在分子氧存在时能使羟基脱去质子形成酚氧阴离子,引起木质素酚型结构单元侧链断裂,包括C—C键、脱甲氧基、脱羟基等,铜在其中起决定作用(季立才等,1997;王佳玲等,1998)。漆酶降解木质素不需要H2O2参与,因此有一定的优越性。但漆酶由于其氧化还原电位较低,不能氧化占木素含量90%的非酚型木素,只能氧化木素的酚型结构单元。但在低分子物质作为介质时,漆酶也可以氧化非酚型结构的木素。
3) 其他酶类
木质素降解酶系是非常复杂的一个体系,除了上述3种重要的酶外,还有其他一些酶,如过氧化氢酶、葡萄糖氧化酶、芳醇氧化酶、乙二醛氧化酶等也参与了对木素的降解,但到目前为止,每一种酶在木质素降解中的具体作用还不十分清楚(Elisa et al., 1999)。
确定每一种酶在木质素降解过程中的作用和功能比较困难,因为目前还没有发现哪一种单一的酶能将木质素彻底、完全降解。这些降解木质素的酶是相互作用、共同影响的,它们存在于一个协同作用的体系中。如当Laccase和MnP分别单独存在时,都不能有效地降解木质素,而2种酶同时存在则木质素可得到有效降解。另外,在反应中加入其他酶如葡萄糖氧化酶,可显著提高木质素的降解程度。可见,这些酶在催化木质素降解反应中具有协同作用。
1.2.2 降解木质素的微生物种类能降解木质素的微生物种类很多,其中真菌是主要的木质素降解菌。降解木质素的真菌——木腐菌(wood-rot fungi)可分为白腐菌、褐腐菌和软腐菌3类。白腐菌(white-rot fungi)是最主要的木质素降解真菌,它是一种丝状真菌,首先降解木质生物质中的木质素,且不产生色素(陈立祥等,2003),引起木材白色腐朽。白腐菌及其分泌的酶目前主要用于生物制浆预处理和纸浆的生物漂白。研究得最多的白腐菌多属于担子菌,有:黄孢原毛平革菌(Phanerochete chrysosporium)(Singhal et al., 2001;Gelpke et al., 1999)、Ceriporriopsis subvermispora (Mario et al., 2000;Ferraz et al., 2000;2001)、彩绒革盖菌(云芝,Coriolus versicolor)(冀玲芳等,2002)、糙皮侧耳(Pleurotus ostreatus)(Yasuhiko et al., 1995)、变色栓菌(Trametes versicolor) (Ong et al., 1997)等。褐腐菌首先降解纤维素和半纤维素,然后才缓慢降解木质素,并在降解过程中产生褐色醌式发色团导致木材褐变。软腐菌(soft-rot fungi)多为子囊菌和半知菌,可以降解软木中的所有主要成分,包括木质素(陈叶福等,2001)。但褐腐菌和软腐菌降解木质素的能力都弱于其降解纤维素的能力,因此白腐菌被认为是主要的木质素降解真菌。
除真菌外,一些细菌和放线菌等原核生物对于土壤中木质素的转化和降解也具有重要作用。土壤中木质素的降解是土壤微生物区系中多种微生物共同作用的结果(冀玲芳等,2002;Rayner et al., 1988),白腐菌首先参与土壤中木质素高分子的降解,然后再由细菌和放线菌进一步对残余木质素进行分解,即细菌和放线菌在土壤木质素降解中起二次分解作用,因而它们在木质素降解菌的研究中处于相对次要的地位。
最近也有关于酵母降解木质素的报道。Vilas-Boas等(2002)研究了产朊假丝酵母固体发酵苹果渣过程中各种酶活性的变化,其中几丁质酶和锰过氧化物酶活性较高,分别为239和19.1 U·mL-1, 证明产朊假丝酵母有木质纤维素降解能力。Elena等(2001)报道类酵母Geotrichum klebaahnii也能有效降解木质素。
2 木质生物质生物转化研究现状 2.1 木质生物质转化为乙醇利用废弃的木质生物质原料,如农林废弃物、锯末、废纸等可再生资源酶解发酵制取乙醇是进一步开拓乙醇生产原料有效而又合理的途径之一。这样不仅可缓解石油资源的枯竭,还解决了废弃木质生物质资源的再利用问题,是很有发展前景的。在美国,乙醇已经被广泛作为特殊的石油替代品加入到汽油中以降低汽油的消耗(许凤等,2004)。
木质生物质生物转化乙醇技术一般包括预处理、水解、发酵等过程,以下分别进行讨论。
2.1.1 木质生物质原料的预处理方法木质生物质原料预处理的目的是破坏纤维素-半纤维素-木质素之间的连接,降低纤维素的结晶度,增加纤维素的比表面积,以便于纤维素酶的作用(许凤等,2004;王丹等,2002)。预处理的方法很多,包括物理法、化学法、物理化学法和生物法等,其中蒸汽爆破预处理法研究较多,对阔叶材来说是最经济有效的预处理方法(Duff et al., 1996;Wright,1998)。因为在蒸汽爆破过程中,木片通过高压饱和蒸汽处理,然后压力骤减,使原料经爆破性减压而碎裂,物理和化学的作用引起半纤维素水解成单糖和寡糖,部分木质素溶解,使得纤维素溶解性增大,适合于纤维素酶的作用。传统的机械方法若达到相同尺寸的木材颗粒,消耗的能量要比蒸汽爆破法高70%(Holtzapple et al., 1989)。Grethlein等(1991)的研究表明稀酸水解也能有效地去除半纤维素和部分木素,增加木材孔隙的表面积,促进酶的水解率,与蒸汽爆破法相比,如果得到的表面积相同,酶水解率也就相同。
用蒸汽爆破方法预处理木片时添加SO2,或在爆破前对木片注入SO2或硫酸,可以促进酶的水解过程,而且对针叶材也有效。Clark等(1987)通过试验模型描述了辐射松(Pinus radiata)木片蒸汽爆破预处理时,时间、温度和SO2浓度对还原糖得率的影响,得到了优化的预处理条件:3 min,215 ℃,2.55% SO2,在这些条件下,爆破纤维的酶解率为82%,总糖得率57%。Mackie等(1985)进一步探讨了SO2的作用机制,发现注入的SO2有50%与木材成分,主要是与木素相结合,这样虽然使爆破处理过的木片中水溶性木素的含量降低,但碱木素的含量升高,有利于下一步碱处理时木素的大量溶出。
2.1.2 木质生物质转化为乙醇的研究木质纤维原料生物转化为乙醇的方法有2类:一是原料先经纤维素酶和半纤维素酶水解,产生葡萄糖和木糖等可发酵性糖,然后再由另一类微生物(如细菌、酵母菌)发酵产生乙醇,即两步发酵法(Tsao et al., 1982)。另一类是一步发酵将木质纤维原料转化为乙醇,其中又可分为2种微生物参与的同时发酵(张德强等,2000;Zhao et al., 1993)和仅用一种微生物的直接发酵法(王丹等,2002;Hogsett et al., 1992)。
Zhao等(1993)用造纸厂废纤维进行了同时糖化发酵乙醇的研究,结果发现,向Penicillium decumbens JU-A10的纤维素酶中添加Aspergillus niger L22的富含β-葡萄糖苷酶的纤维素酶可大大促进发酵进程,当混合纤维素酶中β-葡萄糖苷酶活与滤纸酶活之比为1.0且滤纸酶活不小于2.0 IU·mL-1时,获得的最大乙醇浓度为5.4%,比仅用Penicillium decumbens的纤维素酶乙醇产量提高42.1%。
Murray等(1984)用Zymomonas mobilis及其变异株Clostridium saccharolyticum对HF水解杨木得到的己糖和戊糖进行同时糖化发酵,由于Zymomonas mobilis转化葡萄糖为乙醇,而其变异株Clostridium saccharolyticum转化木糖为乙醇,从而大大提高了转化效率,达到理论最高转化率的93.2%。
Jeffrey等(1989)比较了蒸汽预处理的白杨木酶和酸的半纤维素水解产物发酵乙醇的能力,发现酶的水解产物由于含较少的抑制物,经乙酸乙酯抽提后,发酵乙醇的能力高于酸的水解产物,分批发酵72 h时,乙醇产率达到0.20 g·L-1h-1。
Nguyen等(1991)和Gregg等(1995)对木材转化乙醇的基本过程进行了总结分析,包括木材的预处理、酶水解、葡萄糖和木糖的乙醇发酵、产品回收、废物处置等。Nguyen还建立了用于评价木材酶水解过程中技术和经济指标的综合模型,指出了对乙醇成本影响最大的参数依次为:木材成本、酶的成本、纤维素酶解率、木糖发酵乙醇的产率、分馏效率和木质素副产品的售价等。
2.2 木质生物质转化为单细胞蛋白(SCP)单细胞蛋白(single cell protein, SCP)是通过发酵培养单细胞微生物而制成的蛋白质(周亚樵,2000)。微生物细胞蛋白质含量高,主要替代鱼粉等蛋白饲料,还可供人食用。生产SCP的微生物有细菌、酵母、单细胞藻类和真菌等,其中酵母菌由于菌体细胞较大,容易回收,核酸含量低,赖氨酸含量高,能在酸性条件下生长,可利用的碳源较广,能以农林副产品、食品及发酵工业下脚料为原料,所以酵母菌成为SCP研究和生产的主要菌种。如假丝酵母属(Candida)、圆酵母属(Torula)、和丝孢酵母属(Trichosporom)等。生产方法有2种:一种是先将原料经纤维素酶、半纤维素酶等糖化后,再用酵母等微生物生产SCP(徐坚平等,1995);另一种是直接利用纤维素和半纤维素分解菌和酵母菌同时糖化发酵菌体转化成SCP(Rodriguez et al., 1994)。
童英凯等(1995)对锯末发酵用作饲料进行了研究,锯末在固体发酵前先经热喷预处理,然后接种纤维素分解菌,发酵72 h后,经测定粗蛋白的含量提高。用发酵锯末饲喂蛋鸡试验,结果表明,发酵锯末可以替代基础日粮中的部分玉米,产蛋率和料蛋比与对照组差异均不显著。
Chahal等(1981)研究了白杨木(Aspen wood)用不同的预处理方法处理对Chaetomium cellulolyticum发酵生产SCP的影响。发现高压蒸汽比常压蒸汽预处理的效果好,因为高压蒸汽能使木材断裂为更小的碎片;用亚氯酸钠预处理,由于脱木素更完全,产物粗蛋白的含量最高,达到37.9%,有效生长率达0.19 h-1,纤维素的利用率也达到最高(90%)。Wicklow等(1984)比较了不同菌株降解麦秸和枫木中木质纤维素的能力,结果发现最有效降解麦秸的菌种不一定在降解阔叶材上最有效,表明我们不能对单一菌种降解不同原料的能力进行准确预测。
桉树木材中的半纤维素很容易被酸水解,水解液富含可发酵性糖,主要是木糖,可以生物转化为不同的产品,如SCP和木糖醇。Almeida等(1995;2003)进行了桉树木材半纤维素水解液转化SCP的研究,并用表面反应方法对桉树半纤维素水解液培养Paecilomyces variotii IOC-3764的营养条件进行了优化, 在含有10 g·L-1米糠、2.0 g·L-1氮和1.1 g·L-1磷酸钠的介质中培养89 h,细胞浓度达到12.06 g·L-1。
2.3 木质生物质转化为木糖醇木糖醇是一种五碳糖醇,有甜味,但在人体内的代谢不需要消耗胰岛素,不会引起血糖水平的波动,还有特殊的防龋功能,可以作为糖尿病人的营养剂、治疗剂及功能性甜味剂用于防龋性糖果。木糖醇还具有类似甘油和多元醇的特性,因此广泛用于医药、保健品和化工等行业(孙昆山等,2001;董丽辉等,2004)。
传统的木糖醇生产方法是先水解木聚糖含量高的半纤维素物质,从水解液中提取木糖,然后再加氢还原成木糖醇。这种生产方法费用高、程序复杂,而且木糖醇的得率低,只有50%~60%(孙昆山等,2001)。现在,采用微生物转化半纤维素水解液生产木糖醇引起了科研人员的极大关注。在自然界中产木糖醇的微生物主要是酵母,丝状真菌和少数细菌也可生成木糖醇,但效率不高。现已发现产木糖醇性能优异的酵母菌株主要集中于假丝酵母属(Candida)如C. guilliermondii(Felip et al., 1996;Preziosi et al., 2000)、C. tropicalis(Oh et al., 1998)、C. parasilisis(Kim et al., 1997);部分属于德巴利酵母属(Debaryomyces),如D. hansenii(Dominguez et al., 1997;Parajo et al., 1996a)和管囊酵母属(Pachysolen),如P. tannophilus(Parajo et al., 1998)。
Preziosi等(2000)研究了白杨木半纤维素水解物用Candida guilliermondii分批发酵木糖醇,并与半确定培养基进行了比较。发现虽然杨木半纤维素水解物中的葡萄糖对木糖的代谢有抑制作用,但用半确定培养基进行的研究表明,葡萄糖可以使发酵时间明显缩短(从50 h到30 h),从而促进了木糖醇的产率。通过添加酵母抽出物并控制氧的供给,白杨木半纤维素水解物发酵木糖醇的最大转化率可达0.8 g·g-1,生产率可达0.6 g·L-1h-1。
Felip等(1996)和Parajo等(1996a)都研究了最初接种浓度对桉木半纤维素水解物发酵木糖醇的影响。Felip等(1996)用桉木半纤维素水解物分批发酵木糖醇,发现随接种浓度的升高,明显促进了C. guilliermondii对底物的利用和木糖醇产生。在接种浓度为3.0 g·L-1,发酵88 h后,木糖醇的浓度达到13.77 g·L-1,且高浓度接种在发酵初期就观察到葡萄糖和木糖同时被利用,接种后30 h,葡萄糖被完全利用;低浓度接种(1.0 g·L-1)会产生一个不消耗木糖的迟滞期,且葡萄糖的消耗时间向后推移,发酵88 h才观察到葡萄糖和木糖同时被利用的情况,发酵时间明显延长。Parajo等(1996a)用真空蒸发浓缩的桉木半纤维素水解物,经活性炭去除酚类物质并添加营养成分后发酵木糖醇。木糖浓度为58~78 g·L-1,进行分批培养,发现最初接种浓度为16 g·L-1时,木糖几乎不被消耗;但在相同的木糖浓度下,最初接种浓度为50~80 g·L-1时,可得到39~41 g·L-1的木糖醇。
2.4 木质生物质转化为其他产品的研究 2.4.1 转化为乳酸乳酸和乳酸盐在食品、医药和高聚物工业中有重要应用,可以通过化学和生物技术过程生产。由于消费者更多地追求“天然”产品,所以发酵乳酸在市场上占的份额越来越大,尤其是食品行业。松树和桉树木材易于碱抽提或脱木素润胀处理,Parajo等(1996b)研究用预处理后的固体剩余物—多糖部分作为酶水解的底物,产生的单糖用Lactobacillus delbrueckii NRRL B-445发酵乳酸,经10.9 h的发酵,乳酸的最高体积生产率为5.2 g·L-1h-1,与Hanson等(1972)报道的用同一菌种发酵乳酸的最高生产率6.5 g·L-1h-1接近,并建立了乳酸发酵的动力学模型。
Moldes等(1999)也用预处理的桉树木材作原料,用缺乏葡萄糖苷酶活性的纤维素酶系水解液发酵乳酸。在滤纸酶活28 U·g-1、液固比为30:1,45 ℃的条件下,纤维素最高转化率为61.9%,并建立了纤维二糖和葡萄糖共同发酵乳酸的动力学模型,且与试验数据吻合很好。
2.4.2 转化为丁二酸丁二酸作为生产合成树脂和生物高聚物的绿色原料受到很大重视,研究表明,它主要通过厌氧细菌发酵葡萄糖得到(Lee et al., 2000;2003)。Lee等(2003)报道了用橡木水解液通过分批培养Anaerbiospirillum succiniciproducens生产丁二酸。在27 g glucose·L-1的木材水解液中添加10 g·L-1的稻草浸提液作为复合氮源,丁二酸得率为24 g·L-1,产率为88% (g·g-1 glucose),与酵母抽出物作氮源的丁二酸产率相当,从而降低了成本。
3 木质生物质生物转化研究的发展方向利用废弃木材糖化发酵生产乙醇是一个具有巨大潜力的新领域,可以实现废物资源化和无害化,但目前存在的问题还很多,最主要的是生产成本高和中间产物对生产过程的反馈抑制作用。今后的研究应围绕如何解决这些问题来展开,如寻找新的原料预处理方法,提高转化率,降低成本;将纤维素糖化与发酵同步进行(即同时糖化发酵)(袁晓燕等,1996),可将生成的葡萄糖立即转化为乙醇,消除了中间产物葡萄糖对纤维素酶的抑制作用,但乙醇对酶产生的抑制作用也应予以重视。
在木材生物转化为乙醇的过程中,由于戊聚糖是半纤维素的主要成分,占木材原料干质量的10%~40%。木材水解液中除己糖外,还有戊糖,其中戊糖(主要是木糖)占30%左右,因此,戊糖、己糖同步发酵转化成乙醇可以提高乙醇得率,降低生产成本。因此选择性能优良的纤维素酶生产菌株和戊糖发酵菌株,实现戊糖、己糖同步发酵也是该项领域研究的方向(高卫华等,2004;孙金凤等,2004)。
目前,半纤维素资源生物转化木糖醇的研究遇到的问题是,水解液中存在抑制酵母发酵木糖的副产物,如糠醛、乙酸等,从而影响木糖的转化率。今后的研究方向是如何经济有效地进行水解液的脱毒,提高水解液的发酵性能,以及寻找适宜的发酵条件,从而提高水解液中木糖的转化率(孙昆山等,2001)。另外,实现半纤维素物质的同时糖化发酵木糖醇也是生物转化木糖醇研究的发展方向。
在单细胞蛋白的生产方面,今后的研究应放在如何防止杂菌污染,控制发酵过程的研究,其中探讨反应的动力学是驾驭发酵过程的重要基础工作(周亚樵,2000)。
总之,木材生物转化研究有着非常重要的现实意义,是解决当前世界面临的能源、粮食和环境危机的重要途径,是变废为宝,实现人类可持续发展的重要保障。这方面的研究无论是基础理论研究,还是其应用开发,都期待着科研人员的努力和有关部门的支持与投入。
陈立祥, 章怀云. 2003. 木质素生物降解及其应用研究进展. 中南林学院学报, 23(1): 79-85. DOI:10.3969/j.issn.1673-923X.2003.01.006 |
陈叶福, 郭雪娜, 王正祥, 等. 2001. 木质素生物降解与纸浆工业废水脱色. 工业微生物, 31(4): 49-53. DOI:10.3969/j.issn.1001-6678.2001.04.012 |
崔积常, 郭萌. 2004.我国城市木材废弃物亟待重视——关于废旧木材资源再生利用的建议.新世纪生物材料与木材工业的可持续发展研讨会论文集, 68-71
|
董丽辉, 周晓云, 张朝晖. 2004. 生物转化生产木糖醇研究进展. 科技通报, 20(1): 37-41. DOI:10.3969/j.issn.1001-7119.2004.01.010 |
付伟, 廖祥儒, 王俊峰. 2004. 植物体内的木质素. 生物学通报, 39(2): 12-14. DOI:10.3969/j.issn.0006-3193.2004.02.004 |
高培基, 曲音波, 王祖农. 1988. 维素酶解过程的分析和测定. 生物工程学报, 4(4): 324. |
高卫华, 张敏华, 刘成, 等. 2004. 能利用五碳糖和六碳糖生产乙醇的基因工程菌菌株的构建. 工业微生物, 34(1): 56-62. DOI:10.3969/j.issn.1001-6678.2004.01.011 |
管莜武, 张甲耀, 罗宇煊. 1998. 木质素降解酶及其调控机理研究的进展. 上海环境科学, 17(11): 46-49. |
季立才, 胡培植. 1997. 漆酶催化氧化反应研究进展. 林产化学与工业, 17(1): 79-83. |
冀玲芳, 石淑兰. 2002. 木质素的微生物降解. 广西轻工业, (1): 4-5, 10. DOI:10.3969/j.issn.1003-2673.2002.01.001 |
刘家建, 陆怡. 1995. 纤维素酶的研究及应用综述. 林产化工通讯, (1): 6-10. |
刘同军, 张玉臻. 1998. 半纤维素酶的应用进展. 食品与发酵工业, 24(6): 58-61. DOI:10.3321/j.issn:0253-990X.1998.06.014 |
卢雪梅, 刘紫鹃, 高培基. 1996. 木质素生物降解的化学反应机制. 林产化学与工业, 16(2): 75-82. DOI:10.3321/j.issn:0253-2417.1996.02.001 |
孙金凤, 徐敏, 张峰, 等. 2004. 利用木糖和葡萄糖合成乙醇的新型重组大肠杆菌的研究. 微生物学报, 44(5): 600-604. DOI:10.3321/j.issn:0001-6209.2004.05.010 |
孙昆山, 吴绵斌, 夏黎明. 2001. 利用可再生纤维素资源生物转化生成木糖醇的研究进展. 食品与发酵工业, 27(9): 74-78. DOI:10.3321/j.issn:0253-990X.2001.09.018 |
陶用珍, 管映亭. 2003. 木质素的化学结构及其应用. 纤维素科学与技术, 11(1): 42-55. DOI:10.3969/j.issn.1004-8405.2003.01.009 |
童应凯, 王学玲, 宋绍奎, 等. 1995. 锯末作饲料的开发研究. 农牧产品开发, (10): 20-21. |
王丹, 林建强, 张萧, 等. 2002. 直接生物转化纤维素类资源生产燃料乙醇的研究进展. 山东农业大学学报, 33(4): 525-529. DOI:10.3969/j.issn.1000-2324.2002.04.027 |
王佳玲, 余惠生, 付时雨, 等. 1998. 白腐菌漆酶的研究进展. 微生物学通报, 25(4): 233-235. |
王珊珊, 孙芳利, 段新芳. 2004.废弃木质材料的循环利用现状及其研究展望.新世纪生物材料与木材工业的可持续发展研讨会论文集, 62-67
|
吴坤, 张世敏, 朱显峰. 2000. 木质素生物降解研究进展. 河南农业大学学报, 34(4): 349-354. DOI:10.3969/j.issn.1000-2340.2000.04.012 |
许凤, 孙润仓, 詹怀宇. 2004. 木质纤维原料生物转化燃料乙醇的研究进展. 纤维素科学与技术, 12(1): 45-54. DOI:10.3969/j.issn.1004-8405.2004.01.008 |
徐坚平, 刘均松, 孔维, 等. 1995. 利用秸秆类物质微生物共发酵生产单细胞蛋白. 微生物学通报, 22(4): 222-225. |
姚荣, 丁霄霖. 1996. β-葡萄糖苷酶的研究概况. 天津微生物, (2): 23-25. |
袁晓燕, 盛京, 张瑛. 1996. 纤维素废弃物的生物转化. 功能高分子学报, 9(4): 622-630. |
余世袁. 2000. 林产资源的生物转化与利用. 南京林业大学学报, 24(2): 1-5. DOI:10.3969/j.issn.1000-2006.2000.02.001 |
张德强, 黄镇亚, 张志毅. 2000. 木质纤维生物量一步法(SSF)转化成乙醇的研究(Ⅲ)——毛白杨爆破原料一步法转化成乙醇的研究. 北京林业大学学报, 22(6): 50-54. DOI:10.3321/j.issn:1000-1522.2000.06.013 |
张全福, 严岩, 傅海虹. 1994. 开发生物能促进环境保护. 农业环境与发展, (4): 34-36. |
赵广杰. 2004.木质生物质的生物、热化学变换及功能性生态材料制备.新世纪生物材料与木材工业的可持续发展研讨会论文集, 139-146
|
周亚樵. 2000. 植物质生物转化发展近况. 纤维素科学与技术, 8(3): 59-66. DOI:10.3969/j.issn.1004-8405.2000.03.009 |
Almeidae Silva J B, Mancilha I M, Vanetti M C D, et al. 1995. Mocrobiol protein production by cultivated in eucalyptus hemicellulosic hydrolyzate. Bioresource Technology, 52: 197-200. DOI:10.1016/0960-8524(95)00029-E |
Almeidae Silva J B, Lima U A, Taqueda M E S, et al. 2003. Use of response surface methology for selection of nutrient level for culturing in eucalyptus hemicellulosic hydrolyzate. Bioresource Technology, 87: 45-50. DOI:10.1016/S0960-8524(02)00199-2 |
Anatole A, Klyosov. 1990. Trends in biochemistry and enzymology of cellulose degredation. Biochemistry, 29(47): 10577-10585. DOI:10.1021/bi00499a001 |
Chahal D S, Moo-Young M, Vlach D. 1981. Effect of physical and physicochemical pretreatments of wood for SCP production with Chaetomium. Biotechnology and Bioengineering, 23: 2417-2420. DOI:10.1002/bit.260231103 |
Clark T A, Mackie K L. 1987. Steam explosion of the softwood Pinus radiata with sulphur dioxide addition. I. Process optimization. Journal of Wood Chemistry and Technology, 7(3): 373-403. DOI:10.1080/02773818708085275 |
Dominguez J M, Gong C S, Tsao G T. 1997. Production of xylitol from D-xylose by Debaryomyces hansenii. Applied Biochemistry and Biotechnology, 63/65: 117-127. DOI:10.1007/BF02920418 |
Duff Sheldon J B, Murray William D. 1996. Bioconversion of forest products industry waste cellulosics to fuel ethnol: a review. Bioresource Technology, 55: 1-33. DOI:10.1016/0960-8524(95)00122-0 |
Elena S, Bozena K. 2001. Modification of lignin by Geotrichum klebahnii. World Journal of Microbiology & Biotechnology, 17: 1-3. |
Elisa V, Angel T, Martinez, et al. 1999. Molecular cloning of aryl-alcohol xidase from the fungus Pleurotrs eryngii, an enzyme involved in lignin degradation. Biochemistry, 34(1): 113-117. |
Ferraz A, Parra C, Freer J, et al. 2000. Characterization of white zones produced on Pinus radiata wood chips by Ganoderma australe and Ceriporriopsis subvermispora. World Journal of Microbiology & Biotechnology, 16: 641-645. |
Ferraz A, Rodriguez J, Freer J, et al. 2001. Biodegradation of Pinus radiata softwood by white-and brown-rot fungi. World Journal of Microbiology & Biotechnology, 17: 31-34. |
Felip M G A, Alves L A, Silva S S, et al. 1996. Fermentation of eucalyptus hemicellulosic hydrolysate to xylitol by Candida guilliermondii. Bioresource Technology, 56: 281-283. DOI:10.1016/0960-8524(96)00031-4 |
Gelpke M, Mary M, Cereghino G, et al. 1999. Homologous expression of recombinant lignin peroxidase in Phanerochete chrysosporium. Applied and Environmental Micribiology, 65(4): 1670-1674. |
Gregg D, Saddler J N. 1995. Bioconversion of lignocellulosic residue to ethanol: Process flowsheet development. Biomass and Bioenergy, 9(1-5): 287-302. DOI:10.1016/0961-9534(95)00097-6 |
Grethlein H E, Converse A O. 1991. Common aspects of acid prehydrolysis and steam explosion for pretreating wood. Bioresource Technology, 36: 77-82. DOI:10.1016/0960-8524(91)90101-O |
Hanon T P, Tsao G T. 1972. Kinetic studies of the lactic acid fermentation in batch and continuous cultures. Biotechnology and Bioengineering, 14: 233-252. DOI:10.1002/bit.260140207 |
Hogsett D A, Ahn H J, Bernardez D, et al. 1992. Direct microbial conversion: Prospects, progress and obstcle. Applied Biochemistry and Biotechnology, 34: 527-541. |
Holtzapple M T, Humphrey A E, Taylor J D. 1989. Energy requirements for the size reduction of poplar and aspenwood. Biotechnology and Bioengineering, 33: 207-210. DOI:10.1002/bit.260330210 |
Jeffrey W J, Deschatelets L, Nishikawa N K. 1989. Comparative fermentability of enzymatic and acid hydrolysates of steam-pretreated aspenwood hemicellulose by Pichia stipitis CBS5776. Applied Microbiology and Biotechnology, 31: 592-596. |
Kim S Y, Kim J H, Oh D H. 1987. Improvement of xylitol production by controlling oxygen supply in Candida parapsilosis. Journal of Fermentation and Bioengineering, 83: 260-270. |
Kubicek C P, Messner R, Gruber F, et al. 1993. The Trichoderma cellulase regulatory puzzle: from the interior life of a secretory fungus. Enzyme and Microbiol Technology, 15(2): 90-99. DOI:10.1016/0141-0229(93)90030-6 |
Lee P C, Lee W G, Lee S Y, et al. 2000. Fermentative production of succinic acid from glucose and corn steep liquor by Anaerbiospirillum succiniciproducens. Biotechnology Bioprocess Engineering, 5: 379-381. DOI:10.1007/BF02942216 |
Lee P C, Lee S Y, Hong S H, et al. 2003. Biological conversion of wood hydrolysate to succinic acid by Anaerbiospirillum succiniciproducens. Biotechnology Letters, 25: 111-114. DOI:10.1023/A:1021907116361 |
Mackie K L, Brownell H H, West K L, et al. 1985. Effect of sulphur dioxide and sulphur acid on steam explosion of aspen wood. Journal of Wood Chemistry and Technology, 5(3): 405-425. DOI:10.1080/02773818508085202 |
Mario Lello, Gino Corsini, Luis F, et al. 2000. Characterization of three new manganese peroxidase genes from the ligninloytic basidiom ycete Ceriporriopsis subvermispora. Biochemica.Et Biophysica Acta, 1490: 137-144. DOI:10.1016/S0167-4781(99)00227-4 |
Michael H G, Alic M. 1993. Molecular biology of the lignin-degrading Basidiomycete Phanerochaete chrysosporium. Microbiol Rev, 57(3): 605-622. |
Moldes A B, Alonao J L, Parajo J C. 1999. Cogeneration of cellobiose and glucose from pretreated wood and bioconversion to lactic acid:a kinetic sturdy. Journal of Bioscience and Bioengineering, 87(6): 787-792. DOI:10.1016/S1389-1723(99)80154-6 |
Murray W D, Asther M. 1984. Ethanol fermentation of hexose and pentose woood sugars produced by hydrogen-fluoride solvolysis of aspen chips. Biotechnology Letters, 6(5): 323-326. DOI:10.1007/BF00129063 |
Nguyen Q A, Saddler J N. 1991. An intergrated model for the technical and economic evaluation of an enzymatic biomass conversion process. Bioresource Technology, 35: 275-282. DOI:10.1016/0960-8524(91)90125-4 |
Oh D K, Kim S Y. 1998. Increase of xylitol yield by feeding xylose and glucose in Candida tropicalis. Applied Microbiology Biotechnology, 60: 419-425. |
Ong E, Pollock W B R, Smith M. 1997. Cloning and sequence analysis of two laccase complementary DNAs from the ligninolytic basidiom ycete Trametes versicolor. Gene, 196(1): 113-119. |
Parajo J C, Dominguez H, Dominguez J M. 1996a. Production of xylitol from concentrated wood hydrolysates by Debaryomyces hansensii: effect of the initial cell concentration. Biotechnology Letters, 18(5): 593-598. DOI:10.1007/BF00140209 |
Parajo J C, Alonso J L, Santos V. 1996b. Lactic acid from wood. Process Biochemistry, 31(3): 271-280. DOI:10.1016/0032-9592(95)00059-3 |
Parajo J C, Dominguez H, Domingguez J M. 1998. Biotechnological production of xylitol. Part 2: Operation in culture media made with commercial sugars. Bioresource Technology, 65: 203-212. DOI:10.1016/S0960-8524(98)00036-4 |
Pierre Beguin. 1992. Bacterial cellulase. Biochemical Society Transactions, 20(1): 42-46. |
Preziosi_Belloy L, Nolleau V, Navarro J M. 2000. Xylitol production from aspenwood hemicellulose hydrolysate by Candida guilliermondii. Biotechnology Letters, 22: 239-243. DOI:10.1023/A:1005688919428 |
Rayner A D M, Boddy L. 1988. Fungal communities in the decay of wood. Advances in Microbial Ecology, 10: 115-166. |
Rodriguez Vazquez Refugio and Diaz_Cervantes Dolores. 1994. Effect of chemical solutions sprayed on sugarcane bagasse pith to production single cell protein: physical and chemical analyses of pith. Bioresource Technology, 47: 159-164. DOI:10.1016/0960-8524(94)90115-5 |
Singhal V, Rathore V S. 2001. Effects of Zn2+ and Cu2+ on growth, lignin degradation and ligninolytic enzymes in Phanerochete chrysosporium. World Journal of Microbiology & Biotechnology, 17: 235-240. |
Thomas M W. 1985. Properties of cellulolytic enzyme systems. Biochemical Society Transactions, 13(3): 407-410. |
Thomas M W. 1992. Fungal cellulases. Biochemcal Society Transactions,, 20(1): 46-53. DOI:10.1042/bst0200046 |
Thompson N. S. 1983. Wood and agricultural residues. New York: Academic Press, 101-119.
|
Tsao G T, Ladish M R, Voloch M, et al. 1982. Production of ethnol and chemicals from cellulosic materials. Process Biochemistry, 17(1): 34-38. |
Vilas Boas S G, Esposito E, Margarida Matos de Mendonca. 2002. Novel lignocellulolytic ability of Candida utilis during solid-substrate cultivation on apple pomance. World Journal of Microbiology & Biotechnology, 18: 541-545. |
Wicklow D T, Langie R, Crabtree S, et al. 1984. Degradation of lignocellulose in wheat straw versus hrdwood by cyathus and related species(Nidulariaceae). Canadian Journal of Microbiology, 30: 632-636. DOI:10.1139/m84-093 |
Wright J D. 1998. Ethnol from biomass by enzymatic hydrolysis. Chemistry Engineering Progress, 84(8): 62-74. |
Zhao Xin, Gao Peiji. 1993. Acceleration of ethnol production from paper-mill waste fiber by supplementation with beta_glucosidase. Enzyme and Microbiol Technology, 15: 62-65. DOI:10.1016/0141-0229(93)90117-K |
Yasuhiko Asada, Akira W, Toshikazu L, et al. 1995. Structure of genomic and complementary DNAs coding for Pleurotus ostreatus Manganese(Ⅱ)peroxidase. Biochimica et Biophysica Acta, 1251: 205-209. DOI:10.1016/0167-4838(95)00102-Z |
 2006, Vol. 42
2006, Vol. 42
