文章信息
- 曹挥, 刘素琪, 赵莉蔺, 李向花, 师光禄.
- Cao Hui, Liu Suqi, Zhao Lilin, Li Xianghua, Shi Guanglu.
- 万寿菊提取物对山楂叶螨的触杀活性及酶活性的比较
- The Toxicities and the Effects on Several Enzyme Systems of the Extracts of Tateges erecta against Tetranychus viennensis
- 林业科学, 2006, 42(2): 125-128.
- Scientia Silvae Sinicae, 2006, 42(2): 125-128.
-
文章历史
- 收稿日期:2004-03-08
-
作者相关文章
2. 北京市农业应用新技术重点实验室 北京 102206;
3. 中国科学院动物研究所 北京 100080
2. Key Laboratory of New Technology of Agricultural Application of Beijing Beijing 102206;
3. Institute of Zoology, Chinese Academy of Sciences Beijing 100080
万寿菊(Tateges erecta)为1年生草本,是分布于许多国家的观赏性植物,在我国已有千年的栽培历史,也是近年来研究较多的杀虫植物之一。万寿菊享有同印楝(Azadirachta indica)、川楝(Melia toosendan)、烟草(Nicotiana tibacum)、鱼藤(Derris trifoliata)同样的地位,成为从2 400种已记载控害植物中挑选出来的43种广谱控害植物之一,被誉为“控害的精华”(Grainge et al., 1988)。
万寿菊对昆虫的活性主要体现在蚊幼虫,其有效成分α-三连噻吩对埃及伊蚊(Aedes. aegypt)、伊蚊(A. atropalpus)、白纹伊蚊(A. albopictus)等均有良好的光活化活性(乐海洋等,1988;Arnason et al., 1981; Singh et al. 1987)。此外,已发现它的根提物在自然光和紫外光照射下对农业害虫谷蠹(Rhyropertha dominica)、赤拟谷盗(Tribolium castaneum)、烟草夜蛾(Manduca sexta)、小菜蛾(Plutella xylostella)等均有较好的光活化活性(Morallo-Rejesus, 1987;Philogene et al., 1985;崔德君等,1998),在非光照条件下,也有一定的生物活性(Isman, 1994)。
山楂叶螨(Tetranychus viennensis)为北方果树上的重要害螨,由于其自身的繁殖特点及化学农药的不当使用,导致其抗药性增强,危害日趋严重。近年来的研究中发现,万寿菊的提取物对其有很好的生物活性(曹挥等,2003;王鸿雷等,2003)。本试验以山楂叶螨为研究对象,探索了在非光照和光照射条件下,万寿菊不同溶剂的根提取物对山楂叶螨触杀活性及体内几种酶活性的影响,为其在有害生物综合治理中的深入开发和利用提供科学依据。
1 材料与方法 1.1 材料万寿菊采自山西太谷,试螨采自山西农业大学果园,试验期间禁止施药。
1.2 方法1) 活性物质的提取 将采集到的万寿菊置于50 ℃下烘干,用电动粉碎机粉碎过60目筛。准确称取3份5 g干粉,用滤纸包好后置于索氏提取仪中,分别以甲醇、氯仿、石油醚(均为分析纯)3种溶剂各100 mL,80 ℃连续抽提10 h,将所得溶液浓缩至浸膏状备用;另称取5 g干粉,用水作溶剂温浸提取,温度为50 ℃。
2) 生物活性测试 将万寿菊提取物按不同比例制成一定的浓度梯度,采用玻片法,进行生测。将1 cm宽的双面胶带纸贴在载玻片一端,选取大小一致的健康雌成螨,用零号毛笔将其背面向下成两行固定在胶带纸上,于解剖镜下剔除死螨及不活泼螨后,保证每一载玻片上有成螨20头。然后将其置于不同浓度药液中5 s后取出,用滤纸轻轻吸干多余药液。每一浓度设重复3次,对照为体积分数3%的乙醇溶液。处理后的试螨于非光照和自然光照射条件下于不同时间观察死亡情况。
3) 蛋白酶活性测定 以酪蛋白为底物测定(慕立义,1991)。酶液制备:分别于非光照处理4、8、12、16、20、24 h和光照处理0.5、1、1.5、2 h取成螨100头,加0.25 mL生理盐水冰浴中匀浆,于4 ℃下10 000 r·min-1离心15 min,取上清液备用。蛋白含量测定:取酶液0.1 mL加0.3 mL生理盐水与Follin-酚甲液2 mL混匀静置10 min后再加Follin-酚乙液0.2 mL摇匀,在30 ℃水浴中反应30 min后于500 nm波长处比色,测定O D值。蛋白酶活性测定:取制备好的酶液0.05 mL,在37 ℃水浴中预热3~5 min,加入预热到37 ℃的酪蛋白溶液1 mL,混匀后于37 ℃水浴中加热15 min,加入3 mL体积分数为10%的三氯乙酸,混合后离心。取上清液1 mL,加5 mL 0.5mol.L-1碳酸钠,1 mL Follin-酚试剂,在37 ℃水浴中显色15 min,用分光光度计于680 nm波长处测光密度值。从绘制好的标准曲线上查出对应的酪氨酸微克数,确定酶活力大小。
4) 谷胱甘肽-S-转移酶活性测试 酶液制备、蛋白含量测定同上(慕立义,1991)。GSTs酶活性测试:将66 mmol·L-1磷酸缓冲液2.5 mL、50 mmol·L-1 GSH 0.2 mL、0.03 mol·L-1 CDNB 0.05 mL迅速混匀作为对比,将以上试剂再加0.1 m L制备好的酶液作为试样,在27℃下置于uv-300型分光光度计340 nm处,测定5 min内OD值变化。
5) 酯酶同工酶 用聚丙烯酰胺凝胶电泳法测定(陈长琨,1993)。
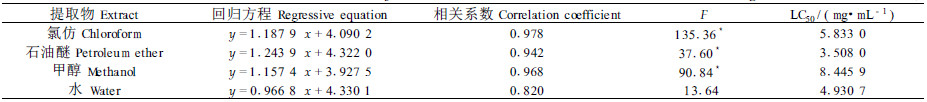
2 试验结果 2.1 万寿菊提取物对山楂叶螨的生物活性从表 1、2可看出,在非光照条件下,万寿菊氯仿提取物有一定的杀螨活性,但从LC50值来看,杀螨效果不明显;其他提取物经F检测,差异不显著,表明毒力方程不真实;在光照下,万寿菊的氯仿、石油醚、甲醇提取物均表现出光活化杀虫活性,其LC50分别为5.833 0、3.508 0和8.445 9 mg·mL-1,并且在光照条件下,经氯仿和石油醚提取物处理0.5~1 h,试螨出现暂时昏迷现象,用毛笔尖轻触虫体, 大部分无反应,随时间延长而逐渐苏醒, 接触有反应的个体增多, 2 h后出现死亡个体。由于万寿菊氯仿提取物在光照和非光照条件下均对山楂叶螨有生物活性, 因此选取它进行作用机理的研究。
|
|
|
|
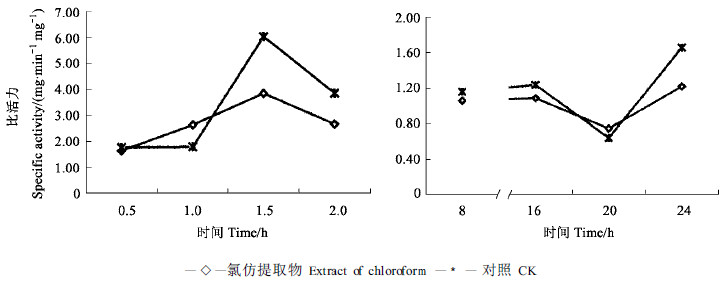
从图 1看出,在非光照处理24 h的过程中,处理组与对照组试螨的蛋白酶活性变化趋势基本相同,都是在处理后16 h出现下降,20 h后有所上升,从比活力值来看,除在处理的20 h左右,处理组稍大于对照组外,其余时间均小于对照组。而在光照处理的2 h中,2组试螨的蛋白酶活性均表现出先上升后下降的趋势,在处理1.5 h左右,处理组试螨的蛋白酶活性明显小于对照组,蛋白酶活性受到了抑制。蛋白酶是生物体内重要的消化酶之一,它的活性受到抑制,会影响生物对食物的正常消化和吸收。
|
图 1 光照(左)和非光照(右)条件下万寿菊氯仿提取物触杀处理对山楂叶螨蛋白酶活性的影响 Fig. 1 The protease activities of Tetranychus viennensis contacted with the chloroform extracts of Tateges erecta in photic group (left) and in dark group (right) |
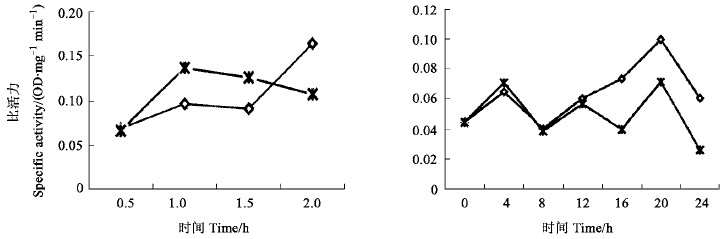
谷胱甘肽-S-转移酶是螨类体内最活跃的解毒酶系之一,它能催化有毒的亲电化合物与内源性的还原型谷胱甘肽发生共轭反应,进行解毒代谢。用万寿菊氯仿提取物进行不同处理的试螨,其体内谷胱甘肽-S-转移酶也有不同的变化。从图 2可以看出,非光照条件下,处理组与对照组的谷胱甘肽-S-转移酶活力变化趋势基本一致,在处理的前8 h,二者的比活力值无明显变化,在8 h以后,处理组的酶活性开始明显上升,并且在12 h后上升较快,于20 h达到最高点,此时对照组的比活力值是处理组的70%。而在光照处理的过程中,处理组的试螨在处理的0~1.5 h,比活力值明显小于对照组,其中在处理1 h时,处理组的比活力值是对照组的66%,试螨体内的谷胱甘肽-S-转移酶活性受到一定程度的抑制。这表明万寿菊氯仿提取物中可能存在着对谷胱甘肽-S-转移酶有抑制作用的光活化物质。
|
图 2 光照(左)和非光照(右)条件下万寿菊氯仿提取物触杀处理对山楂叶螨GSTs酶活性的影响 Fig. 2 The glutathiona S-transferase activities of Tetranychus viennensis contacted with the chloroform extracts of Tateges erecta in photic group(left) and in dark group (right) |
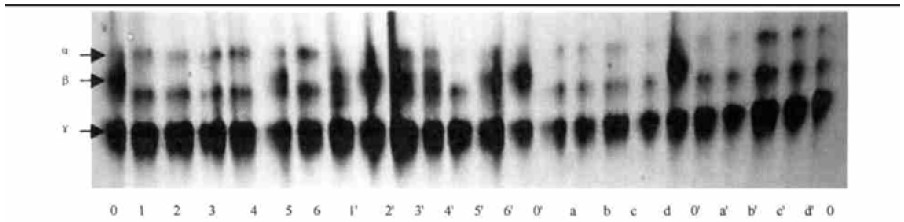
酯酶是生物体内另一类重要的解毒酶系,它可以通过水解杀虫剂中所含的酯键来进行解毒代谢。从图 3酯酶的凝胶电泳图谱中可以明显地看到有3条酯酶酶带:α、β、γ,在这3条酶带的变化中,α和β带的变化较均大,用万寿菊氯仿提取物处理后的试螨无论在光照条件下还是在非光照条件下,处理组酯酶酶带的颜色和大小与对照相比均较弱,光照条件下,这种变化尤为明显,与非光照条件相比,酶带减弱的幅度较大;而γ带的变化在光照和非光照条件下不太明显。当外源有毒物质进入生物体内时,会激活酯酶进行解毒代谢,其活性的升高往往是害虫产生抗药性的标志之一,而当其活性受到抑制时,会导致生物体内有毒物质进行积累,产生中毒作用,从而引起死亡。从本试验的结果来看,处理组酯酶酶带颜色和粗度的减弱,可能与其活性受到一定抑制有关。
|
图 3 万寿菊氯仿提取物触杀处理对山楂叶螨酯酶同工酶活性影响 Fig. 3 Effects on the activities of esterase isozyme of Tetranychus viennensis contacted with chloroform extracts 1—6和1′—6′分别为氯仿提取物和对照组触杀处理山楂叶螨4、8、12、16、20、24 h后酯酶活性变化。a—d和a′—d′分别为氯仿提取物和对照组光照处理0.5、1、1.5、2 h后酯酶活性变化。0为新鲜虫体对照,0′为处理后立即供试虫体。 1′-6′, 1-6, a′-d′, a-d, and 0′ represent effects on the esterase isozyme a ctivities of CK and Tetranychus viennensis contacted with chloroform extracts after 4, 8, 12, 16, 20, 24 h(non-light); after 0.5, 1, 1.5, 2 h(light) and tested immediately after treated respectively. 0 is mites not treated. |
万寿菊是一种高效的杀虫植物,尤其是它的光活化活性。从本研究的生测结果可以看出,万寿菊的氯仿、甲醇、石油醚提取物均含有光活化活性成分,具有很好的杀螨活性,并对山楂叶螨有暂时麻痹的作用。同时它的氯仿提取物中还含有不依赖于光的活性物质,也有较好的杀螨活性。
通过万寿菊氯仿提取物对山楂叶螨体内几种酶系的影响发现,蛋白酶、谷胱甘肽-S-转移酶的活性在光照条件下比非光照条件下要高,可能是由于螨类个体微小,体色较深,吸收热量后加强体内代谢的结果;但从处理组与对照组的酶活性比较来看,万寿菊氯仿提取物在光照条件下,处理组与对照组相比,蛋白酶、谷胱甘肽-S-转移酶的活性受到一定程度的抑制,并且酯酶酶带颜色和粗度减弱;而在非光照条件下,处理组的蛋白酶活性变化不明显,谷胱甘肽-S-转移酶的活性增加,而酯酶酶带受到一定程度的抑制。
水解和轭合是生物解毒代谢的重要方式,由一系列酶系催化完成(张宗炳等, 1989)。酯酶和谷胱甘肽-S-转移酶便是普遍存在于生物体内最重要的两种解毒酶系。谷胱甘肽-S-转移酶能催化生物体内的还原型谷胱甘肽(GSH)与外源化合物的亲电子基团发生轭合,最终形成硫醚氨酸排出体外,其活性的升高可作为动物组织损伤的敏感指标(沈同等, 1990;深见顺一, 1994)。酯酶具有广泛的底物专一性和重迭性,在杀虫药剂代谢中不需额外能量即可催化酯类化合物水解(宗静等, 2000;吴青君等, 1998)。这种高效的解毒代谢体系在生物体与外界不良环境因子的适应过程中很可能发挥重要作用。从本试验结果来看,光照条件下,处理组这两种酶活性受到抑制可能会影响山楂叶螨的正常解毒代谢,从而导致有毒物质在螨体内积累,引起死亡。而谷胱甘肽-S-转移酶活性的升高,可能是由于万寿菊氯仿提取物中含有的有毒物质在其体内的增多,使它增强解毒代谢所致。
从本研究可以看出,万寿菊氯仿提取物对山楂叶螨的生物活性主要属于光活化活性,在万寿菊中主要的光活化物质为α-三噻吩,但由于螨类的生物学在很多方面有别于昆虫,因此其主要杀螨有效成分,仍需进一步的分离。另外,从黑暗条件下各项处理的指标来看,万寿菊氯仿提取物中可能也存在着不依赖于光活化活性的其他活性物质,有待今后进一步深入分析研究。
曹挥, 刘素琪, 王鸿雷, 等. 2003. 万寿菊提取物对山楂叶螨几种酶活性的影响. 林业科学, 39(2): 114-118. DOI:10.3321/j.issn:1001-7488.2003.02.019 |
陈长琨主编. 1993.昆虫生理生化实验.北京: 中国农业出版社
|
崔德君, 赵善欢, 刘新清. 1998. 万寿菊粗提物对小菜蛾产卵忌避作用的研究. 农药, 37(6): 31-35. |
慕立义主编. 1991.植物化学保护方法.北京: 中国农业出版社
|
深见顺一. 1994. 农药实验法——杀虫剂篇. 北京: 中国农业出版社, 251-262.
|
沈同, 王镜岩. 1990. 生物化学:下册. 北京: 高等教育出版社, 283-285.
|
王鸿雷, 刘素琪, 丁起盛. 2003. 光暗条件下万寿菊提取物对山楂叶螨酯酶活性的抑制作用. 林业科学, 39(2): 109-113. DOI:10.3321/j.issn:1001-7488.2003.02.018 |
吴青君, 朱国仁, 赵建周, 等. 1998. 小菜蛾对定虫隆的抗性生化机制初探. 昆虫学报, 41(Suppl): 42-47. |
乐海洋, 赵善欢. 1998. 万寿菊提取物对白纹伊蚊幼虫的光活化活性及有效成分研究. 华南农业大学学报, 19(2): 8-12. |
张宗炳, 樊德方, 钱学范, 等. 1989. 杀虫药剂的环境毒理学. 北京: 中国农业出版社, 8-12.
|
宗静, 张帆, 孙光芝, 等. 2000. 繁殖寄主对赤眼蜂羧酸酯酶和乙酰胆碱酯酶的影响. 昆虫学报, 43(Suppl): 70-76. |
Arnason T S, Wat G K, Graham E A, et al. 1981. Mosquito larvicidal activity of polyacetylenes from species in the Asteraceae. Biochemical Systematics and Ecology, 9(1): 63-68. DOI:10.1016/0305-1978(81)90061-2 |
Grainge M, Ahmed S. 1988. Handbook of plants with pest control properties. New York: John Wiley & Sons INC: 292. |
Isman M B. 1994. Botanical insecticides and antifeedants: new sources and perspectives. Pesticide Research Journal, 6(1): 11-19. |
Morallo-Rejesus B. 1987. Botanical pest control reserch in the Philippines. Philipp Entomol, 7(1): 1-30. |
Philogene B J R, Arnason J T, Berg C W, et al. 1985. Synthetic and evalution of naturally occurring phototoxin, alpha-terthienyl, as a control agent for lavae of Aedesintrudens, A.atropalpus(Diptera:Culicidae) and Simulium verecundum(Diptera:Simuliidae). J Econ Entomol, 78: 121-126. DOI:10.1093/jee/78.1.121 |
Singh S P, Sharma P, Vats L K. 1987. Light-dependent toxicity of the extract of plant Tagetes erecta and alpha-terthienyl toward larvae of mosquito Culex trutaeniorhynchus. Toxicol Environ Chem, 16(1): 81-88. DOI:10.1080/02772248709357251 |
 2006, Vol. 42
2006, Vol. 42