文章信息
- 田国忠, 李永, 朱水芳, 贾瑞祥, 王慧敏.
- Tian Guozhong, Li Yong, Zhu Shuifang, Jia Ruixiang, Wang Huimin.
- 我国木本植物致病性土壤杆菌的分子检测和比较鉴定
- Molecular Detection and Identification of Pathogenic Agrobacterium spp. Isolates Associated with Woody Plant Crown Gall Diseases in China
- 林业科学, 2006, 42(2): 63-72.
- Scientia Silvae Sinicae, 2006, 42(2): 63-72.
-
文章历史
- 收稿日期:2003-12-31
-
作者相关文章
2. 中国检验检疫科学研究院动植物检疫研究所 北京 100029;
3. 中国农业大学植物病理系 北京 100094
2. Institute of Animal and Plant Quarantine, CAIQ Beijing 100029;
3. Department of Plant Pathology, China Agricultural University Beijing 100094
土壤杆菌属(Agrobacterium)中的代表种类根癌土壤杆菌(Agrobacterium tumefaciens)引起植物根癌病,是一种世界性的植物根部病害,可以使植物产生肿瘤等症状,严重影响植物的生长发育,甚至引起生长衰退和死亡,为我国重要森林植物检疫对象(林业部野生动物和植物保护司,1990)。该病菌寄主范围广,为害杨树(Populus)、柳树(Salix)、枣树(Zizyphus jujuba)、桃(Prunus persica)、苹果(Malus)、梨(Pyrus)、葡萄(Vitis)、杏(Prunus)、木瓜(Chaenoneles sinensis)、板栗(Castanea mollissima)、胡桃(Juglans)、月季(Rosa)、樱花(Prunus yedoensis)等93个科、640余种双子叶植物和裸子植物(游积峰等,1985; 任欣正等,1990; 张静娟等,1988; 倪大炜等,1999; 孙艳丽等,2000)。近些年来,随着林业生产发展、造林规模加大、国内外引种和种苗调运频率的增加,出现了林木、花卉和果树根癌病传播加速和蔓延的趋势。
由于该病害的防治难度大,如何快速准确地检测和鉴定致病菌、了解病菌在土壤中的分布、动态变化以及在植物体内的存在部位和含量,对于种苗检疫、病害预测预报和针对性地制订防治对策都具有重要意义。我国开展的病菌鉴定方法主要包括病组织或土壤分离培养、接种指示植物测定致病性、生理生化指标测定其生物型及SDS-PAGE和血清学鉴定等(李英等,1987;孙艳丽等,2000)。近些年来,国外已有用PCR技术和探针技术检测和鉴定致病性根癌土壤杆菌的研究报道(Dong et al., 1992; Cubero et al., 1999; Haas et al., 1995; Sawada et al., 1995; 1993;Burr et al., 1990; Kaufmann et al., 1996; Schultz et al., 1993; Sadowska et al., 1996)。作者根据Ti质粒上与致病性相关的基因的保守序列设计并合成了2对特异性引物,对我国不同来源的土壤杆菌菌株进行了比较研究; 从北京及河北的杨树苗圃和桃园内分离鉴定出了致病性菌株; 从而建立了PCR和探针杂交相结合鉴别致病性土壤杆菌的有效、准确、快速的方法。同时,用制备的基因探针探讨了泡桐丛枝病植原体及其他病原细菌是否存在类似细胞分裂素相关的基因的问题。
1 材料与方法 1.1 根癌土壤杆菌、其他细菌及植原体根癌土壤杆菌株包括杨树根癌土壤杆菌株(来源于中国林业微生物菌种保藏管理中心,CFCC1001)——能引发杨树及其他木本植物根瘤和茎瘤(张锡津, 1980;张静娟等, 1988); 桃树根癌土壤杆菌(来自于中国普通微生物菌种保藏管理中心,AT1 1640)(李英等,1987),分离自桃树、樱花、苹果、葡萄等植物上,致病菌株分别编号为MG10-1、MG11-1、K308、K27、CY4、MB286-A、MB286-B和G11(2)(由中国农业大学植物病理系细菌室提供); 发根土壤杆菌(A. rhizogenes)(来自中国农业微生物菌种保藏管理中心,ACCC10060);非致病菌株放线土壤杆菌(A. radiobacter)(来自中国普通微生物菌种保藏管理中心,CGMCC1150);剔除致瘤基因的土壤杆菌工程菌株AT-GUS和AT-TH(由中国农业科学研究院生物技术研究所李汝刚博士惠赠)。丁香假单胞菌(Pseudomonas syringae)(由本室晁龙军提供); 感染植原体的泡桐丛枝病组织培养苗及用杨树根癌土壤杆菌转化的泡桐遗传转化瘤组织AT-ZH(田国忠等, 2001)。
1.2 田间采集样品、病菌分离培养和致病性测定分别于1999年11月和2002年4月11日2次在北京玉渊潭公园樱花园取样,包括患病樱花根癌瘤及土样; 中国农科院南路成年绿化毛白杨行道树患病株基部肿瘤组织及土样; 2002年5月从河北廊坊市白家务乡王小寨村一桃园和北京通州区台湖镇田家府村84K杨苗圃内取瘤组织及土样。
采用培养皿稀释分离法和平板划线分离法从病瘤组织和土壤中分离培养细菌(方中达,1998)。将接种培养皿放在28 ℃恒温培养箱中培养48 h,挑取具有菌落特征的菌落转移到斜面培养。所选用培养基包括PDA、YEM(酵母膏甘露糖醇培养基)和Kado(甘露糖醇培养基)。
以番茄(Lycopersicum esculentum)和泡桐(Paulownia sp.)组培苗作细菌接种材料。番茄盆载苗接种方法按常规细菌接种方法(方中达,1998)。用泡桐组培苗伤口涂菌接种按田国忠等(2001)的方法。
1.3 细菌和植物瘤组织模板DNA提取刮取约1 mm2菌斑, 放入0.5 mL的Eppendorf管中, 加入100 μL细菌DNA抽提液(20 mmol·L-1 Tris-Cl, pH8.0, 1 mmol·L-1 EDTA, 1 mmol·L-1 NaCl, 0.5%Triton X-100),100 ℃、处理2 min,冰浴2 min,10 000 r·min-1离心1~2 min,取上清液作为细菌模板DNA备用(Tian et al., 2000)。植物瘤组织DNA提取方法按标准CTAB法(田国忠等,2001)。
泡桐丛枝病植原体的提纯和DNA的抽提按田国忠等(1996)方法。
1.4 ipt和VirD2基因片段扩增引物的设计和PCR根据Barker等(1983)对Agrobacterium tumefaciens菌株(章鱼碱型Ti质粒pTi15955) T-DNA的序列测定结果和Haas等(1995)的研究, 设计并合成了1对扩增T-DNA上异戊烯基转移酶基因(ipt)基因片段的引物CYT:5′-GAT CGG GTC CAA TGC TGT-3′(8867-8884), CYT′: 5′-GAT ATC CAT CGA TCT CTT-3′(9298-9276)。VirD2引物是根据A. tumefaciens Ti质粒的致病区VirD2保守序列设计的引物,VirD2A为:5 ′-ATG CCC GAT CGA GCT CAA GT-3′, VirD2E为:5′-CCT GAC CCA AAC ATC TCG ACT GCC CA-3′(Haas et al., 1995)。
PCR反应体系(50 μL): 1~5 μL模板DNA,1 μL 10 mmol·L-1 dNTP,5 μL10×PCR buffer,1~4 μL引物(浓度达0.4 μmol·L-1),加重蒸馏水(DDW)至50 μL,加30~50 μL矿物油,88 ℃, 10 min后加1 U TagDNA酶。扩增条件:94 ℃,45 s; 52 ℃, 80 s; 72 ℃, 90 s。扩增30~35个循环,然后72 ℃,10 min。
1.5 ipt基因片段克隆和序列测定经过对ipt基因引物磷酸化、PCR扩增、产物pGEM-3zf(+/-)平端连接、感受态大肠杆菌热击转化, 然后培养并挑取阳性白色单菌落、PCR筛选鉴定阳性克隆等步骤获得阳性克隆菌株,送Takama公司(大连)进行序列测定。
1.6 ipt基因cRNA探针制备和DNA-cRNA探针杂交将纯化质粒DNA进行单酶切和双酶切鉴定, 然后将经EcoRⅠ单酶切的目的质粒DNA进一步纯化获得线状质粒DNA, 制备地高辛标记cRNA探针。探针合成反应体系(20 μL)为:2 μL线性化质粒DNA(EcoRⅠ酶切),4 μL 5×转录缓冲液,2 μL 100 mmol·L-1 DTT,1 μL rRNa3Sin(20 U),2 μL 4 mmol·L-1 NTP混合物(含地高辛标记-dUTP),2 μL SP6 RNA多聚酶(Promeaga公司),7 μL DDW,37 ℃,温育2 h。然后用加2.5 μL 4 mol·L-1 LiCl和75 μL预冷乙醇纯化探针,加100 μL灭菌DDW溶解,并加1 μL RNase抑制剂, 于-20 ℃保存备用。
点杂交(dot blot)时先将DNA样品用3 mol·L-1 NaOH变性处理,60 ℃,1 h,然后加20×SSC,用灭菌DDW系列按1:2、1:4、1:8、1:16、1:32系列稀释DNA变性样品后,点样于尼龙膜(hybond-N+,amersham)上,120 ℃烘烤30 min固定核酸; 在杂交管中加入预杂交液(5×SSC,50%甲酰胺,0.1%SLS,0.02%SDS,20%封闭剂)于48 ℃预杂交1 h; 然后加入5~10 μL ipt-cRNA探针,48 ℃滚动杂交过夜(14 h以上),然后用2×SSC洗膜2次、0.5×SSC洗膜2次,每次15 min; 加封闭剂后于摇床上摇动1 h; 在封闭剂中加入6 μL地高辛标记的碱性磷酸酯酶Anti-Dig-AP(Boehringer Mannbeim和Roche公司试剂盒),室温反应1~2 h,其他操作按试剂盒说明书进行。采用底物CSPD(1,2-二氧杂环丁烷-磷酸盐取代物)发光法(Boehringer Mannbeim试剂盒)或用碱性磷酸酯酶底物NBT/BCIP直接显色(Roche试剂盒)。
进行northern blot时,先将DNA样品用1%琼脂糖凝胶电泳分离,然后将凝胶变性处理、尼龙膜毛细管转移过夜(18 h以上)。尼龙膜核酸固定、杂交步骤同点杂交。
2 结果与分析 2.1 致病性土壤杆菌不同菌株的PCR检测、鉴定和比较鉴别结果用CYT/CYT′引物对,可从引起多种木本植物根癌病的土壤杆菌(除M G11-1株系外)中扩增出427 bp的DNA片段,而不能从发根土壤杆菌、线土壤杆菌、丁香假单胞细菌和泡桐丛枝病植原体扩增出此特异性片段。从葡萄上分离的土壤杆菌株菌株G11(2)也未能扩增出此片段(表 1, 图 1)。已人工剔除了T-DNA的致瘤性基因的土壤杆菌工程菌株AT-GUS和AT-TH也不能扩增出此特异性片段。在AT-T35瘤组织中也能扩增出427 bp特异片段。
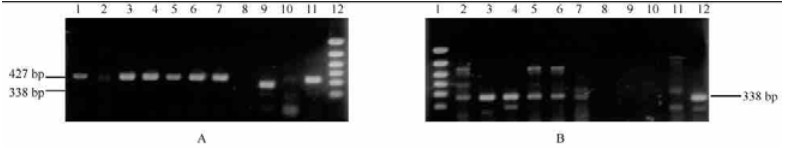
|
图 1 不同来源土壤杆菌的PCR检测结果 Fig. 1 PCR results of Agrobacterium spp. from different sources A:1. MG10-1; 2. MG11-1; 3. K308; 4.K27; 5. CY4; 6. MB286-A; 7. MB286-B; 8. G11 (2); 9. MG10-1; 10. MG11-1; 11. AT1 1640; 1—8、11:ipt引物Primer ipt; 9、10:VirD2引物Primer VirD2;12. PCR分子量标准PCR marker. B:1.PCR分子量标准PCR marker; 2. K308; 3. K27; 4. CY4; 5. MB286-A; 6.G11(2); 7. C85-028D-phytoplasma; 8. T35-028; 9、10:清水对照Water control; 11. AT1 1640; 2-12:VirD2引物Primer VirD2. |
|
|
用VirD2引物对,除可从根癌土壤杆菌(除MG11-1株系外)中扩增出预期的338 bp片段外,发根土壤杆菌、AT-GUS和AT-TH也可扩增出此片段。说明这些菌株在Ti质粒上皆存在与侵染性相关的VirD2区域。在遗传转化的泡桐瘤组织DNA中不能扩增出此片段,也证明此片段未被转移整合到泡桐染色体上。
上述结果充分验证了427 bpPCR产物是与细胞分裂素合成相关的根癌土壤杆菌Ti质粒的可转移T-DNA上的异戊烯基腺苷转移酶基因序列,为土壤杆菌致瘤所必需区域;而338 bpDNA片段则存在于Ti和Ri 质粒上的与T-DNA或R-DNA加工和毒性相关的非转移区域(Zambryski et al., 1989; Steck et al., 1990)。引发毛根症状的A.rhizogenes仅能用 VirD2引物扩增出338 bp的片段而不能用ipt引物扩增出427 bp片断,而放线土壤杆菌为植物非致病菌,所以用此两对引物都不能扩增出特异片段。由此可见,根据这两组引物的PCR结果即可以将致病土壤杆菌种与非致病种加以有效地比较鉴别。
不能扩增出427 bp片段的根癌土壤杆菌, 像MG11-1株系, 推断很可能是在连续继代培养过程中发生了质粒或质粒致病性相关区域的缺失或突变。这有待于对此菌株致病性变化的进一步测定。在AT-T35瘤组织中只能扩增出427 bp特异片段而不能扩增出338 bp的片段,也能支持此推论(Steck et al., 1990; Zambryski et al., 1989)。
2.2 田间采集病组织和土壤分离细菌PCR鉴定结果从北京玉渊潭公园樱花园、北京通州84K杨苗圃等地植物的根部或根茎部产生的肿瘤组织中分离到具有土壤杆菌特征的单菌落分离物共34株,从根围土壤中共分离菌株36株。对这些菌株进行PCR鉴定结果显示(表 1,图 2):有11个菌落具有典型的A. tumefaciens特征,即用ipt引物扩增出427 bp的产物,同时也能用VirD2引物扩增出338 bp的片段。用PDA-YEM-Kada选择培养程序,从河北廊坊桃园和北京通州84K杨树苗圃获得的菌落被鉴定为根癌土壤杆菌的比率最高。而从北京玉渊潭公园樱花树根围土壤2次(1999年8月和2002年4月)取样分离的菌落中,经PCR均未鉴定出具有明确致病特性的根癌土壤杆菌菌株。
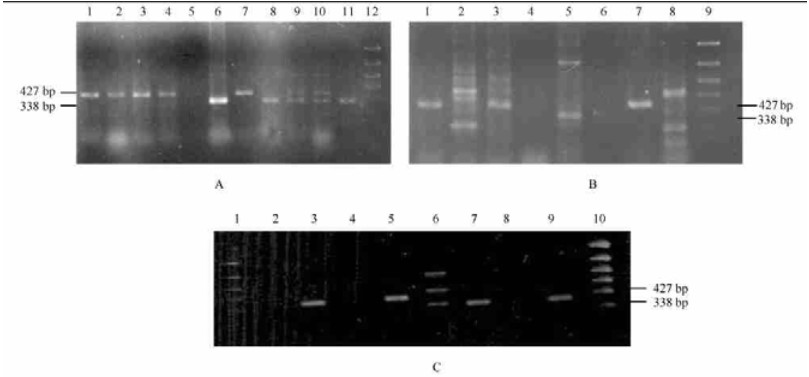
|
图 2 田间分离培养菌株的PCR检测结果 Fig. 2 PCR identification of A. tumefaciens strains isolated from field collected gall tissues and soil A:植物冠瘿组织DNA的PCR结果PCR results of plant crown gall tissues DNA 1.AT-ZH; 2. MD1#;3. TD1#;4. MD4#;5. ARH; 6. MD2#;7. MD2#;8. MD3#;9. TD2#;10. TD5#;11. ARH; 1~5,7:ipt引物Primer ipt; 其余为Vir D2引物Others,primer VirD2.12.DNA分子量标准PCR marker. B:从土壤中分离的细菌菌落的PCR结果PCR results of bacterial DNA isolated from soil 1. AT-ZH. 2.河北廊坊杨树地1号Poplar land No.1 from Langfang, Hebei Province. 3.河北廊坊桃地3号(2YK) Peach land No.3 from Langfang, Hebei Province. 4.河北廊坊杨树地2号(2K) Poplar land No.2 from Langfang, Hebei Province. 5.河北廊坊桃地2号(2YK)Peach land No.2 from Langfang, Hebei Province. 6.北京通州84K杨树地1号(2K) 84K poplar land No.1 from Tongzhou, Beijing. 7.北京通州84K杨树地2号.84K poplar land No.2 from Tongzhou, Beijing. 8. A.rhizogenes. 9. AT11640.10. DNA分子量标准PCR Marker. 1~4, 6, 9:ipt引物primer ipt; 其余为Vir D2引物Others,primer VirD2. C.樱花根癌病的PCR结果PCR results of Yoshino cherry crown gall 1、10. DNA分子量标准PCR marker; 2、4.瘤组织DNA Gall tissue DNA; 5. K308; 6. AT1 1640; 7.清水对照Water control; 8. AT-poplar; 9. A.rhizogenes. |
从北京玉渊潭采来的一批樱花冠瘿组织和从农科院南路杨树冠瘿样品的检测结果全部为阴性,这至少推断瘤组织内未有致病根癌土壤杆菌或浓度很低。有趣的是,用VirD2引物对采自玉渊潭公园樱花园病树的另一批瘤组织样品总DNA进行PCR,扩增出338 bp片段,但用CYT/CYT′引物对却未扩增出427 bp片段。这意味着可能存在A. rhizogenes菌株或产生 A. tumefaciens菌株的ipt基因缺失菌株。有研究也发现过1株非致病的A. radiobacter菌株含有VirD2序列但无ipt基因序列, 并认为是由致病性土壤杆菌的T-DNA缺失造成的(Haas et al., 1995; Fortin et al., 1992)。本试验所检测到的菌株也可能为此类丧失致瘤特性的突变体(Iacobellis et al., 1994; Belanger et al., 1995)。用经PCR鉴定为根癌土壤杆菌菌株的TD1,对泡桐组培苗在伤口处接种,可产生肿瘤,从而证实了其致病特性。而将从玉渊潭公园分离菌株YHTJ1、YHTJ2、YHTJ3接种到番茄苗上,经过9 d发现番茄茎上产生了小毛根,而用发根番茄苗提取DNA为模板的PCR却未检测到427、338 bp片段,进一步支持了玉渊潭公园分离到的菌株多不具有致瘤性的判断。
2.3 杨树根癌土壤杆菌ipt基因片段克隆和测序结果将杨树根癌土壤杆菌菌株(CFCC1001)扩增出的427 bp片段克隆到质粒载体pGEM-3zf(+/-)上,然后转化感受态的大肠杆菌DH5α菌株。经PCR鉴定, 从18个阳性克隆菌落中筛选出了3个含427 bp片段的阳性克隆,pGEM-1#、pGEM-5#和pGEM-7#,分别对阳性克隆质粒DNA进行EcoRⅠ/HindⅢ限制性内切酶切分析,确认了pGEM-7#含有427 bp片段(图 3)。将pGEM-7#送Takama公司测序,将所测序列与A. tumefaciens Ti15955株的ipt基因的相应区域序列比较显示(图 4),其核苷酸残基数目完全相同,未发生缺失或插入现象,二者的序列同源性为83.64%(Barker et al., 1983)。
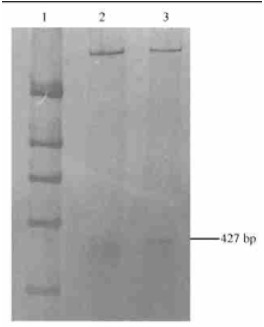
|
图 3 杨树根癌土壤杆菌株(CFCC1001)ipt基因片断克隆质粒的限制性酶切分析(PAGE和银染色) Fig. 3 The restriction endoenzyme analysis of the cloned plasmid with ipt genefragment from poplar crown gall strain(PAGE and silver staining) 1.PCR分子量标准PCR marker; 2.用EcoRⅠ/HindⅢ双酶切pGEM-3zf空质粒Digestion of uncloned pGEM-3zf with EcoRⅠ/HindⅢ; 3.含ipt基因克隆的pGEM-3zf的EcoRⅠ/HindⅢ双酶切, 箭头示427 bp酶切片段Digestion of cloned pGEM-3zf with EcoRⅠ/HindⅢ, arrow points to 427 bp fragment. |

|
图 4 杨树根癌土壤杆菌ipt基因片段与根癌土壤杆菌Ti质粒pTi15955的ipt基因相应区域的序列比较 Fig. 4 Comparison of sequences of ipt gene fragment cloned from poplar crown gall A.tumefaciens with the correspondent region of Ti15955 A.tumefaciens a:杨树根癌农杆菌株系质粒克隆的ipt基因片段Cloned ipt gene fragment from crown gall AT of poplar; b:章鱼碱型Ti质粒pTi15955的ipt基因片段, 下划线指示引物序列pTi15955 of A.tumefaciens opine strain. Underlines indicate the sequences of the primers. |
用克隆的含ipt基因427 bp片段的纯化质粒经EcoRⅠ单酶切后,分别进行转录试验和制备地高辛标记的cRNA探针。点杂交和northern blot杂交结果显示,此探针与克隆的阳性菌株和杨树根癌土壤杆菌总DNA、克隆大肠杆菌质粒DNA及克隆菌株的PCR产物皆有强杂交信号(图 5),从而证明了所扩增产物为ipt目的基因片段。
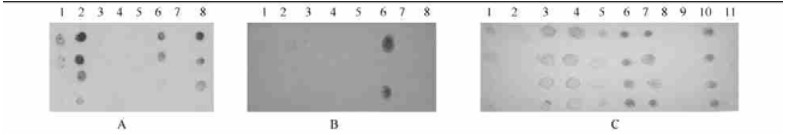
|
图 5 点杂交结果 Fig. 5 Dot hybridization results A:克隆大肠杆菌杂交结果Hybridization results of cloned E.coli.1.含克隆ipt片段的质粒DNA样品Plasmid DNA horboring cloned ipt gene fragment; 2—8.不同阳性克隆菌落PCR扩增产物杂交结果PCR products of different colonies; DNA稀释梯度为1:2,1:4, 1:8, 1:16DNA dilution, 1:2,1:4, 1:8, 1:16.底物CSPD发光法检测到的杂交信号Substrate CSPD method for detecting hybridization signal.B, C:不同菌株PCR产物的杂交结果Hybridization results of different strains of Agrobacterium spp.B:1.AT-GUS-H-580;2.AT-CFCC1001-h; 3.A.rhizogens-h; 4.AT-GUS-v; 5.AT-TH-v; 6.AR-v; 7.AT-CFXX1001-ipt; 8.K308-v.C:1.MG10-1-ipt; 2.MG11-1-ipt; 3.K308-ipt; 4.K27-ipt; 5.CY4-ipt; 6.MB286-A-ipt; 7.MB286-A-ipt; 8.G11(2)-ipt; 9.清水对照Water control; 10.AT11640-ipt; 11.AT11640-v; 其中h, ipt,v分别代表用Harpin, ipt,VirD2基因引物扩增产物h, ipt,v represent the PCR products using primerHarpin, ipt and VirD2 respectively.NBT/BCIP显色反应Staining reaction with NBT/BCIP. |
用木本植物上分离的根癌土壤杆菌的PCR产物与ipt探针进行点杂交分析,结果显示(图 6):此探针与所有扩增出427 bp片段的不同根癌土壤杆菌菌株都有阳性杂交信号,与其他类细菌无杂交信号。说明ipt基因片段在致病性菌株间的同源性很高。因此,采用此探针进行cRNA-DNA杂交,可以进一步鉴定根癌土壤杆菌中ipt基因的存在和确证其致病性。采用CSPD发光法和NBT/BCIP显色法所检测到的杂交信号无明显的差异,都可很好地检测到阳性杂交结果。但从理论上说,HBT/BCIP显色法检测同源核酸的灵敏度可达0.1 pg水平,而CSPP发光法的检测灵敏度要比显色法还要高出3倍以上。
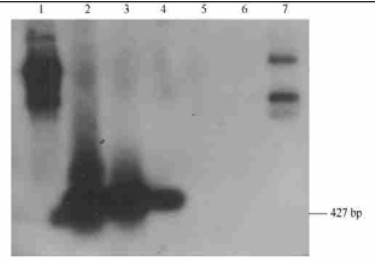
|
图 6 用ipt基因cRNA探针与不同来源DNA进行的northern blot杂交结果 Fig. 6 Northern blot of DNA with cRNA probe of ipt gene from A.tumefaciens associated with polar stem gall disease in China 1.克隆菌株质粒DNA The cloned plasmid pGEM-3zf inserted with ipt gene fragment; 2.杨树根癌土壤杆菌ipt基因克隆质粒pGEM-3zf(+/-)PCR扩增产物Product of amplified plasmid DNA of pGEM-3zf containing ipt gene fragment of A.tumefacians; 3.杨树根癌土壤杆菌转化的泡桐瘤组织AT-ZH DNA的ipt引物扩增产物Amplified DNA of transformed paulownia tumor tissues(AT-ZH)by poplar AT; 4.杨树根癌土壤杆菌PCR扩增产物PCR product of poplar AT; 5.泡桐病组织ZD总DNA Total DNA of paulownia ZD tissues infected with phytoplasmas; 6.泡桐健组织ZH总DNA Total DNA of healthy paulownia ZH tissues; 7.含ipt 427 bp片段的纯化质粒pGEM-3zf(+/-)Purified pGEM-3zf horboring ipt 427 bp gene fragment. |
对提取的感染植原体的泡桐总DNA和从纯化的植原体中抽提的染色质和染色质外DNA,用1%琼脂糖电泳,然后转移到尼龙膜上,用ipt基因探针进行northern blot杂交, 结果此探针与泡桐丛枝植原体NDA未有任何明显的阳性杂交信号出现。说明植原体基因组和染色质外DNA中可能不存在类似根癌土壤杆菌T-DNA的ipt类细胞分裂素合成基因或同源序列。
3 讨论由于致病根癌土壤杆菌、发根土壤杆菌与非致病放线土壤杆菌等在培养性状、理化特性上近似,通常要通过生物学接种方法才能最终确定其致病特性。用向日葵、番茄等幼苗接种至获得结果一般需要1~2周的时间,接种试验也会造成病菌在试验室、温室或大田的污染或病菌潜在人为传播。本研究用PCR结合探针杂交技术,成功地快速鉴定致瘤性根癌土壤杆菌、鉴别诱发植物土壤杆菌及区分非致病的放线土壤杆菌。通过探针杂交进一步验证和提高PCR结果的可靠性也是口岸及苗木检疫的必需技术环节。从田间样品采集到初步的PCR鉴定能在2~4 d内完成。如果直接从瘤组织抽提DNA进行PCR,则可将鉴定时间缩短为1~2 d。在病区或发病苗圃商业化调运种苗过程中,发病苗木或发病瘤组织已被人为淘汰,但苗木被病菌污染或感染的几率仍很高,病害潜在传播的危险性也会更大。由于非瘤组织内病菌含量极低,造成常规的症状诊断、分离培养和接种鉴定病菌技术的准确性和应用范围受到很大的限制,或出现漏检问题。而PCR的高灵敏度和特异性,加上选择性培养基的利用,可以克服常规方法的不足,做到对低浓度病菌的准确快速检测和鉴定。这在口岸和国内苗木检疫、流行学调查、培养菌株的致瘤能力和致病性变异监测等方面具有很大的应用潜力和价值,也为下一步研制适用于大量样本快速检测试剂盒或开发基因芯片技术奠定了必要基础(Sawada et al., 1993; 1995;Dong et al., 1992; Cubero et al., 1999)。笔者将尝试用此技术与BIOLOG自动快速微生物鉴定仪(MicrostationTM)结合用于土壤杆菌属的快速准确鉴定、鉴别研究和应用。
河北廊坊白家务乡王小寨村桃园1999年从辽宁引进4 000余株桃苗,至2000年发现病树花芽发育不正常、果实不能成熟或提前脱落,枝条修剪时发现木质部变色,挖根后才发现根瘤症状。至调查时全园内桃树发病率很高,严重区病株率达100%。本试验通过分子鉴定方法确证了根癌土壤杆菌已成为该果园土壤内的优势致病种群。虽然调运种苗时并未对苗木原产地发病情况和苗木的带菌状况进行调查和检疫处理,但推断病菌从此苗木原产地传入该园的可能性极大。本试验从桃园附近的群众杨(小美旱杨)(Populus×Xiaozhuanica cv. ‘popularis')成年林土壤内也分离鉴定出根癌土壤杆菌,但在群众杨林内未有根癌病树。有资料显示,群众杨为我国20世纪80年代选育鉴定的一种杂交杨品种,其母本为青杨派的河南小叶杨(P. simonii),黑杨派的美国钻天杨(P. pyramidalis)和旱柳(Salix matsudana)为混合父本(赵天锡等,1994)。已知白杨派杨树品种对根癌病最感病,青杨和黑杨派对此病的抗性较强(向玉英,1987),因而推断群众杨可能对此病害有强的抗性而不被此病菌感染,或虽被侵染,但未表现明显的根癌症状。也有报道指出,杨树对根癌病的抗性与其对细胞分裂素的敏感程度有相关性,能耐受更高浓度的细胞分裂素(BA)处理的品种对根癌病的抗性也强(Beneddra et al.,1996)。当然,也不排除后来由桃园内的病菌通过土壤或流水传入杨树林内,在没有损伤的情况下病菌未能侵染杨树而发病的可能性。
关于未能从北京玉渊潭公园樱花园病树根瘤上或病树根围土中分离到致病根癌或发根土壤杆菌菌株的问题值得进一步分析。该园自1972年接受日本赠送樱花品种开始,即出现根癌病的危害。根据有关资料分析判断,虽然当时已将从日本引进的明显表现“根头癌肿病”症状的苗木或瘤组织进行了淘汰和销毁,但受当时我国检疫技术条件和水平等方面的局限,根癌土壤杆菌仍可以附着在受污染的种苗和土壤而传入我全国的各樱花引种区1)。针对此病害,该公园曾采取了多年连续施用抗根癌生防菌剂处理患病苗木和土壤防治病害的措施2)。很可能非致病生防菌剂的连年施用造成了此类微生物菌群的大量繁殖,取代或抑制了致病的根癌土壤杆菌的活动而成为园中根围土壤的优势种群。所以从该地所分离到的具有土壤杆菌培养特征的菌株可能以非致病的生防菌株为主(张静娟等, 1988; 王慧敏等,1998)。有时从该园中分离到的个别菌落也扩增出比典型致病菌株比如CFCC1001、AT11640等弱的427 bp的带,此时即使增加模板DNA浓度和提高检测灵敏度,这些菌株也未能扩增出与阳性对照菌株一致强度的特异谱带。这类弱带的出现可能与土壤或植物瘤组织上存在痕量已部分降解的致病性土壤杆菌DNA污染有关。即使分离到活的目标菌,其繁殖也受到培养基优势生防菌的强烈抑制。多年施用生防菌防治致病性土壤杆菌对微生物区系变化的影响到底有多大尚待深入探讨(Burr et al., 1990; Johnson et al.,1990; Belanger et al., 1995; Lopez et al., 1989)。
1) 陶玲珠, 王一君. 1981.从日本来带有病虫的樱花树苗的处理经过.植物检疫参考资料
2) 许晓波,马玉,王燕.2000.樱花根癌病发生规律和控制措施.交流材料
土壤杆菌属以下种的分类一直存在以致病性为依据和以生理生化性状及其他特征为依据的不同分类方案。其中根癌土壤杆菌是最早被确定的种类。在此种以下进一步根据生理生化特性分成3个生物型(biotype),即Ⅰ、Ⅱ和Ⅲ型。现在普遍接受土壤杆菌属包括了4个与植物病害有关的致病种,即根癌土壤杆菌(A. tumefaciens,原生物型Ⅰ)、发根土壤杆菌(A. rhizogenes,原生物型Ⅱ)、葡萄土壤杆菌(A. vitis,原生物型Ⅲ)和悬钩子土壤杆菌(A. rubi),和一个非致病性种放射土壤杆菌(A. radiobacter)的分类方案(王金生,2000; 王慧敏等, 1998; Sawada et al., 1993; Ophel et al., 1990)。但围绕此属的命名和分类问题仍存在不同观点,今后的分类是否有进一步变动也难有定论(Farrrand et al., 2003; Sawada et al., 1993; Young et al., 2001; 2003)。按本研究仍采用的致病性划分标准,发根土壤杆菌应不含有ipt基因而不能扩增出427 bp片段,与Haas等(1995)的研究结果一致。但按生物型归种标准,中国农业大学分离鉴定的属于不同生物型的根癌土壤杆菌按新的标准将MG10-1、MG11-1、CY4归为根癌土壤杆菌,K27为发根土壤杆菌(生物型Ⅱ),K308、MB286-A、MB286-B和G11(2)为葡萄土壤杆菌(生物型Ⅲ)3个种(Ophel et al., 1990)。从本试验的结果看,K27应该属于引致根癌的土壤杆菌类型。从葡萄上分离鉴定的葡萄土壤杆菌多为窄寄主菌株,象G11(2)常出现因质粒基因缺失检测不到ipt基因片段的情况也属于正常(Haas et al., 1995; Burr et al., 1990)。所以按新的种类划分标准,质粒特性在种类划分上的作用会降低, 只能作为种以下不同致病型的划分依据。
由于根癌土壤杆菌侵入植物组织后将T-DNA整合到植物组织中,因而用以CYT/CYT'引物PCR扩增整合到瘤组织细胞染色体DNA上的427 bp基因片段是鉴定和鉴别遗传转化瘤和非遗传转化瘤重要依据,也是区分由线虫、虫瘿、机械损伤、根瘤菌等引致类似肿瘤组织的良好途径。当田间采集的瘤组织提取的DNA模板同时扩增出427和338 bp两个片段时,则至少说明瘤组织上存在致病性土壤杆菌。从本实验结果来看,PCR足以检测到瘤组织中少量的致病菌,并且有可能直接从土壤中抽提和浓缩DNA用于PCR检测,而不必经过菌落培养步骤(Haas et al ., 1995)。这也是环境DNA和土壤微生物DNA研究的重要途径之一。
已知油橄榄肿枝病菌(Pseudomonas syringae pathovar savastanoi)在其质粒上也具有类似ipt基因(ptz),且与根癌土壤杆菌的tzs位点推导的氨基酸有50%序列同源性(Iacobellis et al., 1994)。本次所制备的cRNA探针是否与此病菌、棒杆菌(Corynebacterium fascians)及其他具有细胞分裂素合成能力的植物病原细菌或真菌有杂交信号尚待进一步试验研究(Powell et al., 1986; Morris, 1986)。因而,ipt-CRNA探针可以用于从其他微生物中克隆类似细胞分裂素的基因,已有的研究已证明固氮根瘤菌(Rhizobium sp.)中与细胞分裂素合成相关基因icr与tzs和ptz基因无同源性(Taller et al., 1991)。
已报道的从根癌土壤杆菌株上克隆的功能ipt基因的序列分别约为1 221 bp(pTi37)、990 bp(pHCkn312)和1 700 bp(AcH5)(Ainley et al., 1993; Thomas et al., 1995; McKenzie et al., 1994),从杨树根癌土壤杆菌上克隆的片段的序列与已报道的根癌土壤杆菌的同源性较高,其探针与其他木本植物上分离的致病性土壤杆菌的杂交结果也进一步表明不同菌株间的同源性都很高。虽然植原体也同为原核生物,并有报道存在染色质外类似质粒的DNA结构,病菌能引起泡桐等众多植物丛枝症状,因而推断植原体可能存在类似根癌土壤杆菌的细胞分裂素基因。但从以前和本试验进行的PCR和探针杂交结果判断,在植原体染色质和染色质外DNA上未检测到与根癌土壤杆菌同源性序列,故推断植原体不存在与根癌土壤杆菌类似的ipt基因结构,或根本无任何自主的细胞分裂素合成能力(田国忠等,2001)。所以,植原体的生长和繁殖所需要的某些物质特别是激素类物质的代谢过程尚不清楚。
方中达. 1998. 植病研究法. 3版. 北京: 中国农业出版社.
|
李英, 王均. 1987. 致癌土壤杆菌K-8菌株的分离和几株致癌土壤杆菌的初步鉴定. 云南植物研究, 4(1): 83-87. |
林业部野生动物和森林植物保护司. 1990. 森林植物检疫对象和检疫技术. 长春: 吉林科学出版社.
|
倪大炜, 张炳欣, 沈杰. 1999. 日本樱花根癌病病原菌的鉴定及其防治. 微生物学通报, 26(1): 11-14. |
任欣正, 罗灿辉, 方中达. 1990. 根癌土壤杆菌新生物种的鉴定. 植物病理学报, 20(3): 195-200. |
孙艳丽, 王慧敏, 王建辉. 2000. 苹果根癌病菌系及生物防治的初步研究. 植物病理学报, 30(4): 11. |
田国忠.1999.泡桐丛枝病植原体与泡桐的生化和分子互作研究.中国农业大学博士学位论文 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y301695
|
田国忠, 张锡津, 朱水芳, 等. 1996. 间接免疫荧光显微术检测泡桐丛枝病原MLO的研究. 林业科学研究, 9(1): 1-6. |
田国忠, 朱水芳, 罗飞, 等. 2001. 根癌农杆菌对感染植原体的泡桐组培苗症状的影响. 林业科学研究, 14(3): 258-261. DOI:10.3321/j.issn:1001-1498.2001.03.004 |
王慧敏, 李健强, 隋新华, 等. 1998. 玫瑰根癌病原及其敏感的生防菌. 中国农业大学学报, 3(增刊): 83-87. |
王金生主编. 2000.植物病原细菌学.北京:中国农业出版社, 81-87
|
向玉英. 1987. 杨树病虫害及其防治. 北京: 中国林业出版社, 81-84.
|
游积峰, 马德钦, 相望年, 等. 1985. 葡萄根癌杆菌的不同生化型对葡萄及其它植物致病性的初步研究. 植物病理学报, 15(2): 73-79. |
张静娟, 周娟, 相望年. 1988. 中国毛白杨根癌土壤杆菌的类型和对土壤杆菌素敏感性的研究. 微生物学报, 28(1): 12-18. |
张锡津. 1980. 杨树根癌病的病原鉴定. 林业科技通讯, (3): 22-24. |
赵天锡, 陈章水主编. 1994.中国杨树集约栽培.北京:中国科学技术出版社, 391-399
|
Ainley W M, McNeil K J, Hill J W, et al. 1993. Regulatable endogenous production of cytokinins up to toxic levels in transgenic plants and plant tissues. Plant Mol Biol, 22: 13-23. DOI:10.1007/BF00038992 |
Barker R F, Idler K B, Thompson D V, et al. 1983. Nucleotide sequence of the T-DNA region from Agrobacterium tumefaciens octopine Ti plasmid pTi15955. Plant Mol Biol, 13: 335-350. |
Belanger C, Canfield M L, Moore L W, et al. 1995. Genetic analysis of nonpathogenic Agrobacterium tumefaciens mutants arising in crown gall tumors. J Bacteriol, 177(13): 3752-3757. DOI:10.1128/jb.177.13.3752-3757.1995 |
Beneddra T, Picard C, Petit A, et al. 1996. Corrrelation between susceptibility to crown gall and sensitivity to cytokinin in aspen cultivars. Phytopathol, 86: 225-231. DOI:10.1094/Phyto-86-225 |
Burr T J, Norelli J T, Katz B H. 1990. Use of Ti-plasmid DNA probes for determining tumorigenicity of Agrobacterium strains. Appl Envion Microbiol, 56: 1782-1785. |
Cubero J, Martinz M C, Liop P, et al. 1999. A simple and efficient PCR method for the detection of Agrobacterium tumefaciens in plant tumors. Journal of Applied Microbiology, 86: 591-602. DOI:10.1046/j.1365-2672.1999.00700.x |
Dong L C, Sun C W, Thies K L. 1992. Use of PCR to detect pathogenic strains of Agrobacterium. Phytopathol, 82: 434-439. DOI:10.1094/Phyto-82-434 |
Farrand S K, van Berkum P B, Oger P. 2003. Agrobacterium is a definable genus of the family Rhizobiaceae. Int J Syst Evol Microbiol, 53: 1681-1687. DOI:10.1099/ijs.0.02445-0 |
Fortin C E, Nester E W, Dion P. 1992. Growth inhibition and loss of virulence in cultures of Agrobacterium tumefaciens treated with acetosyringae. J Bacteriol, 174: 5676-5685. DOI:10.1128/jb.174.17.5676-5685.1992 |
Hass J H, Moore L W, Remand W, et al. 1995. Universal PCR primers for detection of phytopathogenic Agrobacterium strains. Appl and Environ Microbiol, 30(8): 2879-2884. |
Iacobellis N S, Sisto A, Surico G, et al. 1994. Pathogenicity of Pseudomonas syringae subsp. savastanoi mutants defective in phytohomone production. J Phytopathol, 140: 238-248. |
Johnson K B, DiLeone J A. 1999. Effect of antibiotics on antagonist dose-plant disease response relationships for the biological control of crown gall of tomato and cherry. Phytopathol, 89: 974-980. DOI:10.1094/PHYTO.1999.89.10.974 |
Kaufmann M, Kassemeyer H H, Otten L. 1996. Isolation of Agrobacterium vitis from grapevine propagating material by means of PCR after immunocapture cultivation. Vitis, 35: 151-153. |
Lopez M M, Gorris M T, Saloedo C T, et al. 1989. Evidence of biological control of Agrobacterium tumefaciens sensitive and resistant to agrocin 84 by different Agrobacterium radiobacter strains on stone fruit trees. Appl Environ Microbiol, 55: 741-746. |
McKenzie M J, Jameson P E, Poutlter R T M. 1994. Cloning in ipt gene from Agrogacterium tumafaciens characterization of cytokinins in derivative transgenic plant tissues. Plant Growth Regulation, 14: 217-228. DOI:10.1007/BF00024796 |
Morris R O. 1986. Genes specifying auxin and cytokinin biosynthesis in phytopathogens. Ann Rev Plant Physiol, 37: 509-538. DOI:10.1146/annurev.pp.37.060186.002453 |
Ophel K, Kerr A. 1990. Agrobacterium vitis sp nov. for strains of Agrobacterium biovar 3 form grapevines. Int J Syst Bacteriol, 40: 236-241. |
Powell G K, Morris R O. 1986. Nucleotide sequence and expression of a Pseudomonas savasranoi cytokinin biosynthetic gene: homology with Agrobacterium tumefaciens tmr and tzs loci. Nucleic Acids Res, 14: 2555-2565. DOI:10.1093/nar/14.6.2555 |
Sadowska R M, Buttner C, Landsiedel B. 1996. Comparative studies for the detection of Agrobacterium tumefaciens by polymerase chain reaction, serological methods, SDS-PAGE and selective media. Archives of Phytopathol Plant Protection, 30: 31-40. |
Sawada H, Ieki H, Matuda I. 1995. PCR Detection of Ti and plasmids from phytopathogenic Agrobacterium strains. Appl and Environ Microbiol, 30(2): 828-831. |
Sawada H, Ieki H, Oyaizu H, et al. 1993. Proposal for rejection of Agrobacterium tumefaciens and revised descriptions for the genus Agrobacterium and for Agrobacterium radiobacter and Agrobacterium rhizogenes. Int J Syst Bacteriol, 43: 694-702. DOI:10.1099/00207713-43-4-694 |
Schultz T F, Lorenz D, Eichhorn K W, et al. 1993. Applification of different marker sequences for identification of Agrobacterium vitis strains. Vitis, 32: 583-618. |
Steck T R, Lin T S, Kado C I. 1990. VirD2 gene product from the nopaline plasmid pTiC5 at least two activities required for virulence. Nucleic Acid Res, 18(23): 6953-6958. DOI:10.1093/nar/18.23.6953 |
Taller B J, Sturtevnt D B. 1991. Cytokinin production by Rhizobia//Hennecke H, Verma D P S eds. Advances in molecular genetics of plant microbe interactions. Netheryands: Kluwer Academic Publisher, Vol.1, 215-221
|
Thomas J C, Smigocki A C, Bohner H J. 1995. Light-induced expression of ipt from Agrobacterium fumefaciens results in cytokinin accumulation and osmotic stress symptoms in transgenic tobacco. Plant Mol Biol, 27: 225-235. DOI:10.1007/BF00020179 |
Tian Guozhong, Luo Fei, Wang Huimin, et al. 2000. Detection of phytopathogenic Agrobacterium associated with woody plant crown gall diseases by polymerase chain reaction//Zhou Guanghe and Li Huaifang eds. The Proceedings of the 1st Asian Conference on Plant Pathology. Beijing: China Agricultural Scientech Press, 176
|
Young J M, Kunykendall L D, Martinez-Romero E, et al. 2001. A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allohizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R.rhizogens, R. rubi, R. undicola and R. vitis. Int J Syst Evol Microbiol, 51:89-103
|
Young J M, Kunykendall L D, Martinez-Romero E, et al. 2003. Classification and nomencature of Agrobacterium and Rhizobium-a reply to Farrand et al. Int J Syst Evol Microbiol, 53: 1689-1695. DOI:10.1099/ijs.0.02762-0 |
Zambryski P, Tempe J, Schell J. 1989. Transfer and function of T-DNA genes from Agrobacterium Ti and Ri plasmids in plants. Cell, 56: 193-201. DOI:10.1016/0092-8674(89)90892-1 |
 2006, Vol. 42
2006, Vol. 42

