文章信息
- 李在留, 辉朝茂.
- Li Zailiu, Hui Chaomao.
- 珍稀竹种巨龙竹组织培养研究
- Study on Tissue Culture of Dendrocalamus sinicus
- 林业科学, 2006, 42(2): 43-48.
- Scientia Silvae Sinicae, 2006, 42(2): 43-48.
-
文章历史
- 收稿日期:2004-10-18
-
作者相关文章
2. 西南林学院 昆明 650224
2. Southwest Forestry College Kunming 650224
竹类植物主要分布在发展中国家,受资金、技术等因素制约,组培研究起步较晚。国外始于20世纪60年代(Alexander et al., 1968; Tseng et al., 1975); 80年代,进入系统研究阶段,主要通过诱导愈伤组织分化丛芽或胚状体获取再生小植株,或由愈伤组织进行细胞悬浮培养、原生质体培养(Huang et al., 1983; 1988;1989a;1989b;1990; Mehta et al., 1982; Rao et al., 1985; 1986;Yeh et al., 1986a; 1986b;1987; Hassan et al., 1987); 90年代,竹子组培研究进入了更深一层,主要通过以芽繁芽方式获得再生小植株(Tsay et al., 1990; Saxena, 1990; 1993;Chambers, 1991; Prutpongse et al., 1992; Rout et al., 1994; Chang, 1995; Ramanayake, 1997; Lin et al., 1998; Anil et al., 2002),在组培条件下诱导外植体开花、结实(Nadgauda et al., 1990;1993; 1997; John et al., 1993; 1995)。我国竹类植物组培研究起步更晚,始于20世纪90年代,现已有多篇报道(张光楚,2000; 张光楚等, 1993; 1998;2001;2003;2004;吴益民等,2000; 马艳梅等, 1993; 王光萍等, 2002; 张铁等, 2004)。
巨龙竹(Dendrocalamus sinicus)是世界上秆形最大的工业用材竹种,其秆高可达30 m,直径20~30 cm,具有重要经济价值和广阔开发前景。其自然分布区狭窄、资源量较少,大量试验研究表明采用传统育苗法十分困难,组织培养可解决种苗迫切需求,目前尚无系统研究的文献报道(辉朝茂等, 1999; 2002;2003)。
1 材料与方法 1.1 试验材料及消毒处理以种胚和成年竹茎段为外植体,在云南西盟县采集饱满、污染较轻的种子,共163粒。用2%~2.5%的NaClO溶液消毒15 min,蒸馏水清洗3次,催芽12~16 h。接种前,用0.2% HgCl2溶液消毒30 min,清洗5次。
成年竹茎段分别采自新平、沧源以及西南林学院大棚(引自西盟县),当年萌芽嫩枝与2年生枝条作对比试验。用75%的酒精擦洗2~3次,4 ℃下保存12~24 h,接种前用2% ~2.5%的NaClO溶液与0.2% HgCl2溶液各消毒15 min与20 min。
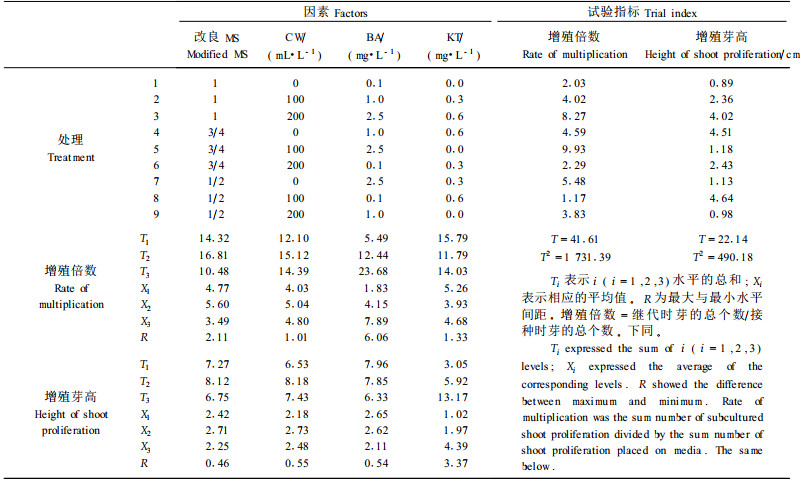
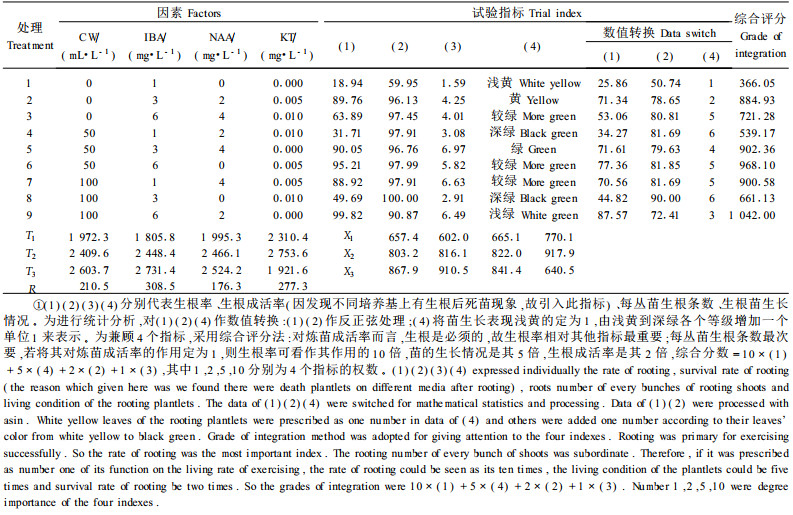
1.2 试验方法 1.2.1 种胚的离体培养1) 培养基及培养条件:采用改良MS、3/4MS和1/2MS作基本培养基,加入不同浓度的细胞分裂素(BA、KT)或生长素(NAA、IBA)及椰乳(CW),外加蔗糖20 g·L-1,琼脂粉6.4 g·L-1。pH值5.8~6.2,温度(25±4)℃,每天辅助光照12 h,光照强度1 600~2 000 lx。2)无性系增殖培养:种子消毒后接种于MS+BA 0.5 mg·L-1培养基上,萌芽至4 cm高时(15~25 d)转接到3/4MS+BA 2.0 mg·L-1+KT 0.5 mg·L-1+CW 100 ml·L-1培养基中诱导丛芽,根据褐化情况进行继代培养,并大量淘汰萌芽慢、生长慢、无法诱导丛芽的无性系。选取增殖芽较正常的无性系进行正交试验,探讨MS、BA、KT、CW用量对苗生长、增殖作用(表 1),并重复试验,筛选最佳增殖培养基。所有正交试验进行3次以上重复,每次供试芽丛不低于30个。3)无性系生根培养:1/2MS培养基,外加生长素NAA和IBA,正交设计试验,筛选最佳生根培养基(表 2)。4)再生小植株炼苗移栽:组培苗根半木质化时,旋松瓶盖,自然散射光下炼苗5~7 d,洗去培养基,植入多种配比的基质中; 与苏麻竹(D. brandisii)作对照,筛选较佳的炼苗基质。
|
|
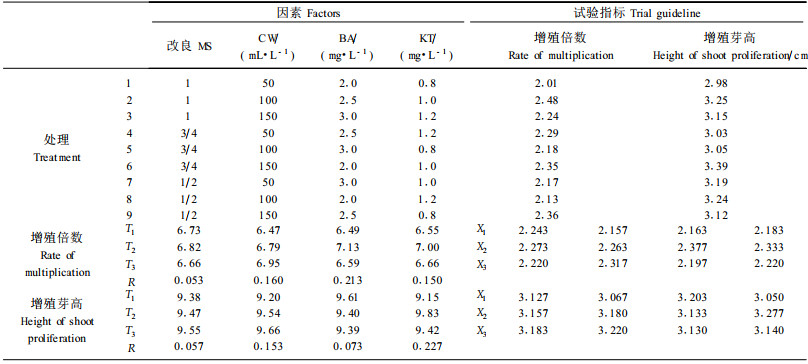
采用1/2MS+BA 3~5 mg·L-1+KT 0.8~1.2 mg·L-1+CW 150 mL·L-1 +蔗糖3%培养基,进行成年竹茎段试管引入、丛芽诱导,探索成年竹组织培养材料采集时间、部位、地点对诱导的影响,并根据丛芽诱导与增殖情况调整各生长调节剂的配比,5~15 d继代一次。
2 结果与分析 2.1 种胚的离体培养 2.1.1 试管引入结果及生长情况163粒种子,4粒污染,7粒未萌芽,无菌种苗得率高达93.25%。继代5~7次后,获得63个能增殖的无性系。
2.1.2 无性系增殖及生根培养基筛选选取增殖倍数较大的23号与增殖倍数适中的49号无性系进行丛芽增殖及生根培养基筛选试验,方案设计、统计与分析参照相关资料(毕庆雨, 1990; 庄楚强等, 2002)。
为获得增殖倍数适中、增殖芽高、生长良好的丛芽,进行了正交试验(表 1)。从表 1可看出,对增殖倍数影响顺序为BA>MS>KT>CW,BA的极差最大,经F检验达到0.1水平,表明它在丛芽增殖诱导中起主导作用,各因素水平的最佳组合为:3/4MS+BA 2.5 mg·L-1+CW 100 mL·L-1; 对增殖芽高度影响顺序为KT>CW>BA>MS,KT的极差最大,经F检验达0.1水平,在丛芽高生长方面起主导作用,各因素水平的最佳组合为:3/4MS+BA 0.1 mg·L-1+KT 0.6 mg·L -1+CW 100 mL·L-1。BA的用量与丛芽增殖倍数成正比,与丛芽高生长成反比; KT对增殖倍数的影响在0~0.3 mg·L-1用量范围内成反比关系,在0.3~0.6 mg ·L -1用量范围内成正比关系,为提高增殖倍数和丛芽高生长,理论上可加大KT用量,但经长期大量试验发现:随着KT用量增加,丛芽生长加快、节间增长,形成畸形芽。BA用量达2.5 mg·L-1时也产生较多畸形芽,且随着继代次数增多,丛芽逐渐矮化,形成花芽,说明BA使丛芽细胞从营养状态向生殖状态转化。逐渐降低BA用量到1.5 mg·L-1,获得增殖倍数为5.23倍,生长良好、性状正常的苗,丛芽高度为4.09 cm,最佳培养基为:3 /4MS+BA 1.5 mg·L-1+KT 0.5 mg·L-1+CW 100 mL·L-1。另外,长期在高浓度BA上培养产生花芽的苗,加大KT用量,可分化出正常的丛芽,即:KT有使细胞从生殖状态向营养状态转化的作用。
无性系增殖到一定数量后进行生根,培养基如表 2。从表 2可看出:4个因素对苗的生根、生长、成活的作用为IBA > KT > CW > NAA,IBA起主导作用,经F检验达到0.1水平。加大IBA、CW、NAA用量,4个指标逐渐变优; 在0~0.005 mg·L-1内加大KT用量,对4个指标产生优化作用,在0.005~0.010 mg·L-1内加大KT用量,对4指标产生抑制作用。综合分析得最佳培养基为:1/2 MS+IBA 6.0 mg·L-1+NAA 2.0 mg·L-1+KT 0.005 mg·L -1+CW 100 mL·L-1。继而加大IBA、CW、NAA用量,4指标无明显增强。长期使用以上配方生根,4指标表现出较稳定的优良性。另外,对IBA与NAA作专门试验,发现加大NAA用量,每丛苗生根数量增多,根细长; NAA用量大于或等于4.0 mg·L-1时,丛芽基部膨大形成愈伤组织,从愈伤组织上产生多条根,再生植株根系发达而茎叶枯黄,炼苗成活率低; 仅用NAA且用量大于或等于7.0 mg·L-1时,再生植株只长根,地上部分枯死; 仅用IBA且用量大于或等于7.0 mg·L-1时,每丛再生植株生根条数少(1~3条),根短、粗、壮,炼苗也难成活,故适量IBA与NAA配合使用有利于丛芽生根和再生植株炼苗成活。
|
|
23号无性系与苏麻竹组培苗进行对比炼苗,采用6种基质(体积比)炼苗:1)100%河砂; 2) 100%珍珠岩; 3)100%蛭石; 4)河砂+珍珠岩(1:1);5)河砂+蛭石(1:1);6)河砂+腐质土(1:1)。每组基质栽种生长情况相同的根半木质化(生根培养基上培养40 d)的小苗50丛。炼苗40 d后,结果为:23号成活率分别为50%、35%、23%、38%、29%、55%;苏麻竹为97%、89%、84%、93%、91%、98%。
从结果看:苏麻竹炼苗比巨龙竹容易,2种苗在有河砂的基质上炼苗成活率较高,在有腐质土的基质上成活率更高,生长更绿、更高、更快,发笋数更多,根系更发达,说明基质6)相对较优,但总体成活率偏低。
为了提高炼苗成活率,采用了多种措施,如:添加多种基质配比(河砂与腐质土以体积比1:1为上层、珍珠岩垫底)对照、改变小植株在培养瓶内的培养时间、水培炼苗、尽可能提高相对温湿度、加强管护等,成活率仍较低。经观察,发现小植株生根数越多,成活率越低,根系从丛芽基部膨大、似愈伤组织物上分化而来,对丛芽生根培养基作多次试验,发现高浓度NAA使丛芽生根前先产生愈伤组织再分化出较多细弱的根,降低NAA用量到2 mg· L-1,并延长小植株在生根培养基上的生长时间(50~60 d),成活率可提高到70%~90%。所有无性系在河砂与腐质土以体积比1:1为上层、珍珠岩垫底的基质上成活率最高,小苗生长最健壮。在长期炼苗试验中,发现在昆明5—8月份是最佳的炼苗时期。
2.2 成年竹茎段培养试验 2.2.1 材料最佳采集时间2002年9、10、11月和2003年3月进行了4次巨龙竹成年竹枝条试管引入试验,每次接种60段。发现成年竹枝条试管引入无污染活体数越来越难获得,丛芽诱导也越来越困难; 2003年5、6、7、8月所引入材料无菌活体得率高达70%以上,丛芽诱导率达60%以上,说明材料在5—8月采集最佳。
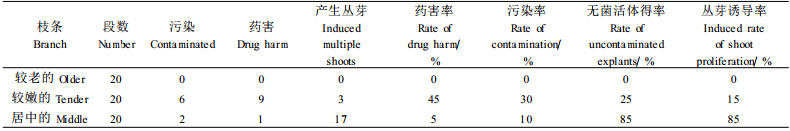
2.2.2 材料最佳部位选取2003年5月引入60段枝条,较老的、较嫩的和居中的分开消毒,考虑到NaClO药性较烈,HgCl2相对温和些,故嫩枝条采用2次HgCl2消毒。消毒情况如表 3。从表 3可看出:枝条过嫩容易受药害,过老难诱导丛芽,且小枝上通常稍部节尚未分化出芽点; 以枝条为外植体诱导丛芽,目的是诱导节上芽点萌芽并产生丛芽。一般半木质化枝上第1、2个节上未分化出芽点,第3个节上开始有芽,但消毒极易受药害而难于诱导成功,且诱导出的丛芽细小,生长不良,多次继代后变黄枯死。过老的节上芽点长期不萌动,极易褐化枯死。只有枝上第4、5个节芽较易诱导萌发,获得无菌材料,并进一步诱导产生丛芽。
|
|
巨龙竹成年竹无菌活体,在1/2MS+BA 3~5 mg·L-1+KT 0.8~1.2 mg·L -1+CW 150 mL·L-1+蔗糖3%的培养基上多次继代培养后,发现不同时期、不同地点采集的材料对BA、KT用量产生不同结果。采用相同培养基分别对采自新平、沧源以及西南林学院大棚(引自西盟县)的材料进行培养,发现新平枝条BA用量在4 mg·L-1以上,KT在1.0~1.5 mg·L-1时可诱导丛芽; 沧源枝条BA在2~3 mg·L-1,KT 0.8~1.0 mg·L-1时产生丛芽; 大棚里的枝条BA 3. 0~3.5 mg·L-1,KT 1.0~1.2 mg·L-1,经继代6~8次产生丛芽。前二者需10~12次继代后才产生细弱丛芽,易褐化,需5~7 d继代一次,生长差,增殖倍数在1.15~1.21。后者10~15 d转移一次,丛芽生长健壮,增殖倍数在1.6~2.5,相对种胚,增殖倍数较低。
2.2.4 成年竹丛芽增殖、生根试验成年竹诱导丛芽后,因产生大量无效苗,而逐渐降低激素用量,当降到BA 2.0 mg·L -1+KT 0.8 mg·L-1时,丛芽增殖倍数、苗生长量显著降低; 对培养基作正交试验,其结果如表 4。从表 4可看出,4因素中,对丛芽增殖倍数影响最大的是BA,BA的极差最大,经 F检验达到0.1水平,表明它在成年竹丛芽诱导增殖阶段起主导作用; 其次是CW,经F检验也达到了0.1水平,4因素作用为BA>CW>KT>MS,各因素水平的最佳组合为:3/4MS+CW 150 mL·L-1+BA 2.5 mg·L-1+KT 1.0 mg·L-1; 4因素中,对丛芽高生长影响为KT>CW>BA>MS,KT的极差最大,经 F检验达0.1水平,为主导因素,其次是CW,各因素水平的最佳组合为:1/2MS+CW150 mL·L-1+BA 2.0 mg·L-1+KT 1.0 mg·L-1。经分析,既适宜提高增殖倍数又利于高生长的最佳培养基为:2/3MS+CW 150 mL·L-1+BA 2.2 mg·L-1+KT 1.0 mg·L-1。
|
|
采用不同培养基进行多次生根试验,生根率均较低,生根后死苗现象严重。目前尚未达到较好效果。
3 结论与讨论通过对巨龙竹幼年竹、成年竹组织培养研究,发现成年竹组培比幼年竹困难,这与张光楚等对麻竹、苏麻竹、杂种撑麻7号竹(Bambusa pervariabilis×Dendrocalamus latiflorus No.7)的研究结果相同(张光楚等, 1993; 2003;2004),难诱导产生丛芽; 丛芽增殖倍数低,难生根; 易褐化、死苗,这是竹类植物进行优质种源快繁难以解决的大问题,有待从基因角度进一步研究。巨龙竹种胚离体培养很成功,组培苗在圃地生长良好,但巨龙竹是世界上秆形最大的竹子,来源于种胚的无性系是否保持母本优良性状,需进行优良无性系的选择(另文报道)。竹子开花、结实少见,巨龙竹开花、结实更难见,通常整丛开花,产生自花传粉,后代生活力和适应性下降,遗传品性单一(Saxena, 1990),传统优良无性系筛选方法时间长、经费高、效率低,若能引入生化或分子水平检验(卓仁英, 2003),可克服以上不足。
竹类植物组培较一般植物困难,接种时间长,成本高,随着继代次数增多,无性系增殖倍数逐渐降低; 丛芽易老化、褐化、黄化。传统分株育苗成本相对较低,无需激素刺激,对小苗的长期分化无较大影响,故可进行实验室组培快繁、田间分株并进,提高育苗效率,降低成本。
根据细胞分裂素BA有促进试管苗开花的作用,可考虑人工促进巨龙竹开花及人工授粉,获取遗传品性较好的种子,用于直接离体培养。
巨龙竹受水热条件限制,分布区狭窄。若能导入抗寒基因,可扩大其适应范围,有利于推广利用。另外,还可进行细胞和原生质体的培养、体细胞杂交、遗传诱导转化及其他的转基因操作,来获取性状更优的突变体或新品种,以便将植物生物技术应用到竹亚科(Bambusoideae)植物中(邢新婷等, 2003; 田波等, 2005),研究提高竹类植物的利用价值。

|
图版Ⅰ Plate Ⅰ |
毕庆雨. 1990. 数理统计. 北京: 中国林业出版社, 204-235.
|
辉朝茂, 杨宇明. 1999. 材用竹资源及其工业化利用. 云南: 云南科技出版社, 7-23.
|
辉朝茂, 杨宇明. 2002. 中国竹子培育和利用手册. 北京: 中国林业出版社, 24-25.
|
辉朝茂, 杨宇明. 2003. 云南竹亚科植物多样性及其保护发展研究. 林业科学, 39(1): 145-152. |
马艳梅, 何远康, 何琼英, 等. 1993. 华南农业大学学报, 14(3): 131-140. |
田波, 陈永燕, 严远鑫, 等. 2005. 一个竹类植物MADS盒基因的克隆及其在拟南芥中的表达. 科学通报, 50(2): 145-151. DOI:10.3321/j.issn:0023-074X.2005.02.008 |
王光萍, 丁雨龙. 2002. 几种观赏竹种组织培养研究. 竹子研究汇刊, 21(2): 5-9. DOI:10.3969/j.issn.1000-6567.2002.02.002 |
吴益民, 边红武, 王君晖, 等. 竹子悬浮细胞系的建立和组织培养试管苗移栽观察. 竹子研究汇刊, 19(1): 52-56. |
邢新婷, 傅懋毅. 2003. 竹类植物遗传改良研究进展. 林业科学研究, 16(3): 358-365. DOI:10.3321/j.issn:1001-1498.2003.03.019 |
张光楚, 王裕霞. 1993. 麻竹离体快速繁殖技术的研究. 竹子研究汇刊, 12(4): 8-15. |
张光楚, 王裕霞. 1998. 竹子育种工作现状及前景. 竹子研究汇刊, 17(1): 6-8. |
张光楚. 2000. 竹子育种工作近况. 竹子研究汇刊, 19(3): 13-15. DOI:10.3969/j.issn.1000-6567.2000.03.005 |
张光楚, 王裕霞. 2001. 竹子试管苗开花的初步研究. 竹子研究汇刊, 20(1): 1-4. DOI:10.3969/j.issn.1000-6567.2001.01.001 |
张光楚, 王裕霞. 2003. 杂种撑麻7号竹的组织培养研究. 林业科学研究, 16(3): 245-253. DOI:10.3321/j.issn:1001-1498.2003.03.001 |
张光楚, 王裕霞, 谭源杰, 等. 2004. 丛生竹的组培快繁技术及其应用. 竹子研究汇刊, 23(1): 13-20. DOI:10.3969/j.issn.1000-6567.2004.01.004 |
张铁, 万京. 2004. 勃氏甜龙竹的组培快繁. 云南民族大学学报, 13(3): 203-206. DOI:10.3969/j.issn.1672-8513.2004.03.013 |
庄楚强, 吴亚森. 2002. 应用数理统计基础. 广州: 华南理工大学出版社, 383-587.
|
卓仁英. 2003. 竹子生物技术育种研究进展. 浙江林学院学报, 20(4): 424-428. DOI:10.3969/j.issn.2095-0756.2003.04.020 |
Alexander M P, Rao T C. 1968. In vitro culture of bamboo embryos. Curr Sci, 37: 415. |
Anil S, Ahuja P S, Madhu S, et al. 2002.In vitro protocols and field performance of elites of an important bamboo Dendrocalamus hamiltonii Nees et Arn. Ex Munro.Plant Cell, Tissue and Organ Culture, 71: 55-63 http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_JJ0212243513
|
Chambers S M, Heuch J H R, Pirrie A. 1991. Micropropagation and in vitro flowering of the bamboo Dendrocalamus hamiltonii Munro. Plant Cell, Tissue and Organ Culture, 27(1): 45-48. DOI:10.1007/BF00048205 |
Chang W C, Lan T H. 1995. Somatic embryogenesis and plant regeneration from roots of Bamboo(Bambusa beecheyana Munro var. beecheyana). Plant Physiol, 145: 535-538. DOI:10.1016/S0176-1617(11)81784-0 |
Hassan A E, Debergh P. 1987. Embryogenesis and plantlet development in the bamboo Phyllostachys viridis (Young) McClure. Plant cell Tissue Organ Culture, 10: 73-77. DOI:10.1007/BF00037499 |
Huang L C, Murashige T. 1983. Tissue culture investigation of bamboo Ⅰ:Callus culture of Bambusa, Phyllostachys and Sasa. Bot Bull Acad Sin, 24: 31-52. |
Huang L C, Chen W L, Huang B L. 1988. Tissue culture investigations of bambooⅡ:Liquid suspension cultures of Bambusa, Phyllostachys and Sasa cells. Bot Bull Acadmia Sinica, 29: 177-182. |
Huang L C, Chen W L, Huang B L. 1989a. Tissue culture investigations of bamboo Ⅲ:A method for viable protoplasts isolation from Bambusa cells of liquid suspention culture. Bot Bull Acadmia Sinica, 30: 49-57. |
Huang L C, Chen W L, Huang B L. 1989b. Tissue culture investigations of bamboo Ⅳ:Organogenesis leading to adventitious shoots and plants in excised shoot apices. Enviromental and Experimental Botany, 29: 307-315. DOI:10.1016/0098-8472(89)90004-X |
Huang L C, Chen W L, Huang B L. 1990. Tissue culture investigation of bamboo Ⅴ:Recovery of callus. Bot Bull Adadmia Sinica, 31: 29-34. |
John C K, Nadgauda R S, Mascarenhas A F. 1993. On the `monocarpic' flowering of bamboos. Curr Sci, 65: 665-666. |
John C K, Nadgauda R S, Mascarenhas A F. 1995. Floral biology and breeding behaviour in Bambusa arundinacer (Retz.) Willd. J Cytol Genet, 30: 101-107. |
Lin C S, Chang W C. 1998. Micropropagation of Bambusa edulis through nodal explants of field grown culms and flowering of regenerated plantlets. Plant Cell Reports, 17: 617-620. DOI:10.1007/s002990050453 |
Mehta U, Rao I V R, Ram H Y M.1982.Somatic embryogenesis in bamboo. In: Proc.V. International Congress of Plant Tissue and Cell Culture. Plant Tissue Culture, Tokyo, Japan, 109-110
|
Nadgauda R S, Parasharami V A, Mascrenhas A F. 1990. Precocious flowering and seeding behaviur in tissue cultured bamboos. Nature, 344: 335-336. DOI:10.1038/344335a0 |
Nadgauda R S, John C K, Mascarenhas A F. 1993. Floral biology and breeding behaviour in the bamboo:Dendrocalamus strictus Nees. Tree Physiol, 13: 401-408. DOI:10.1093/treephys/13.4.401 |
Nadgauda R S, John C K, Parasharami V A, et al. 1997. A comparison of in vitro with in vivo flowering in bamboo:Bambusa arundinacer. Plant Cell, Tissue and Organ Culture, 48: 181-188. DOI:10.1023/A:1005800700024 |
Prutpongse P, Gavinlertvatana P. 1992. In vitro micropropagation of 54 species from 15 genera of bamboo. Hort Science, 27(5): 453-454. DOI:10.21273/HORTSCI.27.5.453 |
Ramanayake SMSD, Yakandawala K. 1997. Micropropagation of the giant bamboo (Dendrocalamus giganteus Munro) from nodal explants of field grown culms. Plant Sci, 129: 213-223. DOI:10.1016/S0168-9452(97)00185-4 |
Rao I U, Rao I V R, Narang V. 1985. Somatic embryogenesis and regeneration of plants in the bamboo Dendrocalamus strictus. Plant Cell Rep, 4: 191-194. DOI:10.1007/BF00269286 |
Rao I V R, Narang V, Rao I U.1986. Origin and development of embryogenic callus and somatic embryos in the bamboo, Dendrocalamus strictus//Ⅳ International Congress of Plant Tissue and Cell Culture. Minneapolis, U.S.A., 134
|
Rout G R, Das P. 1994. Somatic embryogenensis and in vitro culture of 3 species of bamboo. Plant Cell Rep, 13(12): 683-686. |
Saxena. 1990. In vitro propagation of the bamboo (Bambusa tulda Roxb.) through shoot proliferation. Plant Cell Rep, 9: 431-434. |
Saxena S, Bhojwani S S. 1993. In vitro clonal multiplication of four year old plants of the D.longispathus Kurz. In Vitro Cell Dev Biol, 290: 135-142. |
Tsay H S, Yeh C C, Hsu J Y. 1990. Embryogenesis and plant regeneration from anther culture of bamboo (Sinocalamus latiflorus McClure). Plant Cell Rep, 9: 349-351. |
Tseng T C, Liu F, Shaio S Y. 1975. Isolation of protoplasts from crop plants. Bot Bull Acadmia Sinica, 16: 55-60. |
Yeh M L, Chang W C. 1986a. Plant regeneration through somtic embryogenesis in callus culture of green bamboo(Bambusa oldhamii Munro). Theory Appl Genet, 73: 161-163. DOI:10.1007/BF00289269 |
Yeh M L, Chang W C. 1986b. Somtic embryogenesis and subsequent plant regeneration from inflorescence of Bambusa beecheyana Munro var. beecheyyana. Plant Cell Reports, 5: 409-411. DOI:10.1007/BF00269628 |
Yeh M L, Chang W C. 1987. Plant regeneration via somitic embryogenesis in mature embryo derived callus culture of Sinocalamus latiflora (Munro)Mc. Cllure. Plant Science, 51: 93-96. DOI:10.1016/0168-9452(87)90224-X |
 2006, Vol. 42
2006, Vol. 42