文章信息
- 唐明, 陈辉, 高延锋.
- Tang Ming, Chen Hui, Gao Yanfeng.
- 5种林木的11个丛枝菌根菌株分子遗传初步研究
- Preliminary Studies on Molecular Genetic of 11 Strain Arbuscular Mycorrhizal Fungi from 5 Tree Species
- 林业科学, 2006, 42(1): 126-128.
- Scientia Silvae Sinicae, 2006, 42(1): 126-128.
-
文章历史
- 收稿日期:2004-09-20
-
作者相关文章
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)由于不能纯培养,其分子生物学研究起步较晚。Simon等(1992)首次分析了AMF18S核糖体基因,得到了第一条DNA序列,Wyss (1993)用RAPD-PCR技术得到AMF的RAPDs,Sanders等(1995)对AMF群落的孢子进行遗传分析,发现其孢子间存在着rDNA序列的多型现象,Lloyd-MacGilp等1996研究证实了Glomus mosseae种间及其近缘种之间rRNA的ITS基因序列存在多样性。Redecker等(2000)对AMF中的Glomus sinuasum和Sclerocystis coremioides的核糖体18s亚基的系统发育分析,证明这两种丛枝菌根真菌在亲缘关系上非常近缘。国内有关AMF分子生物学研究甚少(Chen et al., 1999),本文对来自不同宿主林木的11个AMF菌株进行RAPD分析,研究AMF的宿主林木对AMF种内及种间遗传多样的影响。
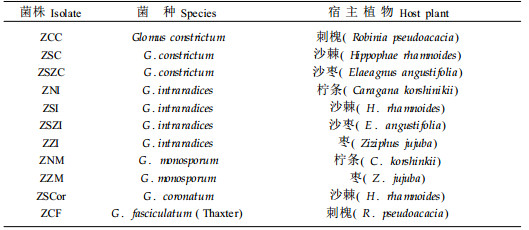
1 材料与方法 1.1 供试菌种在甘肃张掖采集刺槐(Robinia pseudoacacia)、柠条(Caragana korshinskii)、枣(Ziziphus jujuba)、沙棘(Hippophae rhamnoides)和沙枣(Elaeagnus angustifolia)根系及根际土,采用湿筛倾析法(Gerdemann et al., 1963)分离AMF,经白三叶草(Trifolium nepens)为载体进行单孢培养,50d后收集得到纯种AMF孢子(Phillips et al., 1970;李晓林等,2001),包括5种11个菌株,其编号、菌种和宿主林木如表 1。
|
|
选用上海生物工程技术有限服务公司生产的随机引物和DNA Marker,引物编号及序列为S108 (GAAACACCCC),S115(AATGGCGCAG),S118(GAATCGGCCA),S265(GGCGGATAAG),S266 (AGGCCCGATG)。DNA Marker作为分子量标记。
1.3 试验方法1) 模板DNA的提取 DNA的提取参考Wyss的方法(Wyss et al., 1993)并稍加改进,将不同菌株的孢子分别放入0.5 mL的离心管中(每管10个),加入灭菌的双蒸水中,高速离心(12 000 r·min-1)清洗5次,加入30 μL Tris/HCl(pH值为8.0)破解,再加入20 μL 20 % Chelex 100(美国Sigma公司生产)悬浮液搅拌混匀,95 ℃水浴10 min,离心(4 ℃,12 000 r·min-1,10 min),取上清液-20 ℃下保存备用。
2) RAPD引物筛选及扩增体系优化 分别对模板浓度、dNTP浓度、引物浓度和Taq酶浓度设置不同的浓度梯度进行优化,采用25 μL反应体系(灭菌双蒸水11 μL, 10×反应缓冲液(含Mg2+)2.5 μL, dNTP 2.0 μL, 随机引物2.0 μL, Taq DNA聚合酶1.5 μL, 模板DNA 6.0 μL)。通过对30条随机10聚体引物进行PCR反应,根据扩增条带的有无、条带的数量和可重复性、特异性及谱带强弱,选择5个引物用于11个菌株的扩增。
3) PCR扩增程序 PCR扩增程序为94 ℃预变性2.5 min,94 ℃变性30 s,36 ℃退火1 min,72 ℃延伸2 min,反应45个循环后,72 ℃延伸5 min结束反应,4.0 ℃下过夜保存。相同条件下设无模板D NA的扩增反应为对照。扩增产物用含有溴化乙锭的1.5%琼脂糖(西班牙生产)凝胶在1×TBE缓冲液中电泳分离(80 V, 1 h),在紫外灯下摄像记录结果。
4) 数据处理及聚类分析 根据某一条谱带在样品中的出现和不出现分别赋值为1和0,统计各菌株的扩增条带数,根据公式I=2Nij/(Ni+Nj)计算相关菌株的相似系数I,其中Ni、Nj分别为两样品显示的总带数,Nij为两样品共有的显示带数,距离D=1-I(Nei,1987a)。用Neighbor-Joining分别对所有菌株和系统间的相似系数进行聚类,得到相应的系统进化树(Nei,1987b)。相似系数的计算和系统聚类分析均由Ntsys2.02分析软件完成。
2 结果与分析 2.1 RAPD扩增结果及聚类分析5个引物对AMF11个菌株进行PCR扩增,每个引物扩增条数为13~16条,扩增片断的分子量在0.2~2 kb之间,共扩出75个RAPD标记,其中70个标记都出现多态性,表明供试菌株表现出丰富的遗传多样性。
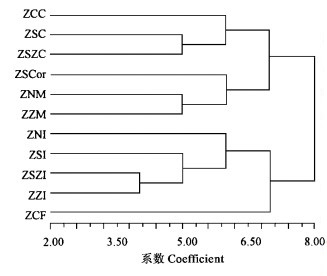
对11个菌株遗传多样性进行聚类分析表明,相同菌种不同菌株之间在亲缘关系上要近于不同菌种间的亲缘关系,在遗传距离为6.5时把11个AMF菌株分为4个类群:第1个类群为Glomus constrictum,包括ZCC、ZSC和ZSZC;第2个类群为Glomus coronatum和Glomus monosporum,包括ZSCor、ZNM和ZZM;第3个类群为Glomus intraradices,包括ZNI、Z SI、ZSZI和ZZI;第4个类群为Glomus fasciculatum(Thaxter),只有ZCF(图 1)。从系统进化角度可以看出第1个类群和第2个类群亲缘关系较为接近,第3个类群和第4个类群亲缘关系较为接近;不同宿主林木各菌株间的亲缘关系也存在着差别,在遗传距离为5.0时第1个类群Glomus constrictum由于宿主的不同分为刺槐ZCC、沙棘ZSC和沙枣ZSZC 3个菌株,第2个类群中的Glomus monosporum,分为柠条ZNM和枣ZZM 2个菌株。
|
图 1 AMF菌株RAPD遗传相似性聚类树状图 Fig. 1 Dendrogram of cluster among AMF isolates based on RAPD analysis |
不同宿主各菌株间存在着丰富的种内遗传多样性,来自枣和沙棘的2个菌株ZSC和ZSZC相似性为80.00%,来自柠条和枣ZNM和ZZM的菌株相似性为75.00%,来自柠条和沙枣ZNI和ZSZI菌株相似性为65.00%(表 2)。相似性在65.00%~80.00%之间,多态性达到20.00% ~35.00%,表明在物种演化过程中,AMF与宿主之间互相选择,形成了具有特殊结构的共生体,宿主自身的遗传特性诱导来自于同源的遗传信息发生了变异,并选择性的保留了这些变异。这种对特殊宿主选择性的基因变异最终导致了AMF的遗传分化,形成了对宿主的不同适应型。
|
|
通过对不同宿主林木的11个AMF菌株进行RAPD分析,在遗传距离为6.5时可以把它们分为Glomus constrictum, G.coronatum和G.monosporum, G.intraradices, G.fasciculatum 4个类群,在遗传距离为5.0时由于宿主的不同分为不同的菌株。不同菌株和不同树种都影响菌种的亲缘关系,同种菌根真菌虽然有共同的起源,但由于受宿主的选择和环境的胁迫,产生不同的表型和遗传型的分化。
AMF菌株种内及种间遗传相似性分析表明,相同生态条件同种宿主不同菌种间存在着丰富的种间遗传多样性,不同种宿主各菌株间也存在着相当丰富的种内遗传多样性。从遗传相似性来看,不同宿主各菌株间遗传相似性高于相同宿主不同菌种之间的遗传相似性,说明菌种、宿主林木都和AMF遗传相似性具有相关性,在AMF的遗传分化上菌种的作用要高于宿主林木对其的影响。因此,在菌根技术应用中依据适地、适树、适菌的原则,从菌株与树木最佳组合、菌株与生态条件最相适应筛选菌株,建立该区域林木和菌根真菌共生体系的优化措施至关重要。
李晓林, 冯固. 2001. 丛枝菌根生理生态. 北京: 华文出版社.
|
Chen Yinglong, Gong Mingqin, Bernie Dell. 1999. Use of molecular biological techniques to study mycorrhiza: advance and perspective. Soil and Environmental Sciences, 8(3): 230-234. |
Gerdemann J W, Nicolson T H. 1963. Spores of mycorrhizal Endgone species extracted from soil by wet sieving and decating. Trans Brith Mycol Soc, 46: 235-244. DOI:10.1016/S0007-1536(63)80079-0 |
Lloyd-MacGilp S A, Chambers S M, Dodd J C, et al. 1996. Diversity of the ribosomal internal transcribed spaces within and among isolates of Glomus mosseae and related mycorrhizal fungi. New Phytol, 133: 103-111. DOI:10.1111/j.1469-8137.1996.tb04346.x |
Nei M. 1987a. Estimation of average heterozygosity and genetic distance from a small number of indiviguals. Genetics, 89: 583-590. |
Nei M. 1987b. Molecular evolutionary gene genetics. New York: Columbia University Press.
|
Phillips J M, Hayman D S. 1970. Improved procedures for clearling and stining parasitic and VAMF for rapid assessment of infection. Trans Br Mycol Soc, 55: 158-161. DOI:10.1016/S0007-1536(70)80110-3 |
Redecker D, Morton J B, Bruns T D. 2000. Molecular phyiogeny of the arbuscular mycorrhizal fungi Glomus sinuosum and Sclerocystis coremioides. Mycology, 92(2): 282-285. DOI:10.1080/00275514.2000.12061155 |
Sanders I R, Alt M, Groppe K, et al. 1995. Identification of ribosomal DNA polymorphisms among and within spores of the Glomales: application to studies on the genetic diversity of arbuscular mycorrhizal fungal communities. New Phytol, 130: 419-427. DOI:10.1111/j.1469-8137.1995.tb01836.x |
Simon L, Lalonde M, Bruns T D. 1992. Specific amplification of 18S fungal ribosomal genes from veslcular-arbuscular endomycorrhiral fungi colonizing roots. Applied and Environmental Microbiology, 58: 187-194. |
Wyss P, Bonfante P. 1993. Amplification of genomic DNA of arbuscular mycorrhizal (AM) fungi by PCR using short arbitrary primers. Mycological Research, 97: 1351-1357. DOI:10.1016/S0953-7562(09)80169-X |
 2006, Vol. 42
2006, Vol. 42