文章信息
- 杨天赐, 莫建初, 程家安.
- Yang Tianci, Mo Jianchu, Cheng Jia'an.
- 白蚁消化纤维素机理研究进展
- Advances in the Study on the Digestive Mechanism of Cellulose in Termites
- 林业科学, 2006, 42(1): 110-115.
- Scientia Silvae Sinicae, 2006, 42(1): 110-115.
-
文章历史
- 收稿日期:2003-11-26
-
作者相关文章
纤维素是由许多D-吡喃葡萄糖经β-1, 4糖苷键组成的直链多糖,广泛存在于植物组织中。地球上每年通过光合作用合成的纤维素约1 000亿t(高洁等,1996)。自然界中,一些昆虫主要利用纤维素酶来消化食物中的纤维素,以获得生长发育所需的营养。目前,昆虫纤维素酶的研究主要集中在鞘翅目、鳞翅目和等翅目的一些种类上,如桑粒肩天牛(Apriona germari)、星天牛(Anoplophora chinensis)(蒋书楠等,1996)、黄粉虫(Tenebrio molitor)(Ferreira et al., 2001)、秋粘虫(Spodoptera frugiperda)(Yu,1989)、北美黑条黄凤蝶(Papilio glaucus)(Lindroth,1988)、桉嗜木天牛(Phoracantha semipunctata)(Chararas et al., 1982)、台湾乳白蚁(Coptotermes formosanus)、黄胸散白蚁(Reticulitermes flaviceps)和北美散白蚁(R. falvipes)等(张大羽等,2001;Nakashima et al., 2002b;Watanabe et al., 2002)。
白蚁是一类古老的社会性昆虫,它们主要以纤维素类物质为食。在白蚁消化系统内,存在完整的纤维素酶体系。现有研究表明,白蚁主要依靠自身分泌的和体内共生物分泌的纤维素酶,来分解食物中的木质纤维素类物质(Nakashima et al., 2002b)。近年来,人们对白蚁消化纤维素的机理做了大量的研究,取得了许多令人振奋的成果。
1 纤维素酶主要成分及其作用方式纤维素酶最早发现于蜗牛的消化液,是一类将纤维素降解成葡萄糖的多组分酶系的总称。根据酶的性质与功能,可将纤维素酶分成内切β-1, 4-葡聚糖酶(endo-1, 4-β-glucanase, EG,CMCase或Cx)、外切葡聚糖酶(exo-β-1, 4-glucanase, C1)和β-葡萄糖苷酶(β-1, 4-g lucosidase,BG)。EG主要作用于非晶态纤维素和水溶性纤维素衍生物,随机水解糖苷键,将其分解成葡葡糖、纤维二糖、纤维三糖和其他寡聚体。C1主要包括纤维二糖水解酶、外切β-1, 4-葡聚糖水解酶两种成分,主要从多聚糖链的非还原端释放出纤维二糖和葡萄糖。纤维二糖水解酶(Cellobiohydrolase, CBH)和外切-β-1, 4-葡聚糖酶分别作用于晶状纤维素和可溶性纤维糊精。BG则将纤维二糖和水溶性纤维糊精水解成葡萄糖(Breznak et al., 1994;Malherbe et al., 2002)(见图 1)。

|
图 1 纤维素酶水解纤维素示意图(Malherbe et al., 2002) Fig. 1 A schematic representation of the process involved in complete enzymatic hydrolysis of a cellulose (Malherbe et al., 2002) |
目前,有关纤维素酶降解纤维素的机理仍未完全阐明。多数学者普遍认为纤维素酶对纤维素的降解是各种组分协同作用的结果(高其昌,1998)。高培基(2003)认为纤维素酶分子对纤维表面的吸附,可诱导分子链间氢链的断裂和单一基元纤维的分离,通过纤维素聚集结构态的改变形成可溶性糖类。
2 白蚁消化纤维素的机理 2.1 肠腔内微生物的作用后肠是白蚁消化系统中微生物栖息的主要场所,其囊形附器内,共生着数量众多的鞭毛虫、纤毛虫、变形虫等单细胞原生动物。原生动物分泌的纤维素酶,可帮助白蚁分解和消化食物中的纤维素成分,使其转变为可吸收利用的营养物质(Breznak et al., 1994;Terra et al., 1994)。
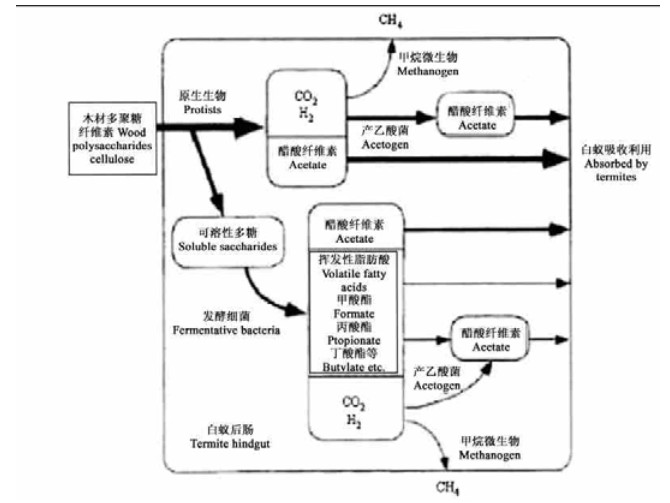
白蚁的能量代谢在后肠中完成,能量代谢途径如图 2所示(Kudo et al., 1998)。研究表明,内华达古白蚁(Zootermopsis nevadensis)和美古白蚁(Z. angusticollis)体内,原生动物降解的纤维素占白蚁所有消化食物量的2/3以上(Hungate,1939)。在北美散白蚁和台湾乳白蚁囊形附器内,共生有13种细菌(Breznak et al., 1977),而澳桉象白蚁(Nasutitermes exitiosus)体内的细菌数量则超过27种(Czolij et al., 1983)。这些微生物不仅对寄主无害,相反能在很大程度上改善白蚁的能量代谢与物质循环(Odelson et al., 1983;Dolan,2001)。通过13C和14C分别标记柏锯白蚁(Microcerotermes parvus)、Thoracotermes macrothorax和Cubitermes orthognathus,发现白蚁体内微生物能明显增强纤维素的消化作用,使寄主能获取足够的营养成分,保持旺盛的生命力(Hopkins et al., 1998;Ji et al., 2001)。
|
图 2 白蚁后肠能量代谢途径(Kudo et al., 1998) Fig. 2 Energy metabolism of termite hindgut (Kudo et al., 1998) |
Thayer(1978)和Inoue等(1997)分别从美国散白蚁(R. hesperus)后肠仙人掌杆菌(Bacillus cereus)和粘质赛氏杆菌(Serratia marcescens)及栖北散白蚁(R. speratus)的原生动物Trichomitopsis termopsidis和披发虫(Trichonympha sphaerica)细胞提取液中,分离出了纤维素酶,这些纤维素酶具有降解羧甲基纤维素(carboxymethylcellulose, CMC)的特性。Veivers等(1983)研究发现,达尔文澳白蚁(Mastotermes darwiniensis)体内的EG酶和CBH酶主要由原生动物产生,在该白蚁不同的消化组织内,纤维素酶的成分也不相同。原位杂交结果显示,大约85%的鞭毛虫附着于囊形附器的内壁上(Breznak et al.,1977;Berchtold et al., 1999)。
来自根土白蚁(Odontotermes obesus)肠道中的玫瑰色微球菌(Micrococcus roseus),也能诱导EG酶和BG酶的产生,它们可将稻壳和CMC糖基化成可降解的糖(Paul et al.,1993)。
2.2 白蚁自身分泌的纤维素酶的作用白蚁消化系统内,除共生微生物分泌纤维素酶外,白蚁自身也能分泌一定量的纤维素酶(Slaytor,1992)。白蚁科是等翅目昆虫中最为进化的一个科,该科多数类群的肠腔内缺乏共生的原生动物。因此,这类白蚁主要依赖唾液腺或中肠上皮细胞分泌的内源性纤维素酶来完成纤维素的消化。大白蚁亚科Macrotermitinae的一些种类还可从巢体上的共生真菌处获得外源性纤维素酶(Aanen et al., 2002)。
Nakashima等(2002b)发现,台湾乳白蚁工蚁体内有2个独立的纤维素消化系统。一是依赖白蚁自身中肠细胞分泌的纤维素酶,二是依赖后肠共生微生物分泌的纤维素酶。这2个酶系统共同完成肠腔内纤维素的分解。在栖北散白蚁的唾液腺中,EG酶和BG酶的含量分别占肠道纤维素酶总量的77.8%和23.9%(Inoue et al., 1997)。黄胸散白蚁也可利用唾液腺分泌的EG酶来降解食物中的纤维素,台湾乳白蚁体内的纤维素酶除存在于唾液腺外,还存在于中肠,且EG酶和CBH酶的活性比黄胸散白蚁的明显要高(张大羽等,2001)。
Martin等(1978)发现,在撒哈拉大白蚁(Macrotermes natalensis)的中肠和唾液腺中,不仅有EG酶和BG酶成分,在中肠还存在有CBH酶。但CBH酶主要通过取食巢体上的鸡NFDA2菌(Termitomyces sp.)获得。M. mülleri对食物中纤维素的消化与吸收,除自身分泌的纤维素酶外,还需要真菌纤维素酶的协同作用(Rouland et al., 1988)。在肯坦大白蚁(M. michaelseni)和M. subhyalinus的唾液腺和中肠均有纤维素酶存在,其中以中肠纤维素酶活性最高。在新陈代谢过程中,工蚁体内90%的葡萄糖由肠道自身分泌的纤维素酶提供,少量由真菌分泌的纤维素酶提供(Anklin-Mühlemann et al., 1995)。
高山象白蚁(N. takasagoensis)和N. walkeri体内的CBH酶也主要存在于中肠。该部位CBH酶分别占2种白蚁体内CBH酶总量的97%和92%。利用氧处理方法排除肠道中原生动物和螺旋菌体的干扰,结果28 h后,后肠中大部分纤维素酶和CBH酶活性丧失,而中肠酶系的活性不受影响,说明高山象白蚁和N. walkeri中肠中的纤维素酶由白蚁自身分泌产生(Mcewen et al., 1980)。以上研究结果与Slaytor(1992)的研究一致,说明有些白蚁在消化纤维素的过程中,可以依靠自身分泌的纤维素酶,来完全降解食物中的纤维素。
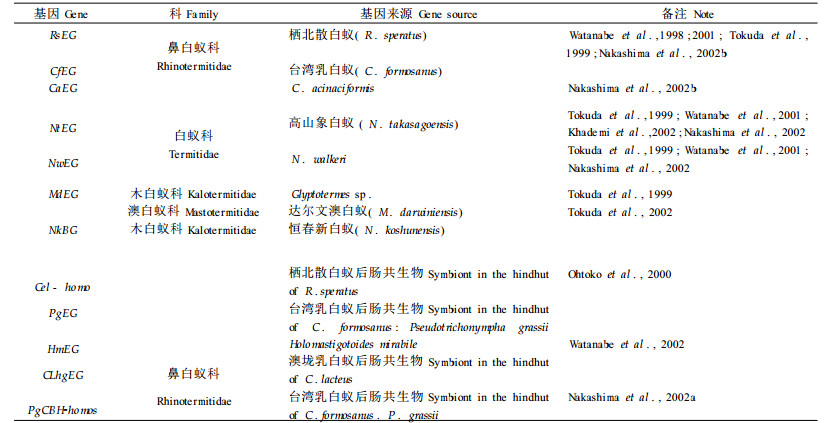
3 白蚁纤维素酶基因的克隆美国国家生物技术信息中心的GenBank数据库(http://www.ncbi.nlm.nih.gov)显示,已克隆的白蚁纤维素酶基因主要是EG酶基因,它们来自鼻白蚁科、白蚁科、澳白蚁科和木白蚁科的几种白蚁(见表 1)。
|
|
最早克隆白蚁纤维素酶基因的是日本科学家Watanabe等人,他们从栖北散白蚁体内克隆出完整的RsEG基因序列(Watanabe et al., 1998)。由Southern杂交试验得知,该纤维素酶基因为内源性基因。Tokuda等(1999)也从白蚁科、鼻白蚁科几种常见白蚁体内克隆出了内源性纤维素酶基因。该基因编码的酶属糖苷水解酶第9家族(glycoside hydrolase family 9,GHF 9),与细菌、变形虫和植物的EG酶具有40%~52%的同源性。同植物EG酶基因一样,它由单一的催化区组成,没有大多数微生物纤维素酶基因所拥有的吸附结构域。高山象白蚁EG酶基因编码的NtEG序列,是典型的真核生物启动子。该白蚁肠道中带有NtEG反义RNA,经原位杂交探针实验证明它可在中肠中表达,而栖北散白蚁EG酶染色体基因的表达是在唾液腺。经蛋白质N-末端测序分析,台湾乳白蚁EG酶N-端和C-末端氨基酸序列为“LGQGTNQAENHPSLS WQNRR…INY",该序列同样与GHF 9家族十分相似,其表达主要是在唾腺液、前肠和中肠(Nakashima et al., 2002b)。
Ohtoko等(2000)和Nakashima等(2002a)先后从黄胸散白蚁和台湾乳白蚁后肠共生物中克隆出了纤维素酶基因。前者与纤维素酶第45家族具有一定的相似性,而后者是来自Pseudotrichonympha grassii体内的CBH酶基因同族体(PgCBH-homo),与GHF 7家族相似。
利用多序列联配Clustal X(1.8)软件包,对台湾乳白蚁(CfEG)、栖北散白蚁(RsEG)、高山象白蚁(NtEG)、N. walkeri (NwEG)、达尔文澳白蚁(MdEG)体内编码的EG酶基因进行序列分析,发现不同栖境下白蚁EG酶基因具有高度的同源性,序列相似性达70%。在台湾乳白蚁后肠共生物P. grassii(PgEG)和Holomastigotoides mirabile (HmEG)及澳垅乳白蚁(C. lacteus)后肠原生动物体内(CLhgEG),也同样克隆出了EG酶基因。经同源性检测,上述3种共生物的纤维素酶基因的同源性达62%以上。
另外,在达尔文澳白蚁和树白蚁属Glyptotermes sp.的唾液腺中,也发现有完整的纤维素酶基因(AB024735和AB024736)。在BG酶基因研究方面,目前也取得了一定的进展。现已克隆出恒春新白蚁BG酶基因(NkBG,AB073638)。该基因的大小为1 677 bp(Tokuda et al., 2002),但其结构与功能仍未弄清楚。
4 结语与展望作为世界上重要的资源性昆虫,白蚁体内的纤维素酶异常富庶。今后,应深入了解不同栖息特性白蚁体内纤维素酶的组成特点,全面获取白蚁纤维素酶的基础信息,进一步加强白蚁纤维素酶基因结构的研究,结合生物信息学技术预测相关基因的功能,彻底阐明白蚁利用纤维素的理化途径以及纤维素酶在白蚁体内的分泌机制。
在全面掌握各类型白蚁纤维素酶特性的基础上,筛选出具有较高活性纤维素酶的白蚁种类,为开发高活性的纤维素酶基因工程菌株创造条件。同时通过研制纤维素酶抑制剂,为重要农林业害虫的防治,提供新的手段。此外,还可以利用纤维素酶分解自然界中的纤维素类物质,生产工业燃料,弥补世界石油和天然气资源的不足,为人类经济的进一步繁荣和发展开辟新的能源途径(张德强等,2000;Alfani et al., 2000)。
高洁, 汤烈贵. 1996. 纤维素科学. 北京: 科学出版社.
|
高培基. 2003. 纤维素酶降解机制及纤维素酶分子结构与功能研究进展. 自然科学进展, 13(1): 21-29. DOI:10.3321/j.issn:1002-008X.2003.01.004 |
高其昌. 1998.纤维素酶//张树政主编.酶制剂工业: 下册.北京: 科学出版社, 595-624
|
蒋书楠, 殷幼平. 1996. 几种天牛纤维素酶的来源. 林业科学, 32(5): 441-446. |
张大羽, 诸永, 程家安. 2001. 黄胸散白蚁和台湾家白蚁不同品级虫体内纤维素酶的活性. 浙江大学学报:农业与生命科学版, 27(1): 1-4. |
张德强, 黄镇亚, 张志毅. 2000. 木质纤维生物量一步法(SSF)转化成乙醇的研究Ⅲ. 北京林业大学学报, 22(6): 49-54. |
Aanen D K, Eggleton P, Rouland-Lefèvre C, et al. 2002. The evolution of fungus-growing termites and their mutualistic fungal symbionts. Proc Natl Acad Sci, 99(23): 14887-14892. DOI:10.1073/pnas.222313099 |
Alfani F, Gallifuoco A, Saporosi A, et al. 2000. Comparison of SHF and SSF processes for the bioconversion of steam-exploded wheat straw. J Ind Microbio Biotech, 25: 184-192. DOI:10.1038/sj.jim.7000054 |
Anklin-Mühlemann R, Bignell D E, Veivers P C, et al. 1995. Morphological, microbiological and biochemical studies of the gut flora in the fungus-growing termite Macrotermes subhyalinus. J Physiol, 41(11): 929-940. |
Berchtold M, Chatzinotas A, Schønhuber W, et al. 1999. Differential enumeration and in situ localization of microorganisms in the hindgut of the lower termite Mastotermes darwiniensis by hybridization with rRNA-targeted probes. Arch Microbiol, 172: 407-416. DOI:10.1007/s002030050778 |
Breznak J A, Brune A. 1994. Role of microorganisms in the digestion of lignocellulose by termites. Annu Rev Entomol, 39: 453-487. DOI:10.1146/annurev.en.39.010194.002321 |
Breznak J A, Pankratz H S. 1977. In situ morphology of the gut microbiota of wood-eating termites [Reticulitermes flavipes (Kollar) and Coptotermes formosanus Shiraki]. Appl Environ Microbiol, 33(2): 406-426. |
Chararas C, Chipoulet J M. 1982. Purification by chromatography and properties of a β-glucosidase from the larvae of Phoracantha semipunctata.. Comp Biochem Physiol, 72B: 559-564. |
Czolij R, Slaytor M, O′Brien R W. 1985. Bacterial flora of the mixed segment and the hindgut of the higher termite Nasutitermes exitiosus Hill (Termitidae, Nasutitermitinae). Appl Environ Microbiol, 49(5): 1226-1236. |
Dolan M F. 2001. Speciation of termite gut protists: the role of bacterial symbionts. Int Microbiol, 4: 203-208. DOI:10.1007/s10123-001-0038-8 |
Ferreira A H P, Marana S R, Terra W R, et al. 2001. Purification, molecular cloning, and properties of a β-glycosidase isolated from midgut lumen of Tenebrio molitor (Coleoptera) larvae. Insect Biochem Molec Biol, 31: 1065-1076. DOI:10.1016/S0965-1748(01)00054-6 |
Hopkins D W, Chudek J A, Bignell D E, et al. 1998. Application of 13C NMR to investigate the transformations and biodegradation of organic materials by wood-and soil-feeding termites, and a coprophagous litter-dwelling dipteran larva. Biodegradation, 9: 423-431. DOI:10.1023/A:1008313309557 |
Hungate R E. 1939. Experiments on the nutrition of Zootermopsis Ⅲ: The anaerobic carbohydrate dissimilation by the intestinal protozoa. Ecology, 20(2): 230-245. DOI:10.2307/1930742 |
Inoue T, Murashima K, Sugimoto A, et al. 1997. Cellulose and xylan utilization in the lower termite Reticulitermes speratus. J Insect Physiol, 43(3): 235-242. DOI:10.1016/S0022-1910(96)00097-2 |
Ji R, Brune A. 2001. Transformation and mineralization of 14C-labeled cellulose, peptidoglycan, and protein by the soil-feeding termite Cubitermes orthognathus. Biol Fertil Soils, 33: 166-174. DOI:10.1007/s003740000310 |
Khademi S, Guarino L A, Watanabe H, et al. 2002. Structure of an endoglucanase from termite, Nasutitermes takasagoensis. Acta Cryst, 58D: 653-659. |
Kudo T, Ohkuma M, Moriya S, et al. 1998. Molecular phylogenetic identification of the intestinal anaerobic microbial community in the hindgut of the termite, Reticulitermes speratus, without cultivation. Extremophiles, 2: 155-161. DOI:10.1007/s007920050055 |
Lindroth R L. 1988. Hydrolysis of phenolic glycosides by midgut β-glucosidases in Papilio glaucus subspecies. Insect Biochem, 18: 789-792. DOI:10.1016/0020-1790(88)90102-3 |
Malherbe S, Cloete T E. 2002. Lignocellulose biodegradation: Fundamentals and applications. Environ Sci Bio/Technology, 1: 105-114. DOI:10.1023/A:1020858910646 |
Martin M M, Martin J S. 1978. Cellulose digestion in the midgut of the fungus-growing termite Macrotermes natalensis: the role of acquired digestive enzymes. Science, 199(31): 1453-1455. |
Mcewen S E, Slaytor M, O′Brien R W. 1980. Cellobiase activity in three species of Australian termites. Insect Biochem, 10: 563-567. DOI:10.1016/0020-1790(80)90092-X |
Nakashima K, Watanabe H, Azuma J I. 2002a. Cellulase genes from the parabasalian symbiont Pseudotrichonympha grassii in the hindgut of the wood-feeding termite Coptotermes formosanus. Cell Molec Life Sci, 59: 1554-1560. DOI:10.1007/s00018-002-8528-1 |
Nakashima K, Watanabe H, Saitoh H, et al. 2002b. Dual cellulose-digesting system of the wood-feeding termite, Coptotermes formosanus Shiraki. Insect Biochem Molec Biol, 32: 777-784. DOI:10.1016/S0965-1748(01)00160-6 |
Odelson D A, Breznak J A. 1983. Volatile fatty acid production by the hindgut microbiota of xylophagous termites. Appl Environ Microbiol, 45(5): 1602-1613. |
Ohtoko K, Ohkuma M, Moriya S, et al. 2000. Diverse genes of cellulase homologues of glycosyl hydrolase family 45 from the symbiotic protists in the hindgut of the termite Reticulitermes speratus. Extremophiles, 4: 343-349. DOI:10.1007/s007920070003 |
Paul J, Varma A K. 1993. Hydrolytic enzyme(s) production in Micrococcus roseus growing on different cellulosic substrates. Letters Appl Microbiol, 16: 167-169. DOI:10.1111/j.1472-765X.1993.tb01386.x |
Rouland C, Civas A, Renoux J, et al. 1988. Purification and properties of cellulases from the termite Macrotermes mülleri (Termitidae, Macrotermitinae) and its symbiotic fungus Termitomyces sp. Comp Biochem Physiol, 91B: 449-458. |
Slaytor M. 1992. Cellulose digestion in termites and cockroaches: what role do symbionts play?. Comp Biochem Physiol:B, 103: 775-784. DOI:10.1016/0305-0491(92)90194-V |
Terra W R, Ferreira C. 1994. Insect digestive enzymes: Properties, compartmentalization and function. Comp Biochem Physiol, 119B(1): 1-62. |
Thayer D W. 1978. Carboxymethylcellulase produced by facultative bacteria from the hind-gut of the termite Reticulitermes hesperus. J Gene Microbiol, 106: 13-18. DOI:10.1099/00221287-106-1-13 |
Tokuda G, Lo N, Watanabe H, et al. 1999. Metazon cellulase genes from termites: intron/exon structures and sites of expression. Biochimica et Biophysica Acta, 1447: 146-159. DOI:10.1016/S0167-4781(99)00169-4 |
Tokuda G, Saito H, Watanabe H. 2002. A digestive beta-glucosidase from the salivary glands of the termite, Neotermes koshunensis (Shiraki): distribution, characterization and isolation of its precursor cDNA by 5'- and 3'-RACE amplifications with degenerate primers. Insect Biochem Molec Biol, 32(12): 1681-1689. DOI:10.1016/S0965-1748(02)00108-X |
Veivers P C, O′Brien R W, Slaytor M. 1983. Selective defaunation of Mastotermes darwiniensis and its effect on cellulose and starch metabolism. Insect Biochem, 13(1): 95-101. |
Watanabe H, Tokuda G. 2001. Animal cellulases. Cell Mol Life Sci, 58: 1167-1178. DOI:10.1007/PL00000931 |
Watanabe H, Nakashima K, Slaytor M. 2002. New endo-β-1, 4-glucanases from the parabasalian symbionts, Pseudotrichonympha grassii and Holomastigotoides mirabile of Coptotermes termites. Cell Molec Life Sci, 59: 1983-1992. DOI:10.1007/PL00012520 |
Watanabe H, Noda H, Tokuda G, et al. 1998. A cellulase gene of termite origin. Nature, 394: 330-331. DOI:10.1038/28527 |
Yu S J. 1989. β-glucosidase in four phytophagous Lepidoptera. Insect Biochem, 19: 103-108. DOI:10.1016/0020-1790(89)90015-2 |
 2006, Vol. 42
2006, Vol. 42