文章信息
- 赵博光, 梁波, 徐梅, 赵林果.
- Zhao Boguang, Liang Bo, Xu Mei, Zhao Linguo.
- 松材线虫携带的一株荧光假单胞细菌致萎毒素的初步分离
- Preliminary Partition of the Toxins of a Strain in Pseudomonas fluorescens associated with Busaphelenchus xylophelus
- 林业科学, 2006, 42(1): 75-78.
- Scientia Silvae Sinicae, 2006, 42(1): 75-78.
-
文章历史
- 收稿日期:2004-12-13
-
作者相关文章
在调查并鉴定了中国松材线虫病疫区的松材线虫(Busaphelenchus xylophelus)携带的细菌种类及分布的基础上, 对黑松(Pinus thunbergii)幼苗、幼树及7~8年生大树进行了接种试验。大量采样和分离的结果确定了在中国健康黑松和马尾松(Pinus massoniana)体内没有内生细菌的存在。根据接种实验及病原的再分离结果,认为松材线虫携带的细菌与松材线虫的致病性相关,并提出松材线虫病是松材线虫和致病细菌共同侵染引起的复合侵染病害的假说(Zhao et al.,2003)。谢立群等(2004)对接种松材线虫后黑松的不同发病阶段, 树体内非接种枝上的线虫、细菌的种类及数量变化动态进行了研究, 结果表明:非接种枝上, 在发病早期就有细菌检出; 至发病后期, 病树基本枯死时, 线虫和细菌数量才迅速增加。发病初期至中期, 细菌种类比较单一, 最早出现的细菌为假单胞属的细菌。随着病情的发展, 细菌不但数量迅速增加, 而且种类也增多, 但优势菌群仍为假单胞属细菌。此外,还用电子显微镜和普通光学显微镜观察到线虫携带的细菌及其携带部位并测定了线虫携带的细菌的数量(赵博光等, 2000;谢立群等, 2002)。
国内外均有报道证明,无菌松材线虫失去致病性,不产毒(Kawazu et al., 1997; 曹越等,1996),接种无菌线虫后不能使寄主松树发病(Zhao et al., 2003; 赵博光等, 2004;Zhang et al., 1997)。然而,生测表明松材线虫携带的细菌产毒(Zhao et al., 2003; Han et al., 2003;Oku et al., 1980; Kawazu et al., 1996;1998; Zhang et al., 1997), 接种无菌线虫与细菌的混合物,能导致寄主松树萎蔫(Zhao et al., 2003;赵博光等,2004;Kawazu et al., 1999)。上述报道均为细菌参与松材线虫病提供了证据。
关于松材线虫病的致萎机制,目前多数研究者认为毒素在致病过程中起着重要作用。但是对于毒素的来源却有不同的看法。Oku等(1980)和Oku(1990)首先提出在松材线虫病的致病过程中有毒素的参与,并从感染松材线虫病的黑松、赤松(Pinus densiflora)和多脂松(P.resinosa)的松树针叶和木材中提取、鉴定致萎活性的物质:苯甲酸,邻苯二酚,2-氢松柏醇和8-羟基香芹鞣酮;后来Bolla等(1982)和Shaheen(1984)又从感病的欧洲赤松(P.sylvestris)上分离到了10-羟基马鞭草烯酮和8-羟基香芹鞣酮, 经生测证明这些物质均有致萎活性。另据曹越等(2001)报道,自然感病的15年生黑松和马尾松以及人工感病的黑松苗中有致萎毒素物质苯乙酸和2-甲氧基肉桂酸。Kawazu等(1998)和Zhang等(1997)对松材线虫携带的细菌进行研究,鉴定出3种对松树细胞产生毒素的细菌,分别为蜡状芽孢杆菌(Bacillus cereus),枯草芽孢杆菌(B. subtilis)和巨大芽孢杆菌(B. megaterium),并且分离、鉴定出这些细菌的代谢毒素为苯乙酸;Odani等(1985)等认为松材线虫分泌的纤维素酶在早期致病过程中起到了关键作用。严东辉等(1997)对松材线虫体外分泌物的组成酶进行了研究,认为松材线虫病的初始病理反应不仅仅有纤维素酶的作用,可能还有其他酶的参与。Kojima等(1994)对松材线虫的分泌物进行了电泳分析,认为纤维素酶在致萎机制中起重要作用。
迄今尚未见与松材线虫相关的细菌产生的大分子物质参与松材线虫病的致萎作用的报道。本试验对松材线虫携带的假单胞菌GcM5-1A进行其致萎毒素的初步分离纯化。
1 材料与方法 1.1 菌种从松材线虫虫体上分离的荧光假单胞菌GcM5-1A菌株(Pseudomonas fluorescens) (Zhao et al., 2003)。该菌株保存于南京林业大学森林保护系。
1.2 获得无菌松材线虫在南京伊刘苗圃感病枯死的黑松木段上采用贝曼漏斗法分离出野生松材线虫。将得到的松材线虫用3%过氧化氢处理10 min,再用0.5%硫酸链霉素和0.5%硫酸庆大霉素各处理2 h,每次处理后均用灭菌水冲洗3次。处理后的松材线虫接至黑松愈伤组织上,取部分松材线虫接到牛肉汤蛋白胨(NB)琼脂平板上培养,以检验其是否为无菌松材线虫。检验确认后,每隔15 d,用黑松愈伤组织进行继代培养。
1.3 获得黑松愈伤组织细胞采用1/2MS为基本培养基,附加NAA 0.5 mg·L-1,IBA 0.1 mg·L-1,GA3 1.0 mg·L-1,2, 4-D 1.0 mg·L-1,LH 100 mg·L-1,蔗糖30 g·L-1,用1 mol的HCl和1 mol的NaOH调节pH值为5.86,分装于100 mL三角瓶中,于121 ℃、1.1 kg·cm-2灭菌15 min,得到黑松细胞振荡培养用的液体培养基(张海兰等,2002)。
挑选生长松散的黑松愈伤组织块,在无菌操作室中机械粉碎,接入50 mL液体培养基中,置于26 ℃恒温振荡器(128 r·min-1)上培养1 d,静置,待细胞沉淀后,移去上清液,得到黑松单细胞及小的细胞团。
1.4 荧光素的配制将0.5 g双醋酸盐荧光素FDA(fluorescein diacetate)(美国SIGMA公司)溶于50 mL丙酮中,制成FDA母液,置于4 ℃冰箱中保存。
1.5 荧光假单胞菌菌株GcM5-1A液体培养的无细胞滤液将在4 ℃冰箱中保存的GcM5-1A菌株在无菌操作室中用接种环取一环(直径为0.2 mm),接入NB液体培养基50 mL中,置于30 ℃恒温振荡器(128 r·min-1)上培养2 d进行菌种活化。活化后,将GcM5-1A菌株接入NB液体培养基中,每50 mL NB液体培养基中接入1 mL活化菌株,置于30 ℃恒温振荡器(128 r·min-1)上培养7 d。之后,每天取培养液离心10 min(4 000 r·min-1),取上清液用0.22 μm微孔滤膜过滤,得到细菌的液体培养的无细胞滤液,置于4 ℃冰箱中保存,备测。
1.6 GcM5-1A液体培养的无细胞滤液的透析将DM-36透析膜先用50%乙醇慢慢煮沸1 h,再分别用50%乙醇,0.01 mol·L-1碳酸氢钠溶液,0.001 mol·L-1EDTA溶液依次洗涤,最后用蒸馏水浸洗3次,以除去透析膜中对蛋白质和其他生物活性物质有害的微量硫化物、重金属和一些具有紫外吸收的杂质。将处理好的透析膜置于4 ℃冰箱中保存。
将GcM5-1A液体培养4 d后的无细胞滤液40 mL装入处理过的DM-36透析膜中,两端封住,置于一盛有约200 mL蒸馏水的烧杯中透析2 d,每8 h换一次蒸馏水。收集透析膜外的蒸馏水约1 200 mL。透析后测定透析膜内液体培养的无细胞滤液的体积,将收集的透析膜外的蒸馏水用旋转蒸发器在70 ℃减压浓缩至与透析膜内滤液等体积。
1.7 无细胞滤液的荧光染色显微生测将荧光染色显微生测方法(Kawasu et al., 1998)进行了改进,即:将待测的液体培养的无细胞滤液分别与黑松细胞按4:1混和,黑松细胞的浓度约为6×105个·mL。置于4 ℃冰箱中4 d后,镜检,统计黑松细胞的存活率。镜检时,取混和液少许,滴到载玻片上,再滴加用蒸馏水稀释50倍的FDA母液,盖上盖玻片,静置5 min后移至万能研究用显微镜(Olympus BH-2)下,随机挑选4个视野,分别在暗视野和明视野下统计活细胞数和细胞总数,计算各视野下黑松细胞的存活率(用SPSS软件统计分析,下同)。以NB液体培养基为对照。
将40 mL NB液体培养基用灭菌水稀释至与透析后透析膜内的液体培养的无细胞滤液等体积,以此为对照,把GcM5-1A液体培养的无细胞滤液透析后的膜内组分和膜外组分以及对照分别与黑松细胞按4:1混和,置于4 ℃冰箱中4 d,用上述方法测定毒性。
2 结果与分析 2.1 无细胞滤液毒性随培养天数的变化萤光假单胞菌菌株GcM5-1A液体培养的无细胞滤液毒性随培养天数的变化如图 1所示。从结果可见,当GcM5-1A培养仅1 d时,其液体培养的无细胞滤液与对照之间t检验显示其差异显著,可见GcM5-1A在NB液体培养基中的产毒很快并且产毒能力很强。随着培养时间的增长,GcM5-1A液体培养的无细胞滤液的毒性逐渐增强,当培养4 d时,其毒性进入相对稳定期,再继续延长培养时间,其毒性仅有小幅度的升高。据此,在进行荧光假单胞菌菌株GcM5-1A细菌毒素的分离鉴定工作中,可将4 d作为GcM5-1A菌株的培养时间。
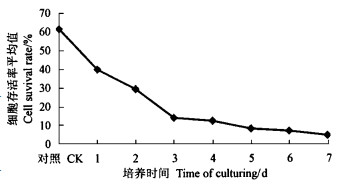
|
图 1 GcM5-1A液体培养的无细胞滤液毒性随培养天数的变化 Fig. 1 Changes of the toxicity of the cell free filtrate of GcM5-1A culture with culturing days |
对GcM5-1A菌株液体培养了4 d的培养基无细胞滤液及其透析后各组分的毒性测定结果见图 2。经t检验,GcM5-1A液体培养的无细胞滤液的毒性与对照之间,GcM5-1A液体培养的无细胞滤液透析后其膜内和膜外组分毒性与对照之间毒性差异均极显著,但GcM5-1A液体培养的无细胞滤液透析后其膜内组分和膜外组分之间的毒性t检验结果不显著,说明GcM5-1A液体培养的无细胞滤液在透析膜内、膜外组分均有毒性, 但都比未经透析的GcM5-1A液体培养的无细胞滤液的毒性低。该结果表明:GcM5-1A细菌毒素不是单一化合物,可能由比较多的物质组成,其中含有相对分子质量大于8 000的大分子物质(膜内组分),如蛋白质、多肽、酶等;也有小分子有机化合物(膜外组分)。
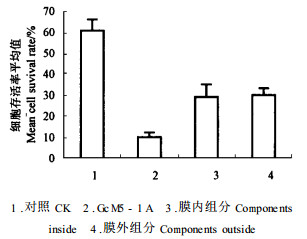
|
图 2 GcM5-1A液体培养的无细胞滤液透析后膜内外组分的毒性测定 Fig. 2 Toxicity of the dialytic components within and outside the membrane of the cell free filtrate of GcM5-1A culture |
在对松材线虫携带的细菌所产生的致萎毒素的研究中,建立一种灵敏、高效的生测方法是一个关键。笔者所建立的细胞荧光染色显微生测法能真实地反映松材线虫携带的细菌所产生的毒素对寄主的致病作用,显示出了很高的灵敏度。细菌液体培养的无细胞滤液与黑松细胞的培养液按4:1的比例混和,既保证了细菌液体培养的无细胞滤液不被过于稀释,能够很好的作用于黑松细胞,又使得每次试验仅需很少量的细菌液体培养的无细胞滤液,约为2.4 mL,方法简单,结果稳定,为今后在松材线虫携带的细菌的致萎毒素的分离、鉴定工作打下了基础。
根据本试验结果,随GcM5-1A培养天数的增多,GcM5-1A液体培养的无细胞滤液对黑松细胞的毒性逐渐增强,当培养4 d时,其液体培养的无细胞滤液的毒性的升高已进入相对稳定期,因此可将培养4 d作为假单胞菌GcM5-1A产毒的最佳培养时间。试验中采用DM-36透析膜,可透过的相对分子质量为8 000。试验结果显示,GcM5-1A液体培养的无细胞滤液透析后其膜内和膜外组分均有毒性,据此可推测,GcM5-1A细菌毒素并不是单一化合物,而且有可能由比较多的物质组成,其中含有相对分子质量大于8 000的大分子物质,如蛋白质、多肽、酶等;也有小分子有机化合物。本结果同时表明,松材线虫携带的致病细菌是导致寄主萎蔫的毒素的来源。
接种试验已经证明松材线虫携带的致病细菌在寄主体内可以产生毒素(Zhao et al., 2003;Kawazu et al., 1998;Zhang et al., 1997)。本试验的结果证明松材线虫携带的致病的荧光假单胞细菌在寄主体外也可以产毒,其产毒数量随培养时间的增加可分为上升阶段和相对稳定阶段。结合有关无菌松材线虫体外培养不能产毒(曹越等,1996)及接种后不能诱导萎蔫症状(Zhao et al., 2003; Kawasu et al., 1997)的报道,说明了松材线虫携带的致病细菌才是产生萎蔫病状毒素的来源。
通过组织培养结合毒素诱变筛选抗病突变体是抗病育种的一条新途径。在松材线虫寄主树种的愈伤组织或细胞的培养液中加入不同浓度的毒素作为选择压力,选择对松材线虫病具有明显抗性的后代,并可进一步与育种工作结合,就有可能培育成抗性品系。
GcM5-1A细菌毒素的分离工作可分两方面进行:以生测跟踪,对小分子及大分子组分进行致萎毒素的分离鉴定。松材线虫所带致病菌产生毒素的分离、鉴定将为阐明松材线虫病的分子致病机理奠定基础。
曹越, 韩正敏, 李传道. 2001. 松材线虫病感病松树中致萎毒性物质的研究. 林业科学, 37(4): 75-79. DOI:10.3321/j.issn:1001-7488.2001.04.012 |
曹越, 沈伯葵. 1996. 人工培养条件下松材线虫提取物的毒性研究. 南京林业大学学报:自然科学版, 20(4): 13-16. |
谢立群, 赵博光, 巨云为, 等. 2002. 松材线虫携带细菌的光镜观察与数量测定. 浙江林学院学报, 19(4): 346-349. DOI:10.3969/j.issn.2095-0756.2002.04.003 |
谢立群, 巨云为, 赵博光. 2004. 松材线虫病程中树体内线虫和细菌种群数量的动态变化. 林业科学, 40(4): 124-129. DOI:10.3321/j.issn:1001-7488.2004.04.021 |
严东辉, 杨宝君. 1997. 松材线虫体外酶组成分析. 林业科学研究, 10(3): 265-269. DOI:10.3321/j.issn:1001-1498.1997.03.007 |
赵博光, 郭道森, 高蓉. 2000. 松材线虫携带细菌部位的电镜观察. 南京林业大学学报, 24(4): 69-71. DOI:10.3969/j.issn.1000-2006.2000.04.016 |
赵博光, 郭道森. 2004. 松材线虫携带的一株细菌的分离及其致病性. 北京林业大学学报, 26(1): 59-63. |
张海兰, 林晓佳, 赵博光. 2002. 激素对黑松愈伤组织褐变和增殖的作用. 山东农业大学学报:自然科学版, 33(4): 413-417. |
Bolla R, Shaheen F, Winter R. 1982. Phytotoxin produced in Bursaphelenchus xylophilus-infected Pinus sylvestris//Appleby J E, Malek R B. Proceedings of the 1982 National Pine Wilt Disease Workshop. Illions Natural History Survey, Champaign, IL: 11-31
|
Han Z M, Hong Y D, Zhao B G. 2003. A study on pathogenicity of bacteria carried by pine wood nematodes. Phytopathology, 151: 683-689. DOI:10.1046/j.1439-0434.2003.00790.x |
Kawazu K, Kaneko N, Hiraoka K. 1999. Reisolation of the pathogens from wilted red pine seedlings inoculated with the bacterium-carrying nematode, and the cause of difference in pathologenicity among pine wood nematode isolates. Scientific Reports of the Faculty of Agriculture, Okayama University, 88: 1-5. |
Kawazu K, Kanneko N. 1997. Aseptisis of the pine wood nematode isolae OKD-3 causes it to lose its pathogenicith. Japanese Journal of Nematology, 27(2): 76-80. DOI:10.3725/jjn1993.27.2_76 |
Kawazu K, Yamashita H, Kanzaki H. 1998. Isolation of pine-wilting bacteria accompanying pine wood nematode, Bursaphelenchus xylophilus, and their toxic metabolites. Scientific Report of the Faculty of Agriculture, Okayama University, 87: 1-7. |
Kawazu K, Zhang H, Yamashita H, et al. 1996. Relationship between the pathogenicity of the pine wood nematode, Bursaphelenchus xylophilus, and phenylacetic acid production. Biosci Biotechnol Biochem, 60(9): 1 413-1 415. DOI:10.1271/bbb.60.1413 |
Kojima K, Kamijyo A, Masumori M, et al. 1994. Cellulase activities of pine-wood nematode isolate with different virulences. J Jpn For Soc, 76(3): 258-262. |
Odani K, Sasaki S, Nishiyama Y, et al. 1985. Early system development of the pine wilt disease by hydrolytic enzymes produced by the pine nematode-cellulase as a possible candidate of the pathogen. J Jpn For Soc, 67(9): 366. |
Oku H, Shiraishi T, Kurozumi S. 1980. Pine wilt toxin, the metabolite of a bacteria associated with a nematode. Naturwissenschafen, 67: 198-199. |
Oku H. 1990. Phytotoxins in pine wilt disease. Nippon Nogeikagaku Kaishi, 64(7): 1254-1257. DOI:10.1271/nogeikagaku1924.64.1254 |
Shaheen F. 1984. Phytotoxin production in Bursaphelencus xylophilus-infected Pinus sylvestris. J Nematol, 16(1): 57-61. |
Zhang H, Kanzaki H, Kawazu K. 1997. Benzoic acid accumulation in the Pinus thunbergii callous inoculated with the pine wood nematode, Bursaphelenchus xylophilus. Z Naturforsch C, 52: 329-332. DOI:10.1515/znc-1997-5-609 |
Zhao B G, Wang H L, Li F, et al. 2003. Distribution and pathogenicity of bacteria species carried by Bursaphelenchus xylophilus in China. Nematology, 5(6): 899-906. DOI:10.1163/156854103773040817 |
 2006, Vol. 42
2006, Vol. 42
