文章信息
- 白钢, 李海燕, 马洪周, 王玉嬿, 杨文博, 张奇.
- Bai Gang, Li Haiyan, Ma Hongzhou, Wang Yuyan, Yang Wenbo, Zhang Qi.
- 疫木切面上松材线虫抗原的免疫学检测方法
- An Immunocytochemical Method for Identification of Bursaphelenchus xylophilus Antigen on the Surface of Pinewood Section
- 林业科学, 2005, 41(6): 101-104.
- Scientia Silvae Sinicae, 2005, 41(6): 101-104.
-
文章历史
- 收稿日期:2003-12-12
-
作者相关文章
2. 国家林业局森林病虫害防治总站 沈阳 110034
2. General Station of Forest Pest Management, State Forestry Administration Shenyang 110034
松材线虫(Bursaphelenchus xylophilus)病是引起松树灾难性毁灭的重要林木检疫对象之一。目前国内外在致病机理研究方面,多数局限在利用影响因子直接接触松树并致病后,根据病木在形态学方面的变化间接地分析松材线虫的致病机理,可见松材线虫的致病机理实际尚未定论(朱克恭,1995)。Odani(1985)和Yamamoto(1986)分别对松材线虫体外分泌酶的致病性进行了研究,认为松材线虫的纤维素酶使松树薄壁细胞的细胞壁和细胞膜遭到破坏, 导致树脂不能正常地从树脂道中渗漏并扩散到相邻的管胞中,使水分输导受阻,导致萎蔫。Myers(1986)认为松树感染了松材线虫后,木质部内挥发性萜烯类物质的含量增加,这些物质进入管胞在管胞中形成空洞,致使水分输导受阻。而Oku(1990)则认为松树感染松材线虫后,体内产生有毒物质,这些毒素导致了松树的枯萎。本研究利用免疫学手段,以抗松材线虫血清直接在疫木切面上进行免疫学染色,建立疫木切面松材线虫抗原的检测方法,为松材线虫的检疫以及松材线虫病的病理学研究提供更直观的检测手段。
1 材料与方法 1.1 材料试剂:弗氏佐剂(GIBCOBRL);辣根过氧化物酶(HRP)标记羊抗兔IgG;邻苯二胺(OPD);3, 3′-二氨基联苯胺(DAB);4-氯萘酚;羊血清及牛血清白蛋白(BSA)均购于灏洋生物工程公司,其他试剂均为分析纯。
主要仪器:酶标仪(BIOTECH,ELX800);冷冻干燥机(Christ,ALPHA1-4);高速冷冻离心机(Beckman,20RP52D);VDS分析仪(Image Master VDS,Pharmacia Biotech),木材切片机(国产);超声波细胞粉碎仪(国产)。
1.2 抗线虫血清的制备分别取贝尔曼漏斗法收集的松材线虫和拟松材线虫(B.mucronatus)(104~105条)于2 mL PBS (0.01 mol·L-1磷酸缓冲液,0.1 mol·L-1 NaCl,pH=7.2)中,冰水浴,超声波粉碎虫体(200 W,10 min)。4 ℃、3 000 r·min-1离心10 min,用Lowry法检测上清液中蛋白含量(Lowry et al., 1951),作为标准线虫蛋白抗原。
取1 mg·mL-1松材线虫蛋白抗原1 mL与等体积的弗氏完全佐剂混合乳化后,于家兔皮下进行多点注射。每隔2周加强注射1次,定期测定抗血清效价,待获得最高效价后,收集血清,灭活,作为抗松材线虫血清(Anti-BX),-20 ℃保存备用。
1.3 抗血清的特异性分析(ELISA法)分别取线虫蛋白抗原溶液于0.05 mol·L-1 NaHCO3缓冲液(pH=9.6)中,制成10 μg·mL-1包被液。取100 μL包被酶标板,经封闭液(0.01 mol·L-1磷酸缓冲液,0.1 mol·L-1 NaCl,10%羊血清,0.1% NaN3,pH=7.2)封闭后,加入以稀释液(0.01 mol·L-1磷酸缓冲液,0.01 mol·L-1 EDTA,0.1% BSA,pH=7.4)10 000倍稀释的Anti-BX血清100 μL,室温反应3 h。用200 μL PBST(0.01 mol·L-1磷酸缓冲液,0.1 mol·L-1 NaCl,0.1% Tween20,pH=7.2)清洗4次后,再加入2 000倍稀释的HRP标记羊抗兔IgG的酶标二抗100 μL,室温反应1 h。PBST清洗4次后,加入新配OPD底物溶液(0.5 mg·mL-1邻苯二胺,0.012% H2O2,0.1 mol·L-1柠檬酸缓冲液,pH=5.2)100 μL,反应5 min后,加入1 mol·L-1 H2SO4 50 μL终止反应,于490 nm处测定吸光度。
1.4 木材表面线虫抗原的固定及封闭取0.5、0.25、0.125、0.1、0.05 μg松材线虫抗原蛋白,以及1.0 μg的松木腐生线虫蛋白,分别点样于干燥的白皮松(Pinus bungeana)木片表面上(6 cm×3 cm×0.2 cm),晾干后微波(800 W)高火加热1.5 min,固定木材表面抗原(Lawler et al., 1993)。将上述木片加入20 mL封闭液中,4 ℃,封闭过夜后用于免疫学检测。自然感染松材线虫的疫木样品则直接取大小为4 cm×4 cm×0.2 cm的弦切片,经上述条件固定,封闭后直接用于免疫学检测。
1.5 疫木切面线虫抗原的免疫染色取上述封闭后的木片,加入1 000倍稀释的Anti-BX血清,振荡,室温反应3 h。经PBST清洗,除去未结合抗体(共5次,每次15 min),随后加入盛有5 mL 500倍稀释的HRP标记的羊抗兔IgG酶标二抗的杂交袋中,室温放置2 h。经PBST充分清洗后,加入联苯二胺(DAB)和4-氯萘酚的混合底物溶液(Young,1989),反应10 min,用蒸馏水冲洗,中止反应,并立即照相保存。
2 结果与分析 2.1 抗血清的特异性分析分别以相同剂量的线虫抗原蛋白包被酶标板,加入Anti-BX血清同固相抗原结合的抗体以酶标二抗进行检测,采用ELISA法考察抗血清的特异性。结果如表 1所示,Anti-BX抗体对松材线虫抗原呈现良好的反应性,BX1、BX2、BX3、BX4的OD490 nm吸光度均大于0.40,拟松材线虫BM1、BM2、BM3也呈现了一定的交叉反应,而松木上其他的腐生线虫,如双胃线虫(Diplogaster sp.)以及湖南伞滑刃线虫(B. hunanensis)反应性较低,说明该血清对松材线虫有一定的专属性。另外,拟松材线虫之间的吸光度变化很大,说明不同品系的拟松材线虫抗原之间也存在着较大的差别。
|
|
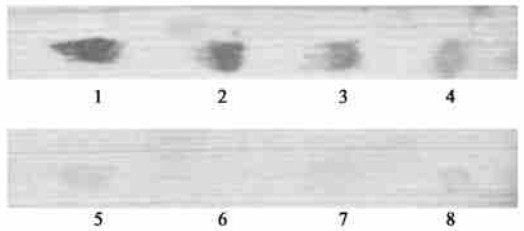
在健康松木的木片上用线虫抗原点样,人工模拟线虫感染的松木,再用Anti-BX血清结合酶标抗体考察检测的灵敏度和特异性(图 1),复合底物的棕黑色显色状况经VDS扫描分析结果见表 2。与空白对照相比较,松材线虫蛋白抗原的检测灵敏度为0.1 μg (P/N>2.0),而其他2种松木的腐生线虫蛋白质样品几乎没有颜色反应(P/N<2.0)。该结果不仅为在疫木切面上直接进行原位染色打下了基础,同时也为以木片作为免疫反应的介质进行免疫学试验提供了可行性的证据。
|
图 1 木片表面线虫抗原的免疫斑点印迹分析 Fig. 1 Immunoblot analysis for nematode antigens on the surface of pinewood section 1、2、3、4、5号BX抗原量分别为0.50,0.25,0.125, 0.10和0.05 μg;7和8号为双胃线虫和湖南伞滑刃线虫提取物1.0 μg;6号为空白0 μg BSA;No.1, 2, 3, 4, 5 are 0.50, 0.25, 0.125, 0.10 and 0.05 μg BX antigen; No.7 and No.8 are 1.0 μg Diplogaster sp. and B. hunanensis extract; Blank test of No.6 is 0 μg BSA |
|
|
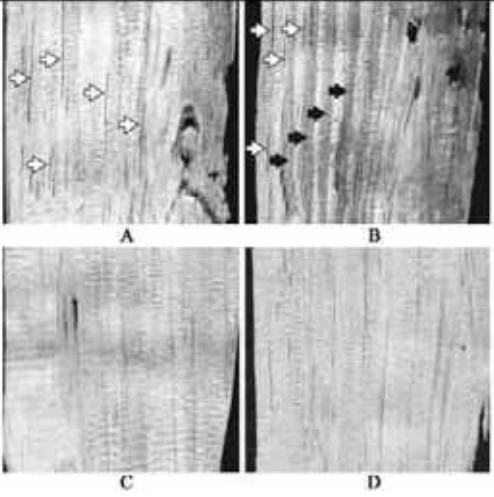
分别取自然感染松材线虫的黑松疫木(江苏南京)和拟松材线虫的马尾松疫木(四川邻水)弦切片,经微波固定,封闭处理后,分别加入空白兔血清和Anti-BX血清,直接在疫木切面进行免疫组化染色。结果如图 2所示,与感染拟松材线虫的松木相比(C,D),感染松材线虫的疫木(A,B)的树脂道和纵向薄壁细胞有明显的褐变(白色箭头),这也与报道的松材线虫侵染松树树脂道的结论相吻合(郭道森等,2000);感染拟松材线虫的疫木切片上未见DAB底物的显色(D),说明该抗体对松材线虫有较好的特异性;与之相对比,感染松材线虫的免疫组化的着色部位多集中在皮层与髓部之间的管胞部位(B)(黑色箭头),表明该部位可能有松材线虫蛋白抗原的存在,这也与松材线虫的侵染途径(朱克恭,1995),以及感染后树皮和木质部中可溶性蛋白含量增加(Yamada,1987)的报道一致。
|
图 2 自然感染的疫木切片的免疫组化分析 Fig. 2 The natural infested pinewood sections stained for nematode antigen by immunocytochemistry A.自然条件下感染松材线虫野生木片的空白对照Control sample, BX natural infected wild wood section; B.结合有抗BX血清的松材线虫感染的松树木片样品染色Staining sample of BX natural infected pinewood section with Anti-BX serum; C.自然条件下感染拟松材线虫野生木片的空白对照Control sample, BM natural infected wild wood section; D.结合有抗BX血清的拟松材线虫感染的松树木片样品染色Staining sample of BX natural infected pinewood section with Anti-BX serum。白色箭头指向树脂道和纵向薄壁细胞;黑色箭头指向染色的管胞组织; White arrows indicate resin canal and longitudinal parenchyma cell; and black arrows indicate stained tracheid tissue. |
多年以来,松材线虫致病机理一直是研究的热点(杨宝君,2002)。病理生理学研究认为:松材线虫感染松树后,树脂道泌脂细胞的胞质首先颗粒化,细胞内含物褐变,轴向和射线薄壁细胞死亡。进一步树脂道、射线和形成层内出现空洞,并延伸至皮层和木质部引起组织的严重破坏,最终导致松树死亡。目前,松材线虫致病的机理存在着酶学学说、空洞化学说和毒素学说3种不同的观点,大多数结论都是建立在病木形态学变化的基础上,未能在分子水平上阐明其内在的机理(谈家金等,2001)。
Lawler等(1993)曾经用抗松材线虫的多克隆抗体检出了点样于欧洲赤松(P. sylvestris)木材表面的培养线虫的微量蛋白质(0.4 μg,相当于25条线虫);但他认为木材的种类和感染情况不同,松材线虫常常以1~10条不等的数量分散或聚集于木材内部,因而未能对自然感染松材线虫的疫木进行更深入地研究。
本研究首先在健康木材表面进行免疫斑点印迹的试验,其检测灵敏度为0.1 μg线虫蛋白(相当于6~8条线虫),显示了本试验所制备的抗松材线虫血清(Anti-BX)有较高的滴度(图 1)。相关研究的免疫印迹分析结果也表明,Anti-BX抗体可识别松材线虫多种可溶性抗原蛋白(白钢等,2004)。在此基础上,本试验重点对自然感染的黑松疫木切片进行了松材线虫抗原的免疫学检测研究。免疫组化的染色结果表明:该方法可以清晰地分辨出轴向的部分管胞处的DAB底物的颜色,证明该部位有松材线虫抗原的存在(图 2),初步认为可能是线虫分泌到体外的酶类或其他蛋白抗原。
有研究表明,当松材线虫侵入松树体后,可通过木质部的树脂道、木射线及管胞作垂直或水平方向的移动,当病木枯死后,病木中的松材线虫逐渐减少,最终几乎消失(朱克恭,1995)。而松材线虫致病机理之一则认为:松材线虫向体外分泌的纤维素酶导致了松树薄壁细胞的细胞壁和细胞膜的破裂,树脂不正常地从树脂道中渗漏并扩散到相邻的管胞中,使水分输导受阻,导致了松树的萎蔫(Yamamoto,1986)。严东辉等(1996)也证明松材线虫可以向体外分泌多种酶蛋白,其中包括纤维素酶、过氧化物酶、蛋白酶、淀粉酶等。本研究虽然未能直接观测到疫木切片中松材线虫的存在,但发现了管胞中存在的松材线虫抗原。如果能进一步证明这些抗原是松材线虫向体外分泌的酶,特别是纤维素酶,这无疑将为致病机理的酶学学说提供一个有利的佐证。
本研究利用抗松材线虫血清,采用免疫学手段建立了在疫木切面上直接进行免疫组化染色检测松材线虫抗原的方法。虽然由于取样季节和取样部位以及抗体的特异性等因素的影响,给该方法的实际应用带来一定的困难,但该方法对疫木上松材线虫的检测,以及感染状况的实时监控仍有很大的实用价值,更有助于获取松材线虫以及其可溶性蛋白抗原成分在疫木组织内的分布信息,进而对松材线虫病的病理学研究有着重要的意义。
白钢, 王玉嬿, 马洪周. 2005. 疫木中松材线虫的免疫学检测方法的研究. 林业科学, 41(2): 91-95. |
郭道森, 赵博光, 李周直. 2000. 松材线虫病致病机理的研究进展. 南京林业大学学报, 24(4): 64-68. DOI:10.3969/j.issn.1000-2006.2000.04.015 |
谈家金, 冯志新. 2001. 松材线虫病病理生理学研究进展. 江西科学, 19(1): 27-30. DOI:10.3969/j.issn.1001-3679.2001.01.009 |
严东辉, 杨宝君. 1996. 松材线虫体外酶组成分析. 林业科学研究, 10(3): 265-269. |
杨宝君. 2002. 松材线虫病致病机理的研究进展. 中国森林病虫, 21(2): 27-31. DOI:10.3969/j.issn.1671-0886.2002.02.012 |
朱克恭. 1995. 松材线虫病研究综述. 世界林业研究, (3): 28-33. |
Lawler C, Harmey M A. 1993. Immunological detection of nematode antigens on the surface of a wood section. Fundamental and Applied Nematology, 16(6): 521-523. |
Lowry O H, Rosebrough N J, Farr A L. 1951. Protein measurement with the folin phenol reagent. J Biol Chem, 193: 265-275. |
Myers R F. 1986. Cambium destruction in conifers caused by pine wood nematode. J Nematol, 18(3): 398-402. |
Odani K. 1985. Early symptom development of the pine wilt disease by hydrolytic enzymes produced by the pine wood nematode cellulose as a possible candidate of the pathogen. J Jpn For Soc, 67(9): 366-372. |
Oku H. 1990. Phytotoxinsin pine (Pinus) wilt disease Bursaphelenchus xylophilus. Nippon Nogeikagaku Kaishi, 64(7): 1254-1257. DOI:10.1271/nogeikagaku1924.64.1254 |
Yamada T. 1987. Lipid peroxidation during the development of pine wilt disease. Ann Phytopath Soc Japan, 53: 523-530. DOI:10.3186/jjphytopath.53.523 |
Yamamoto N. 1986. Cellulase exudation by the pine wood nematode & detection of activity in its crawing track. J Jpn For Soc, 68: 237-240. |
Young P R. 1989. Enhancement of immunoblot staining using a mixed chromogenic substrate. J Immunol Methods, 121(2): 295-296. DOI:10.1016/0022-1759(89)90174-9 |
 2005, Vol. 41
2005, Vol. 41