文章信息
- 吴延军, 张上隆, 谢鸣, 陈俊伟, 秦永华, 秦巧平.
- Wu Yanjun, Zhang Shanglong, Xie Ming, Cheng Junwei, Qin Yonghua, Qin Qiaoping.
- 桃幼胚及幼胚子叶再生的研究
- Plantlets Regeneration from Immature Embryos and Cotyledons of Peach
- 林业科学, 2005, 41(5): 45-50.
- Scientia Silvae Sinicae, 2005, 41(5): 45-50.
-
文章历史
- 收稿日期:2004-10-16
-
作者相关文章
2. 浙江省农业科学院园艺所 杭州 310021
2. Institute of Horticulture, Zhejiang Academy of Agricultural Sciences Hangzhou 310021
高频再生系统是遗传转化研究的基础。国内外学者对桃(Prunus persica)离体培养均有研究(Hammerschlag et al., 1985; Scorza et al., 1990; Riaao et al., 1998),但相对于其他核果类果树,桃经愈伤组织诱导率低,再生频率低且效果不稳定,通过愈伤组织和体细胞途径再生的研究进展缓慢。桃子叶再生报告较少,目前仅见Mante等(1989)利用盛花后70 d的幼胚子叶,4 ℃放28 d后培养在含TDZ和IBA的MS培养基上及Pooler等(1995)用贮藏于4 ℃ 1~3年的桃砧木成熟子叶培养获得再生芽, 但研究多以砧木为主且普遍存在诱导效率不高,培养程序复杂等问题。桃再生系统的研究已严重制约了遗传转化工作(Byrne, 2002)。本研究运用正交设计研究愈伤组织诱导、分化及完整植株形成,并在前期筛选品种和幼胚子叶发育时间的基础上(吴延军等,2003),对影响幼胚子叶再生的一些因子开展详细研究,试图建立分化频率较高、培养方法简单、成本低廉的再生体系,为桃遗传转化工作打下基础。
1 材料与方法 1.1 试验材料以浙江省奉化水蜜桃研究所种植的玉露(P. persica cv. Yulu)和湖景蜜露(P. persica cv. Hujingmilu)桃幼果为试材,于盛花后45 d(5月3日),55 d(5月13日)取样。
1.2 试验方法 1.2.1 桃幼胚的预处理及培养条件选果型正常、大小均一、无伤无虫果,常规消毒后除去果肉并剥开果核,取出幼胚接种在愈伤组织诱导培养基或子叶生长培养基(MS)上,(26±1) ℃暗中培养。每处理20个幼胚,重复3次。20 d后统计愈伤组织诱导率,并将愈伤组织接入分化培养基,光照强度2 000~3 000 lx,光暗周期16 h/8 h下培养,培养温度同上。20 d后统计愈伤组织分化成芽的比例。从子叶生长培养基上挑出幼胚子叶,作为子叶培养的外植体,其不定芽诱导及生根培养条件与愈伤组织分化条件相同。
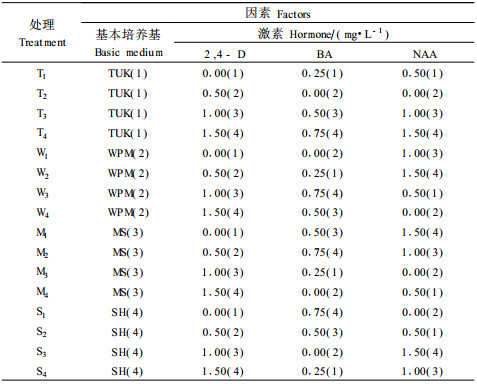
1.2.2 愈伤组织诱导培养基愈伤组织诱导培养基采用正交4因素4水平L16(44)设计(表 1),因素(水平)分别为基本培养基类型(TUK、WPM、MS和SH)、2,4-D浓度(0、0.5、1.0和1.5 mg·L-1)、BA浓度(0.0、0.25、0.50和0.75 mg·L-1)和NAA浓度(0.0、0.5、1.0和1.5 mg·L-1)。
|
|
分化培养基以MS为基本培养基,选用NAA和BA激素组合。NAA浓度固定在0.05 mg·L-1,BA设4个浓度(0.5、1.0、1.5和2.0 mg·L-1); BA浓度固定在0.5 mg·L-1,NAA设3个浓度(0.1、0.15和0.2 mg·L-1)。
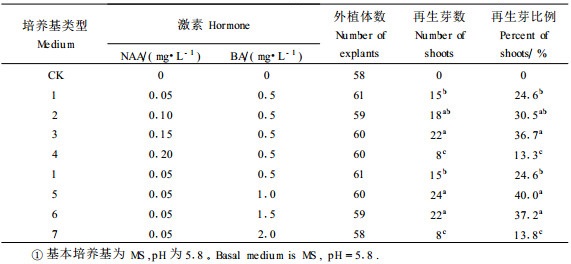
1.2.4 幼胚子叶分化培养基以MS为基本培养基,激素配比分为3组:1) BA固定在5.0 mg·L-1,NAA设4个浓度(0.25、0.5、0.75和1.0 mg·L-1); 2) NAA浓度固定在0.5 mg·L-1,BA设6个浓度(2.5、5.0、7.5、10.0、12.5和15.0 mg·L-1); 3) NAA浓度固定在0.05 mg·L-1,TDZ设4个浓度(2.0、3.0、4.0和5.0 mg·L-1)。
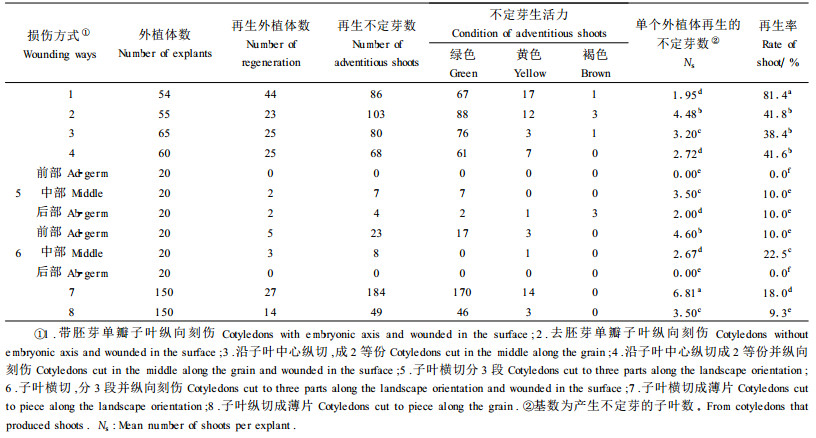
1.2.5 幼胚子叶切割处理从子叶生长培养基上挑出幼胚子叶作如下损伤处理:1)带胚芽单瓣子叶纵向刻伤; 2)去胚芽单瓣子叶纵向刻伤; 3)沿子叶中心纵切成2等份; 4)沿子叶中心纵切成2等份并纵向刻伤; 5)子叶横切分3段; 6)子叶横切分3段并纵向刻伤; 7)子叶横切成薄片; 8)子叶纵切成薄片。
1.2.6 生根培养基以1/2MS为基本培养基,附加不同浓度的IBA。
以上培养基均加蔗糖2%,琼脂7.5 g·L-1,调pH 5.8。121 ℃高压灭菌20 min。培养基中所用激素BA、NAA和IBA采用高压灭菌,TDZ采用过滤灭菌。
1.2.7 统计分析正交分析参考李春喜等(1997)的方法。用SAS统计软件包分析方差。
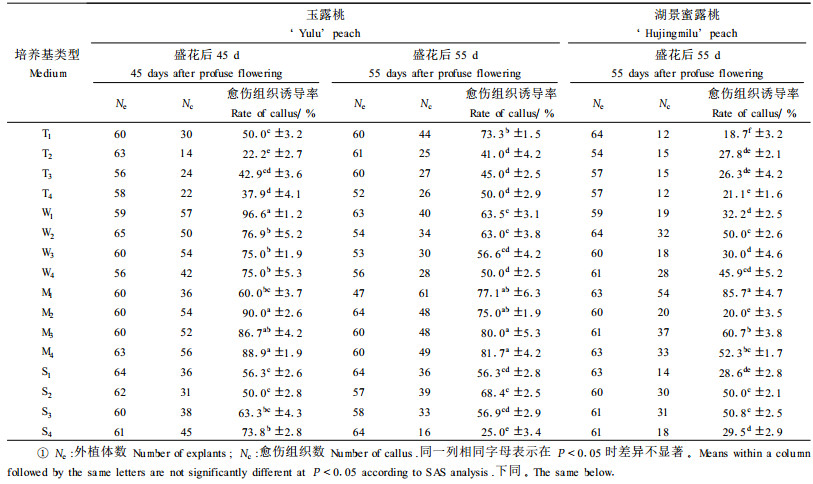
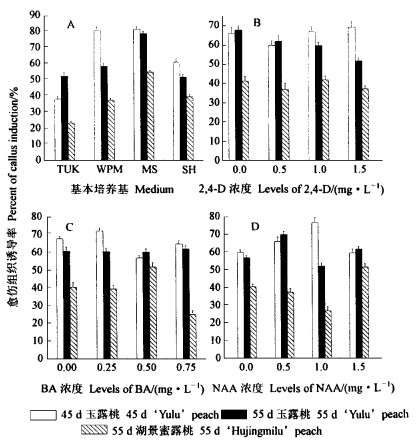
2 结果与分析 2.1 幼胚愈伤组织的诱导及分化 2.1.1 愈伤组织的诱导幼胚诱导愈伤组织的试验结果(表 2)经正交分析证明,供试4个因素中以基本培养基类型(图 1A)最为关键。盛花后45 d玉露桃幼胚愈伤组织诱导最佳培养基为MS和WPM,二者平均出愈率分别为81.4%和80.8%,而SH为60.9%,TUK最差仅为38.4%。其中最好组合是W1,其出愈率达96.9%,其次为M1(90%)、M4(88.9%)和M3(86.7%),最低为T2,仅22.2%,与W1上的相比相差4倍多。盛花后55 d玉露桃幼胚出愈率基本规律与45 d相似,最高者亦为MS,平均出愈率达78.5%,后依次为WPM(58.3%)、TUK(52.3%),SH最低为51.7%。与45 d幼胚相比,培养基间差异明显缩小,最高最低组合相差仅为26.8%,出愈率最好者是M4和M3,分别达81.7%和80.0%,最差的是S4,为25.0%。与盛花后45 d幼胚相比,盛花后55 d幼胚出愈率有较明显下降,说明幼胚发育时间的长短会导致出愈率差异。55 d湖景蜜露幼胚出愈率的总趋势与玉露桃幼胚基本相似,即MS培养基最好,平均达54.7%,TUK最差,为23.4%,而WPM与SH出愈率相近,分别为37.5%和39.3%。与同期玉露幼胚相比出愈率大大下降,以MS为例二者相差23.8%,说明湖景蜜露桃出愈能力低于玉露桃(图版Ⅰ-1,2)
|
|
|
图 1 基本培养基类型、激素对桃幼胚愈伤组织诱导的影响 Fig. 1 Effect of basic media and hormone on the callus induction from immature embryos of peach |

|
Ⅰ 吴延军等:桃幼胚及幼胚子叶再生的研究 Plate Ⅰ Wu Yanjun et al.:Plantlets Regeneration from Immature Embryos and Cotyledons of Peach |
3种激素对试材出愈率影响的研究表明(图 1B、C、D):2, 4-D为1.5 mg·L-1时,盛花后45 d的玉露桃幼胚出愈率最高,达68.9%,但各浓度间出愈率差异不显著; 2, 4-D浓度为1.0 mg·L-1时,盛花后55 d的湖景蜜露桃幼胚出愈率最高,达59.7%,各浓度间差异不显著且各水平均较低(37.1%~41.8%)。说明不同浓度2,4-D对供试幼胚诱导愈伤组织的影响很小。BA为0.25 mg·L-1时,45 d玉露桃幼胚出愈率最高,达到72.0%,但出愈率与BA为0 mg·L-1时无差异。55 d玉露桃幼胚出愈率对BA浓度变化不敏感,平均值均在60%左右。BA为0.5 mg·L-1时,55 d湖景蜜露桃幼胚出愈率最好,达51.9%;0.75 mg·L-1时最差,仅为24.9%。这说明BA对湖景蜜露桃幼胚出愈率影响较大。NAA对45 d玉露桃幼胚出愈率受浓度的影响较大,NAA 1.0 mg·L-1时出愈率达到76.7%,而1.5 mg·L-1时反而下降。NAA对55 d玉露桃幼胚出愈率以0.5 mg·L-1时最高,但总体规律不明显; NAA为1.0 mg·L-1时55 d湖景蜜露桃幼胚出愈率最低,为27%。由此可见,激素对不同品种不同发育时期桃幼胚愈伤组织诱导效果不同,NAA 1.0 mg·L-1对45 d、0.5 mg·L-1对55 d玉露桃,0.5 mg·L-1 BA对55 d湖景蜜露桃效果较好,在试验浓度范围内2,4-D对2个品种幼胚出愈率均无明显效果。
2.1.2 愈伤组织再分化将盛花后45 d玉露桃幼胚愈伤组织接入分化培养基,愈伤组织将会陆续分化。由表 3可看出,愈伤组织分化成芽最好的培养基为5号,分化率为40.0%,其次为3号和6号,分化率分别为36.7%和37.2%(图版Ⅰ-3~5)。
|
|
结果如表 4所示,TDZ是苯脲类细胞分裂素,浓度升高至3.0 mg·L-1时不定芽再生率最好,高浓度TDZ上不定芽易发生玻璃化(图版Ⅰ-6~7)。
|
|
受伤的组织、器官或细胞可以感染农杆菌,为了提高基因的遗传转化率,应最大限度地使外植体受伤。为此试验中将幼胚子叶作损伤处理后培养在M8号培养基(MS+10.0 mg·L-1 BA+0.50 mg·L-1 NAA)上,结果表明损伤方式对子叶不定梢发生有较大影响(表 5),子叶带胚芽刻伤培养效果最好,不定芽诱导率达80%以上,子叶带胚芽和不带胚芽间的再生率有明显差异; 子叶沿中心纵切再生率中等,刻伤与否无显著差异; 幼胚子叶横切3等份,不论是否横向刻伤,不定芽发生率都很低,尤其是不刻伤的近胚芽端和刻伤处理的远胚芽端无任何再生; 子叶横切成薄片、纵切成薄片再生率虽低,但是单个外植体再生的不定芽或不定梢却很多,横切者有32个外植体变褐死亡(图版Ⅰ-8~15)。
|
|
不定梢移入生根培养基,先在IBA 0.5 mg·L-1的1/2 MS培养基上培养15 d(未生根),转入IBA 1.0 mg·L-1的1/2MS培养基上培养5 d后发根, 最终30个不定芽有19株可以发根,发根率达63.4%,单个不定梢平均发根2~3条(图版Ⅰ-7)。
3 讨论桃经分化途径再生一直是组培上的难题,目前仅有少量研究报告。胚发育时间影响愈伤组织诱导率,幼胚组织比成熟胚易于诱导愈伤组织(Hammerschlag et al., 1985; 张永庆等,2001)。花后56 d幼胚比完全成熟的胚易于诱导愈伤组织(Hammerschlag et al., 1985)。经预试验发现发育55 d后(含55 d)的幼胚愈伤组织诱导能力随幼胚发育时间延长诱导率下降,此结果与前人相似。为了提高诱导率将幼胚的发育时间继续缩短,但若发育时间很短则不易操作,同时也有可能会降低诱导率,因之选择盛花后45 d和55 d的幼胚为试材。品种影响诱导率,品种Sunhigh花后56 d幼胚能诱导出13%的疏松愈伤组织,这些愈伤组织可诱导出45%的结球愈伤组织,Suncrest品种的比例分别为18%和33%(Hammerschlag et al., 1985)。‘京艳’和‘大久保’比‘绿化9号’和‘晚蜜’诱导愈伤组织的能力强(闫国华等, 2002)。本试验说明玉露盛花后55 d幼胚比同期湖景蜜露出愈率高。这表明桃幼胚诱导愈伤组织的能力品种间有一定差异。桃愈伤组织的诱导可能是其再生困难的因子之一。本试验采用正交设计,试验大大简化,能方便快速地得到大量愈伤组织,最高诱导率达96.6%,且90%以上都是淡黄色、质地疏松并可诱导结球状愈伤组织,这为获得高频再生提供了前提条件。
基本培养基类型是影响幼胚诱导愈伤组织最主要的因素,MS适合供试材料培养,这可能与培养基的成分有关。MS培养基中NO3-离子的含量远远高于WPM、SH和TUK的,维生素含量低于SH和TUK。各培养基在K和Cu等元素上也存在差异。究竟是哪种成分造成出愈率差异还有待进一步研究。激素的种类和浓度,对不同植物幼胚的继续发育有重要作用。在桃幼胚愈伤组织诱导中使用过多种激素(吴延军等,2002)。本试验证明在供试范围内不同浓度2,4-D对幼胚出愈率作用不大,NAA和BA浓度因试材有差异。
目前报告愈伤组织最高分化率为73.8%(张永庆等,2001),本试验分化率最高仅达40%,仍然较低。这可能与供试品种不同有关,也有可能与幼胚诱导愈伤组织的培养时间及发育程度有关。愈伤组织移入分化培养基7 d后,就有个别愈伤组织分化产生芽,这说明虽是接种的同一批愈伤组织,培养时间相同但发育程度并不同步。此外,可能存在愈伤组织移入分化培养基时已错过最佳的分化时期,表现出分化率低或培养基不适合。这可能也是影响再分化的因素之一。愈伤组织的发育程度有可能成为除培养基类型外影响再生的另一关键。发育到何种程度的愈伤组织、愈伤组织培养多长时间是移接到分化培养基的最佳时期,如何诱导发育阶段同步、整齐的愈伤组织等问题成为下一步研究的重点之一。
桃经愈伤组织诱导和体细胞胚胎发生完成植株再生的研究报告一直集中于幼胚这一幼嫩有性材料。幼胚作为外植体,分化率稍好,但取材受季节限制,采样极为集中,这给研究造成许多不便,增加培养难度。成熟胚或成熟子叶取材虽易,但分化率极低,不是良好的外植体类型。与幼胚相比幼胚子叶取材容易,取材时间适当延长,分化不定芽所需时间周期短,步骤少,且多以直接再生出芽为主,减少了培养变异发生,是较好的外植体类型。
经前期预试验证明45 d幼胚子叶比55 d的易于再生,玉露桃比湖景蜜露桃易于再生,BA与NAA的组合并不能显著提高幼胚子叶的再生率(吴延军等,2003)。在本文中选择盛花后45 d玉露桃,扩大BA和NAA的组合增加TDZ并提高操作技能,进一步开展试验。本试验在诱导幼胚子叶不定芽形成时使用NAA和BA组合,分化率比前次均有提高,增加的BA12.5和15.0 mg·L-1(NAA均为0.5 mg·L-1),分化率分别达70.0%和65.6%,BA为10.0 mg·L-1时分化率达83.3%,分化效果较好。TDZ和NAA组合,最高分化率达88.3%,再生率高。
农杆菌可以感染受伤的组织、器官或细胞,应最大限度地使外植体受伤以期获得较高遗传转化率。因之需经试验选择再生率较高的损伤方式。幼胚子叶损伤方式对再生能力影响的试验表明损伤方式不同再生能力有差异,损伤方式处理的最高再生率为81.4%,与未做处理的83.3%相近,农杆菌感染时可以选择此损伤方式。子叶切成薄片再生率不到20%,但单个外植体再生芽较多,尤其是横切薄片平均可达6.81个,这可能是横切薄片较易再生,试验中却被置于不适合的分化培养基,表现分化率较低。因此需进一步试验,有望得到适宜幼胚子叶培养的另一程序,进一步提高再生率。
李春喜, 王文林. 1997. 生物统计学. 北京: 科学出版社.
|
吴延军, 徐昌杰, 张上隆. 2002. 桃组织培养和遗传转化研究现状及展望. 果树学报, 19(2): 123-127. |
吴延军, 张上隆, 张岚岚, 等. 2003. 桃幼胚子叶不定芽发生的初步研究. 浙江大学学报, 29(2): 93-96. DOI:10.3785/j.issn.1008-9292.2003.02.021 |
闫国华, 周宇. 2002. 桃幼胚下胚轴高频植株离体再生. 果树学报, 19(4): 231-234. |
张永庆, 陈大明, 张上隆, 等. 2001. 桃离体组织培养分化再生植株的研究. 园艺学报, 28(4): 342-344. DOI:10.3321/j.issn:0513-353X.2001.04.013 |
Byrne D H. 2002. Peach breeding trends: a world wide perspective. Acta Hort, 592: 49-58. |
Hammerschlag F A, Bauchan G, Scorza R. 1985. Regeneration of peach plants from callus derived from immature embryos. Theor Appl Genet, (70): 248-251. |
Mante S, Scoria R, Cordts J M. 1989. Plant regeneration from cotyledons of Prunus persica, Prunus clomestica and Prunus cerasus. Plant cell Tissue and Organ Culture, 19(1): 1-11. DOI:10.1007/BF00037771 |
Pooler M R, Scorza R. 1995. Regeneration of peach [Prunus persica (L.) Batsch] rootstock cultivars from cotyledons of mature stored seed. HortScience, 30(2): 355-356. |
Riaao M, Bassi D, Byrne D, et al. 1998. Growth of immature peach [Prunus persica (L.) Batsch] embryos on different media. Acta-Horticulturae, 465: 141-144. |
Scorza R M, Cordts S M. 1990. Long-term somatic embryo productionand plant regeneration from embryo-drived peach callus. Acta-Horticulturae, 280: 183-284. |
 2005, Vol. 41
2005, Vol. 41