文章信息
- 陈礼光, 郑郁善, 李庆荣, 张祝金.
- Chen Liguang, Zheng Yushan, Li Qingrong, Zhang Zhujin.
- 肉桂离体胚超低温保存研究
- Study of Cryopreservation on Cinnamomum cassia Excised Embryos
- 林业科学, 2005, 41(5): 38-44.
- Scientia Silvae Sinicae, 2005, 41(5): 38-44.
-
文章历史
- 收稿日期:2004-06-03
-
作者相关文章
肉桂(Cinnamomum cassia)是一种在常温下既不耐脱水又不耐贮藏(Rorberts,1973)的高含水量顽拗性种子(recalcitrant seeds)。人们通常在种子采收后将种子与湿润物充分混合后贮藏延长其寿命,以达到短期(一般只有几周到几个月)贮藏的目的(傅家瑞,1991; 陈建勋等,1999)。如何长期有效地保存顽拗性种子已经日益受到国内外种质资源工作者的重视。超低温保存,又称液态氮(LN2)保存,目前被认为是最有希望的途径(郑郁善等,2001; 殷晓辉等,1996; 陈礼光等,2001)。然而在国内,超低温保存技术用于林木种子保存的研究为时尚短(陆旺金等,1998),供试种类又少,这就给成功地长期保存林木种子造成很大困难。许多研究认为,在-196 ℃低温下,种子的一切生理代谢和分裂活动基本上处于静止状态(Mantell et al., 1983),种子保存时间长短对种子活力无显著影响(徐刚标等,1998; 吴永杰等,1999)。通过适度脱水来避免或减轻在冷冻或解冻过程中的低温伤害是超低温保存成功的关键(Fu et al., 1993; Ruhl et al., 1988)。和种子相比,种胚具有较高的脱水耐性和较弱的低温敏感性,而且蕴含了种子绝大部分的遗传信息,体积小,是超低温保存的理想材料(Chandel et al., 1995; Pence, 1992; Grout et al., 1983)。本文以肉桂离体胚为对象,研究超低温保存后脱氢酶活性、电导率、α-淀粉酶活性,为肉桂种子的长期保存提供理论依据。
1 研究材料和方法 1.1 材料2003年在福建华安金山林场的肉桂人工林内采集种子,室内消毒湿藏备用。在不伤及胚的前提下,在种胚部位切取约5 mm×5 mm×5 mm的胚块,制备离体胚。
1.2 方法 1.2.1 离体胚含水量(简作MC)根据《国际林木种子检验规程》(国际种子检验协会,1999)规定,将离体胚切碎,采用(105±2) ℃烘8 h测定相对含水量:ω0=(鲜质量-绝干质量)/鲜质量×100%。用30 ℃+硅胶法制备离体胚各种含水梯度,使其含水量降至50%、45%、40%、35%、30%和20%,失水过程中经常更换硅胶,采用减重法来换算:
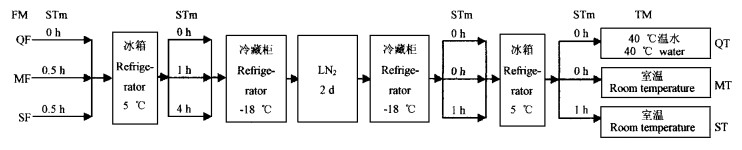
以未经超低温保存为对照(CK),采用L8(41×24)和L18(61×36)正交试验设计(洪伟,1991)进行因子水平安排(表 1,表 2),其中L18(61×36)正交试验设计包含防冻剂预处理试验,经各种冷冻流程,接着将各处理投入到液态氮保存2 d,然后进行解冻处理(图 1),处理后测定脱氢酶活性、电导率和α-淀粉酶活性。
|
|
|
|
|
图 1 冷解冻流程 Fig. 1 Freezing and thawing process 冷冻方式Freezing methods; TM:解冻方式Thawing methods; STm:停留时间Staying time; QF:快冻Quick freezing; MF:缓冻Mild freezing; SF:慢冻Slow freezing; QT:快解Quick thawing; MT:缓解Mild thawing; ST:慢解Slow thawing.下同。The same below. |
采用TTC(2,3,5-三苯基四氮唑)染色法(黄学林等,1990)。每个处理4个重复,每个重复30个离体胚,用0.1%(w:v)TTC溶液,在35 ℃黑暗条件下保温染色6 h,按“TTC定位图形法”作肉桂种子生活力鉴定。然后再加丙酮及少许分析纯石英充分研磨,用丙酮冲洗研钵2~3次,合并洗涤液倒入10 mL离心管中,于4 000×g条件下离心10 min。取上清液在490 nm波长下用72-1型分光光度计测定OD490值,从标准曲线中查出相应的还原态TTC含量。脱氢酶活性以每30个种胚中含有TTC还原物含量,即三苯基甲NFDA6 (TTCH)含量(μg·mL-1)表示。
1.2.4 电导率测定DDS-307型电导率仪测定法(黄学林等,1990)。选择大小均匀、颗粒饱满、无损伤的肉桂离体胚,用蒸馏水冲洗干净后,加入50 mL蒸馏水,在恒温箱中浸泡8 h后,先测在25 ℃条件下的电导率(S1)。然后将浸泡液连同离体胚在沸水中煮15 min,冷却至25 ℃左右后再测定电导率,称之为绝对电导率(S2),以不加种子的蒸馏水为空白对照。然后计算相对电导率:Sr =S1/S2×100%。
1.2.5 α-淀粉酶活性测定I2-KI显色法(黄学林等,1990)。处理的肉桂离体胚,剥取种胚30个,用5 mL醋酸研磨缓冲液将其研磨成匀浆,再用5 mL醋酸研磨缓冲液冲洗。并将其移至试管中,在70 ℃恒温水浴20 min,同时不断振荡试管,使其充分反应。在4 000×g离心5 min。将上清液用研磨缓冲液定容至10 mL作为酶试剂。吸取1 mL酶制剂放入试管,然后加入1 mL反应缓冲液和1 mL淀粉溶液,摇匀后放在37 ℃恒温中加热0,5和10 min,再分别吸取0.3 mL反应混合液放入试管中,迅速加入1 mL显色剂和3 mL蒸馏水,充分混合,测OD620(0),OD620(5),OD620(10)值。淀粉酶活性用单位时间(min)内水解淀粉的质量数(mg)表示。
2 结果与分析 2.1 脱氢酶活性分析脱氢酶是种子呼吸过程中的一种重要的还原酶,其活性的高低与种子的发芽力密切相关(Throneberry et al., 1955),与种子的呼吸强度呈正相关。脱氢酶活性的迅速下降,常伴随着种子发芽力的迅速丧失(郑光华,1985; 郑郁善,2002)。所测脱氢酶活性反映了细胞代谢的还原能力和离体胚损伤程度,是种子活力的重要生化指标。
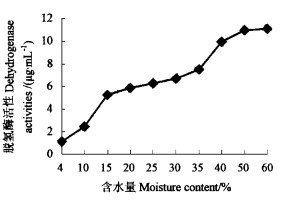
2.1.1 超低温保存前脱氢酶活性肉桂离体胚在30 ℃+硅胶条件下干燥过程中,随脱水程度的加深,其TTCH含量不断降低,新鲜的肉桂离体胚TTC含量最高,每30个胚达到11.051 μg·mL-1,表明脱氢酶活性强,种子代谢能力强; 含水量在15%~30%这个范围内,TTCH含量降幅较小,且能够维持在较高水平,表明所受的伤害较小,其活性比较大。当含水量小于15%时,肉桂离体胚造成严重的脱水伤害,TTCH含量急剧下降,此时已不适合贮藏(图 2)。方差分析表明:F=307.155>F0.01(9, 30)= 3.066,含水量因素造成的差异达极显著水平。因此,肉桂离体胚耐脱水性弱,属高顽拗度种子(Farrant et al., 1988)。
|
图 2 不同含水量肉桂离体胚脱氢酶活性 Fig. 2 Dehydrogenase activities of C. cassia excised embryos with various moisture content |
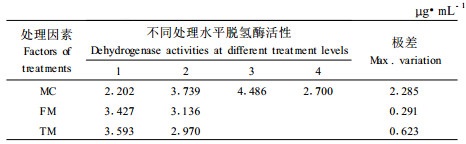
按照L8(41×24)正交设计,将10%、15%、20%和自然含水量离体胚进行超低温保存试验。结果表明:超低温保存对离体胚的含水量有极大的影响,4个水平间的最大差异为2.285(表 3),经方差分析(表 4),F=301.429>F0.01(3, 2)=99.2,表明各含水量之间差异达到极显著水平; 解冻方式也达到极显著水平,F=110.857>F0.01(1, 2)=98.5,说明解冻方式对超低温保存是一个重要因素; 冷冻方式差异达显著水平。可见,含水量是关键因素,肉桂离体胚含水量为30%~40%能够维持较高的脱氢酶活性,当含水量为40%时其脱氢酶活性最高,表明种子所受的伤害最小,其活力最强。在冷冻方式中,缓冻和快冻方式脱氢酶活性非常接近; 在解冻方式中,快解方式的脱氢酶含量较高。因此快冻快解组合的方式使体胚维持较高的脱氢酶活性(4.486 μg·mL-1)。
|
|
|
|
肉桂种子在超低温保存过程中,由于其耐脱水能力差,其保存含水量高,以30%~40%为宜。正因如此,加大了肉桂离体胚超低温保存难度,主要是因为其保存含水量相对较高,在进行超低温保存时降温和升温过程中易受低温伤害。
2.1.3 防冻剂预处理超低温保存肉桂离体胚脱氢酶活性为了尽可能减轻甚至避免肉桂离体胚在超低温保存过程受到低温伤害,采取适当的措施是必需的。其中常用的方法之一就是进行防冻剂预处理。按照L18(61×36)正交设计进行防冻剂预处理后肉桂离体胚超低温保存试验,处理因素包括含水量、冷冻方式、解冻方式和防冻剂(包括甘油、二甲亚砜和聚乙二醇)6个因素,试验结果见表 5和表 6。
|
|
|
|
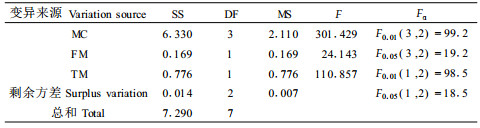
防冻剂预处理后进行超低温保存,肉桂离体胚脱氢酶活性随含水量的变化而变化,在不同含水量之间,其活性的差异达极显著水平,F=163.733>F0.01(5, 2)=99.3。含水量在30%~40%的肉桂离体胚脱氢酶活性变化比较平缓,处于5.594~5.843 μg·mL-1,与其他含水量水平相比,其活性较高。另外,自然含水量的脱氢酶活性有了明显的降低。这说明高含水量种子在超低温处理过程中受到明显的低温伤害。但是与没有防冻剂处理的相比,其受伤害程度较小,这是因为防冻剂起了保护作用,有效地减轻了低温伤害。
冷冻方式也有显著影响,F=35.083>F0.05(2, 2)=19.0,在防冻剂中二甲亚砜的影响最明显,F=22.333>F0.05(2, 2)=19,达显著水平,而甘油和蔗糖的影响不明显。25%含水量的离体胚,在添加10%DMSO+10%Gly+15%PEG及缓冻-快解的处理方式中,其脱氢酶活性平均值最大,为5.594 μg·mL-1,表明其活性最高,最适合超低温保存。
2.2 电导率变化规律前人研究发现,细胞结构的完整性是种子活力的基础(傅家瑞,1985),当种子老化劣变时,细胞膜受到损伤,膜透性增大,电解质外渗,水浸液电导率上升(彭幼芬等,1994)。电解质最初外渗属于被动扩散,随后的渗出量大小才是反映了细胞膜的损伤程度(张保恩等,1999)。不同活力的种子,外渗量的多少可以测定电导率或相对电导率来反映。种子活力大小与电导率的高低一般呈负相关,活力高的种子,其膜修补能力强,电解质外渗量少,积累速度慢,活力弱的种子则反之(郑郁善,1989)。
2.2.1 超低温保存前不同含水量的肉桂离体胚电导率变化规律未经超低温处理的肉桂离体胚的电解质渗漏量的大小随含水量的不同而不同。一般情况下,电导率随含水量的降低而升高,新鲜种子的相对电导率仅为16.59%,细胞膜具有良好的完整性,选择吸收性强,透性较小; 含水量在20%~40%电导率变化比较平缓,其相对电导率为34.83%~39.10%,表明离体胚细胞膜受到一定程度的损伤,经过吸胀修复,膜功能得以恢复; 而低于15%含水量时,已经表现出明显的脱水伤害,细胞膜受到极大伤害,选择吸收能力几乎丧失,膜透性增强,相对电导率大幅上升(表 7)。
|
|
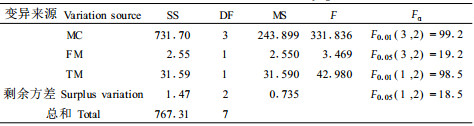
采用L8(41×24)正交试验设计,对20%、25%、30%和自然含水量的肉桂离体胚超低温保存后,方差分析(表 8)结果表明,含水量的影响达到极显著,F=331.836>F0.01(3, 2)=99.2;解冻方式对离体胚的电导率也有较大的影响,达显著水平,F=42.980>F0.05(1, 2)=18.5;而冷冻方式对离体胚电导率的影响并不明显。离体胚含水量30%时用快冻快解方式处理相对电导率最小为41.73%,说明该条件下保存肉桂种子效果最好。
|
|
将含水量分别为30%、35%、40%、45%、50%和自然含水量的肉桂离体胚,加入防冻剂,采用L18(61×36)正交试验设计,进行超低温保存后,结果(图 3)显示,不同含水量的离体胚对多种防冻剂的配合浓度的要求不同,在甘油浓度10%、二甲亚砜5%、聚乙二醇5%的混合防冻剂下,含水量在35%的离体胚相对电导率最小,说明35%的肉桂离体胚在此混合防冻剂浓度下及快冻缓解处理的效果最好。在冷冻解冻的处理中,含水量为35%~40%的离体胚采用缓冻快解和缓冻缓解的处理方式其电导率值较低,说明这种处理对肉桂种子膜系统损伤较小,种子能保持较高的活性。
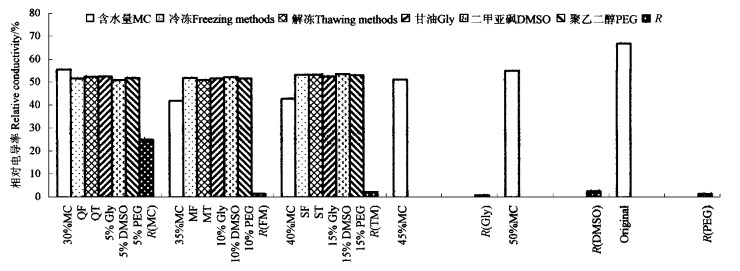
|
图 3 肉桂离体胚超低温保存后电导率极差分析 Fig. 3 Maximum variation of conductivity of C. cassia excised embryos after cryopreservation R:极差Maximum variation. |
种子在萌发过程中,由于本身不能通过光合作用合成碳水化合物,只能依靠分解其子叶或胚乳所贮藏的营养物质来满足种子萌发过程对养分的需求。淀粉酶几乎存在于所有植物中,是在种子萌发时,其贮藏物特别是碳水化合物代谢过程中起重要作用的一种酶。α-淀粉酶活性的高低严重影响种子萌发能力,能够在一定程度上反映种子活力(周丹等,2004)。许多树种种子在萌发初期需大量的淀粉转化为葡萄糖,作为种子萌发生长的营养物质来源。
2.3.1 超低温处理前肉桂离体胚α-淀粉酶活性变化肉桂种子成熟后,由于含水量大,α-淀粉酶仍处于活性状态,代谢旺盛。如果遇到适宜的环境条件,种子就会从成熟过程直接转向萌发过程; 若条件不适宜,种子很容易进入衰老劣变过程。肉桂离体胚α-淀粉酶活性随含水量的下降而降低,新鲜的离体胚其α-淀粉酶活性高,水解的淀粉数为0.380 mg·min-1,而含水量降到15%以下时,α-淀粉酶活性降幅显著增大,这主要是由于含水量越低,脱水时间越长,对细胞的脱水伤害越大,从而表现在水解淀粉的毫克数就越小。
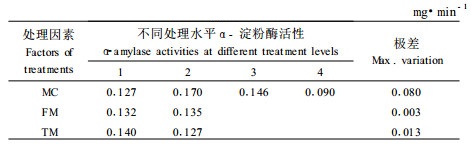
2.3.2 超低温处理后肉桂离体胚α-淀粉酶活性变化对含水量20%、30%、40%和自然含水量的肉桂离体胚,采用L8(41×24)正交试验设计方案进行超低温保存,结果如表 9所示。由于经过超低温处理,高含水量的离体胚受到低温伤害较严重,其活性大大降低,自然含水量的离体胚其α-淀粉酶活性为0.090 mg·min-1,α-淀粉酶活性最大的出现在含水量为30%缓冻快解处理中,为0.170 mg·min-1。冷冻方式对α-淀粉酶活性影响不大,而解冻方式对α-淀粉酶活性影响较大,表现在同一含水量上,快解方式处理的α-淀粉酶活性明显高于慢解方式处理的,因此在保存肉桂种子时,用快冻-快解方式进行液态氮处理,能够更好地维护种子细胞膜的完整性,有效地维持种子的活性。
|
|
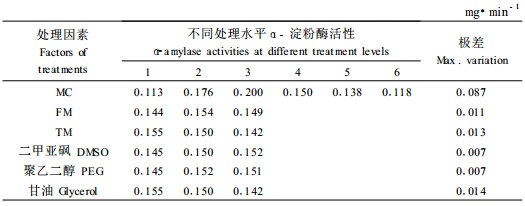
用含水量为30%、35%、40%、45%、50%和自然含水量的肉桂离体胚进行L18(61×36)正交试验设计,进行超低温保存后结果见表 10。由于防冻剂的添加使得冷冻解冻方式对离体胚活性影响变小,极差仅为0.011和0.013 mg·min-1; 而防冻剂中甘油的影响最大,极差为0.014 mg·min-1,聚乙二醇和二甲亚砜的影响较小,极差均为0.007 mg·min-1。在一般情况下,采用缓冻快解方式对肉桂离体胚的保存效果较好。
|
|
种子活力强弱和衰老状况不仅反映在细胞内各种酶活性强弱,而且也反映在细胞膜的完整性。细胞膜不仅是分隔细胞质和胞外环境的屏障,而且也是细胞与环境之间物质交换的主要通道,是细胞受环境胁迫最敏感的部位。宋松泉等(1999;2004)经研究发现,顽拗性种子脱水伤害的位点,主要是膜系统(如质膜、线粒体膜、液泡膜)。因此,肉桂种子超低温保存的技术关键,主要是通过最大限度地保护其各种酶活性和细胞膜的完整性,使种子具备更高的活力和发芽力。
肉桂种子含水量是影响超低温保存成功的最主要因素,当含水量降低到30%~40%时,有较好的抗冻能力,主要表现在含水量降低,脱水伤害较小和细胞保护物质的积累,因而在超低温保存后各项生理生化指标均能达到较好的水平。含水量为20%的肉桂离体胚脱氢酶活性为4.486 μg·mL-1,相对电导率为41.73%,α-淀粉酶活性为0.170 mg·min-1,与超低温保存前相对应的离体胚的脱氢酶活性相近。当含水量下降到15%以下时,超低温保存会造成脱水伤害,细胞膜会因过度脱水而受到损伤。
在超低温保存过程中,防冻剂的使用,有降低肉桂种子冰点的作用,从而使种子免受或降低低温伤害,维持种子各种酶的活性。很多研究表明,一般防冻剂在常温条件下毒性较强,尤其是二甲亚砜,但在0 ℃左右,其对种子或离体胚的毒害作用就会被削弱,很少有叠加性,且在低温下使用适宜浓度的防冻剂组合对保存材料几乎没有任何毒性影响(徐刚标,2000)。使用混合防冻剂的保护作用会比单独使用效果更佳,混合防冻剂的保护作用的大小,主要取决于各种防冻剂的混合比例,在试验过程中寻找最佳防冻剂的混合比例是超低温保存种子的关键。在本次研究中采用10%二甲亚砜+10%甘油+15%聚乙二醇混合防冻剂处理,肉桂离体胚脱氢酶活性最高; 用10%甘油+5%二甲亚砜+5%聚乙二醇混合防冻剂处理,肉桂离体胚的相对电导率最小; 用15%二甲亚砜+10%聚乙二醇+5%甘油混合防冻剂处理,肉桂离体胚的α-淀粉酶活性最高。因此混合防冻剂的使用有效地保护了种子细胞的膜系统的完整,提高了种子的活性。
此外,防冻剂能够更好地超低温保存肉桂离体胚,其最适宜保存含水量为30%~40%。在冷冻解冻方式中,没使用防冻剂处理的条件下,以快冻快解的处理方式离体胚各项生理生化指标较好; 加入防冻剂后,以缓冻快解效果最好,且各项生理生化指标均优于没有防冻剂预处理。因此,寻求各种防冻剂的最佳混合比例,将是今后超低温保存种子的研究方向和必然趋势。
综上所述,肉桂离体胚的超低温保存,需将含水量降低到一定水平,30%~40%之间,并在0 ℃冰浴条件下添加防冻剂,来协调脱水,避免形成冰晶,保护细胞膜不受损伤,才能使超低温保存达到良好的效果。
陈建勋, 谢治芳. 1999. 板栗贮藏过程中的生理生化变化初探. 华南农业大学学报, 20(4): 70-74. |
陈礼光, 郑郁善, 邱尔发, 等. 2001. 米槠和苦槠超低温保存材料细胞膜代谢特征研究. 林业科学, 37(sp.1): 137-142. |
傅家瑞. 1985. 种子生理. 北京: 科学出版社, 397-398.
|
傅家瑞. 1991. 顽拗性种子. 植物生理学通讯, 27(6): 402-406. |
国际种子检验协会(ISTA)编.浙江大学种子科学中心译. 1999.1996国际种子检验规程.北京: 中国农业出版社, 15-18
|
洪伟. 1991. 林业试验设计技术与方法. 北京: 科学技术出版社.
|
黄学林, 陈润政. 1990. 种子生理实验手册. 北京: 农业出版社, 125-127.
|
陆旺金, 金剑平, 向旭, 等. 1998. 黄皮种子的保湿贮藏及胚轴的超低温保存. 华南农业大学学报, 19(1): 7-11. |
彭幼芬, 王文章. 1994. 种子生理学. 湖南: 中南工业大学出版社, 158-183.
|
宋松泉, Berjak P, Pammenter N. 2004. Trichilia dregeana胚轴的脱水敏感性与抗坏血酸的抗氧化作用. 植物学报, 46(7): 803-810. DOI:10.3321/j.issn:1672-9072.2004.07.007 |
宋松泉, 陈玲, 傅家瑞. 1999. 种子脱水耐性与LEA蛋白. 植物生理学通讯, 35(5): 424-432. |
吴永杰, 赵艳华, 周明德. 1999. 苹果休眠茎尖的超低温保存研究. 华北农学报, 14(1): 129-133. DOI:10.3321/j.issn:1000-7091.1999.01.026 |
徐刚标, 陈良昌. 1998. 植物种质超低温保存. 经济林研究, 16(2): 51-53. |
徐刚标. 2000. 植物种质资源离体保存研究进展. 中南林学院学报, 20(4): 81-80. DOI:10.3969/j.issn.1673-923X.2000.04.008 |
殷晓辉, 舒理慧. 1996. 植物种质资源的保存研究进展. 热带亚热带植物学报, 4(3): 75-82. |
张保恩, 黄学林. 1999. 种子吸胀期间的泄漏物与活力的关系. 植物生理学通讯, 35(3): 231-235. |
郑光华. 1985. 国外应用种子活力测定的概况. 种子, (6): 28-30. |
郑郁善, 陈礼光, 李庆荣, 等. 2002. 板栗种子超低温保存研究. 林业科学, 38(2): 146-149. |
郑郁善, 陈礼光, 邱尔发. 2001. 超低温保存锥栗种子的生理生化特性研究. 林业科学, 37(6): 39-44. DOI:10.3321/j.issn:1001-7488.2001.06.008 |
郑郁善. 1989. 电导法测定林木种子活力的研究. 福建林学院学报, 9(2): 199-202. |
周丹, 孙传清, 屠乃美. 2004. 谷类种子休眠性的研究进展. 湖南农业大学学报(自然科学版), 30(6): 588-592. |
Chandel K P S, Chaudhury R, Radhamani J, et al. 1995. Desiccation and freezing sensitivity in recalcitrant seeds of tea, cocoa and jackfruit. Annals of Botany, 76: 443-450. DOI:10.1006/anbo.1995.1118 |
Farrant J M, Pammenter N W, Berjak P. 1988. Recalcitrant—a current assessment. Seeds Science and Technology, (16): 155-166. |
Fu J R, Xia Q H, Tang F. 1993. Effects of desiccation on excised embryonic axes of three recalcitrant seeds and studies on cryopreservation. Seed Sci & Technol, 21: 85-95. |
Grout B W W, Shelton K, Pritchard H W. 1983. Orthodox behavior of oil palm seed and cryopreservation of the excised embryo for genetic conservation. Annals of Botany, 52(3): 381-384. DOI:10.1093/oxfordjournals.aob.a086586 |
Mantell S H, Smith H. 1983. Plant Biotechnology. Cambridge: Cambridge University Press, 163-186.
|
Pence V C. 1992. Desiccation and and the survival of Aesculus, Castanea and Quercus embryo axes through cryopreservation. Cryobiology, 29: 391-399. DOI:10.1016/0011-2240(92)90040-9 |
Roberts E H. 1973. Predicting the storage life of the seeds. Seeds Science and Technology, (1): 499-514. |
Ruhl G, Dambroth M, Biehl B. 1988. Investigations on the causes of sensitivity to cold and drying of tropical seeds with cocoa as an example Ⅱ. Dehydration parameters and exudation of drying cocoa seeds and seed organs. Seed Sci and Techno, 38(3): 235-251. |
Throneberry G O, Smith F G. 1955. Relation of respiration and enzymatic activity to corn seed viability. Pl Physiol, 30: 337-343. DOI:10.1104/pp.30.4.337 |
 2005, Vol. 41
2005, Vol. 41