文章信息
- 阮晓, 王强, 许宁一, 李建贵, 黄俊化.
- Ruan Xiao, Wang Qiang, Xu Ningyi, Li Jiangui, Huang Junhua.
- 白梭梭同化枝对干旱胁迫的生理生态响应
- Physio-Ecological Response of Haloxylon persicum Photosynthetic Shoots to Drought Stress
- 林业科学, 2005, 41(5): 28-32.
- Scientia Silvae Sinicae, 2005, 41(5): 28-32.
-
文章历史
- 收稿日期:2004-12-28
-
作者相关文章
2. 新疆农业大学林学院 乌鲁木齐 830052
2. College of Forest, Xinjiang Agricultural University Urumqi 830052
白梭梭(Haloxylon persicum)是一种典型的沙生荒漠植物,多分布在流动、半流动沙地或沙丘上,是中亚西部荒漠亚区成分,分布区较为狭窄。干旱是荒漠地区最基本的生态环境特征,白梭梭与其他荒漠植物一样,在极其严酷的荒漠环境中表现出特有的抗旱适应能力,被称为超旱生植物,是西部干旱地区主要固沙树种,也是我国抗旱生物种质资源库中的重要成员,极好的抗旱生理学研究样本(张立运, 2002)。
植物体内的脯氨酸含量与植物的抗逆性密切相关,在干旱胁迫下,植物体内迅速累积脯氨酸,通过渗透调节作用来维持细胞一定的含水量和膨压势,从而增强植物的抗旱能力和抗逆性(Hakimi et al., 1995; Singh et al., 1972)。可溶性糖含量高也有利于植物适应干旱生境(徐东翔等, 1990; 汤章城, 1998)。脱落酸(abscisic acid, ABA)是一种对植物生长、发育、抗逆性、气孔运动和基因表达等都有重要调节功能的植物激素,在水分亏缺时,ABA的一个重要生理功能就是促进离子流出保卫细胞从而降低保卫细胞膨压,诱导气孔关闭,降低水分损耗,增加植物在干旱条件下的保水能力(Rock et al., 1999; Leckie et al., 1998)。Jackson等(1995)认为气孔导度与木质部ABA浓度成指数相关关系。而Heckenberger等(1996)研究发现,向日葵(Helianthus annuus)叶片饲喂ABA后,外源ABA浓度和气孔导度之间存在对数关系。土壤干旱在叶细胞膨压降低之前引起气孔导度下降和叶片生长受到抑制(Cramer, 1994; Dodd et al., 1996; Gowing et al., 1992; Puliga et al., 1996)。水分胁迫下棉花(Gossypium hirsutum)叶片生长素(indole-3-acetic acid, IAA)、ABA含量上升并导致脯氨酸积累(袁朝兴等, 1990)。ABA与细胞分裂素(cytokinin, CTK)比值调节气孔开度的生理作用已有大量报道(马宗仁等, 1993)。不同浓度ABA与CTK组合处理后,燕麦(Avena spp.)幼苗脯氨酸积累不同,ABA/CTK比值大于1,脯氨酸发生积累,反之则不积累(聂朝相等, 1994)。
本文通过对超旱生植物白梭梭在自然水分胁迫条件下,生长发育过程中内源激素、可溶性糖、脯氨酸、叶绿素和气孔导度随季节变化的检测,分析了该种植物对干旱胁迫做出响应以适应环境变化的生理过程,探讨了植物能够在干旱沙漠中生存的生理生态机制。
1 试验材料和方法 1.1 研究地概况研究样地选在新疆维吾尔自治区奇台县以东(89°50′—89°56′E,44°8′—44°20′N)的奇台荒漠草原保护站,地处古尔班通古特沙漠的中南边缘带。年均降水量为150~167 mm,蒸发量2 141 mm,无霜期平均156 d,年日照2 840~3 230 h,极端高温41 ℃。供试植物自然生长在保护区无灌溉条件下的沙丘上。
1.2 试验材料设3个典型样地,每个样地挑选5棵树龄相同、健康植株标记并取样。5月初至8月底,每2周于晴朗无风日,选择当年生新枝冠层上部向阳方向的成熟同化枝约800 g,测定内源激素、脯氨酸、叶绿素等含量。
1.3 试验方法 1.3.1 气孔导度的测定采用LI-6200型便携式气体分析系统(LI-COR Inc, Nebraska, USA)测定,气孔导度、光量子通量密度等参数由该系统存储器直接获得。参数测定日均7次(分别于当日北京时间8:00、10:00、12:00、14:00、16:00、18:00和20:00测定,北京时间与当地时间有2 h时差),取平均值。同化枝面积的测定采用LI-3000A叶面积仪测定(LI-COR Inc)。
1.3.2 植物激素IAA、GA3、ABA、CTK的测定样品提取:样品(5 g)中加入30 mL 0.5 mol·L-1的NaOH, 12 000×g离心10 min,取上清液; 加入20 mL乙酸乙酯,8 000×g离心分液取水相; 加入1 mol·L-1 HCl, 调pH至2.0, 加30 mL乙酸乙酯,8 000×g离心分液取酯相; 40 ℃减压蒸馏,以10%乙腈定容至1.5 mL,用于HPLC分析。
样品检测:参照谈峰(1986)、陈雪梅等(1992)的方法并作改进,在岛津高效液相色谱仪CTO-6A上检测。
色谱条件:色谱柱为CLC-C8, 检测器为UV-VIS检测器,检测波长250 nm。二元梯度洗脱:A泵pH 3.0, 10%乙腈; B泵60%乙腈。外标法定量。标准物质保留时间GA3 6.338 min, IAA 9.965 min, CTK 11.189 min, ABA 17.763 min, 回收内标22.569 min。
1.3.3 游离脯氨酸的测定氰酸盐-水合茚三酮比色法(邹琦, 1995)。
1.3.4 可溶性糖的测定蒽酮比色法(薛应龙, 1985)。
1.3.5 叶绿素的测定同化枝用80%丙酮浸提, UV-265分光光度计比色。
1.3.6 同化枝含水量的测定采用烘干称重法。采集白梭梭成熟同化枝,于80 ℃烘至恒重,按下式计算同化枝含水量:含水量=[(鲜质量-干质量)/鲜质量]。
1.3.7 土壤含水量的测定在白梭梭样株附近挖取土壤剖面,在0~100 cm土层范围内每10 cm取样一次,重复3次。土壤含水量(0~100 cm土层含水量均值)采用烘干法测定。
2 结果与分析 2.1 同化枝干旱胁迫季节适应特性白梭梭在5月下旬至6月上旬开花,花期半个月。由图 1、表 1可见,开花期间5月31日、6月14日土壤含水量分别为28.7、31.2 g·kg-1, 同化枝含水量最高,分别达到652、574 g·kg-1。气孔导度最大分别为0.48、0.46 mol·m-2s-1,同化枝处于轻度干旱胁迫状态; 花期过后高温干旱的夏季来临,白梭梭进入花后生殖休眠期(张立运,2002),6月29日土壤含水量为11.6 g·kg-1,同化枝含水量下降为497 g·kg-1,气孔导度也迅速降为0.3 mol·m-2s-1,7月12日、26日气孔导度继续降为0.23、0.25 mol·m-2s-1,此期间土壤含水量分别为10.7、9.8 g·kg-1,同化枝呈现萎蔫,处于重度干旱胁迫状态; 直至8月以后秋季到来,植物蒸腾强度有所减弱,同化枝含水量为500 g·kg-1左右,8月9日、22日土壤含水量分别为15.6、18.7 g·kg-1,同化枝气孔导度又恢复为0.31、0.33 mol·m-2s-1,虽仍处于重度干旱胁迫下,但同化枝开始舒展,萎蔫程度明显减弱。
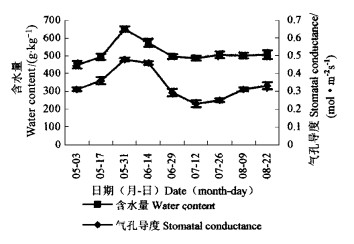
|
图 1 白梭梭同化枝含水量、气孔导度的季节变化 Fig. 1 Seasonal changes of water content and stomatal conductance in H. persicum photosynthetic shoot |
|
|
白梭梭同化枝渗透调节物质脯氨酸、可溶性糖浓度的季节变化特性见图 2,5月31日至6月29日白梭梭开花期,同化枝可溶性糖含量处于其生长发育过程的最低水平(9.17 mg·g-1DW),而叶绿素含量达到最高水平(91.2 mg·cm-2), 脯氨酸含量也开始略有上升; 6月29日至7月12日,可溶性糖、脯氨酸迅速积累,7月12日较6月29日其含量分别增长为5倍和2倍,而叶绿素含量迅速降为70.4 mg·cm-2的较低水平; 7月26日可溶性糖、脯氨酸继续积累为其最低水平(6月29日)的5.5倍和2.7倍,随后直至8月22日均保持在较高水平,而叶绿素则维持在较低浓度水平。

|
图 2 白梭梭同化枝叶绿素、可溶性糖和脯氨酸含量的季节变化 Fig. 2 Seasonal changes of chlorophyll, soluble sugar and proline content in H. persicum photosynthetic shoot |
植物开花期间,可溶性糖作为营养物质从同化枝转移到花器官,降低了同化枝中可溶性糖的含量。而此时同化枝处于轻度水分胁迫状态(同化枝含水量574~652 g·kg-1),脯氨酸含量先于可溶性糖含量略有上升。6月29日至7月26日盛夏期间,同化枝处于重度水分胁迫状态(同化枝含水量487~506 g·kg-1),可溶性糖与脯氨酸迅速积累,通过渗透调节作用适应干旱胁迫。随后可溶性糖与脯氨酸含量持续保持较高水平状态,未出现明显下降趋势。
2.3 干旱胁迫下同化枝内源激素水平的季节变化特性白梭梭同化枝生长发育过程中,4种内源激素水平呈现季节变化特性。由图 3可见,白梭梭同化枝生长发育初期(5月3日至31日),GA3、IAA、CTK浓度均处于生长发育过程的较高水平; 5月31日至6月29日盛花期,GA3、IAA、CTK均呈现明显下降趋势,并保持在较低水平状态,而ABA含量略有上升,调节适应此期间的轻度干旱胁迫; 6月29日至7月26日盛夏期间,GA3和ABA上升趋势明显大于IAA与CTK; 7月26日至8月22日生长发育的后期,GA3含量呈现明显的下降趋势,IAA和CTK含量保持在较高水平,而ABA迅速积累,调节植物适应干旱胁迫。

|
图 3 白梭梭同化枝中4种内源激素含量的季节变化 Fig. 3 Seasonal changes of 4 endogenous hormones content in H. persicum photosynthetic shoot |
由图 2、3、4可见,5月31日至6月29日轻度水分胁迫阶段,白梭梭同化枝ABA含量甚微(仅为0.15 ng·g-1DW),ABA/CTK,ABA/IAA比值极小。6月29日至7月26日深度水分胁迫阶段,同化枝ABA/CTK和ABA/IAA比值呈现上升趋势,脯氨酸在此阶段也迅速积累至最高水平。白梭梭同化枝ABA/CTK比值为0.5时(7月12日),脯氨酸即出现迅速积累趋势。ABA/CTK和ABA/IAA比值分别为2和1时(7月26日),脯氨酸积累至生长发育过程的最高水平。7月26日至8月22日生长发育后期,ABA/CTK和ABA/IAA的值分别上升至14与8(8月22日),而此时脯氨酸含量维持在高水平平稳,没有再上升的趋势。

|
图 4 白梭梭同化枝中ABA/IAA和ABA/CTK的季节变化 Fig. 4 Seasonal changes of ABA/IAA and ABA/CTK in H. persicum photosynthetic shoot |
植物通过渗透调节作用适应干旱胁迫的强弱,取决于细胞中渗透调节物质(细胞溶质——细胞内合成或分解转化的有机物)种类和数量的多少。脯氨酸由于分子量低,高度水溶性,在生理pH范围内无静电荷及低毒性等成为植物组织内一种理想的渗调物质(汤章城, 1998)。可溶性糖除具有以上特点以外,还具有生成迅速、对代谢活动和酶活性影响小,不论是合成还是分解转化,其原料来源充足的特性(刘友良, 1992)。
轻度水分胁迫时,多年生木本果树光合强度降低的原因主要是气孔因素。中、高度胁迫时,则主要是由非气孔因素,即蛋白质分解大于合成,叶绿体分解加强,叶绿素含量下降,从而导致光合降低(夏阳, 1993)。由图 1、2可见,5月31日至6月29日盛花期,气孔导度值与叶绿素含量显著增大,此阶段白梭梭同化枝虽处于轻度水分胁迫状态,但由于气孔开放度大,光合强度非常高,蛋白质合成大于分解,因而分解转化而来的可溶性糖含量呈低水平变化趋势。马宗仁等(1993)认为气孔变化会导致脯氨酸积累,这与氧气流入植物体内的数量减少有关。脯氨酸氧化酶是一个需氧氧化酶,该酶的活性受氧气制约,当植物受到水分胁迫时缩小或关闭气孔,限制氧气进入植物体内,影响了酶的活性,引发脯氨酸积累。6月29日至7月26日盛夏期间,同化枝处于重度水分胁迫状态,气孔导度降为生长发育过程的最低值,气孔开放受到严重抑制,导致脯氨酸快速积累及光合强度降低,叶绿体活性下降,叶绿素分解,蛋白质生物合成受阻,导致光合作用进一步下降。可以把叶绿素含量下降看作是水分胁迫过程中,由功能性影响到器质性伤害的一个中间过程。7月26日至8月22日生长发育后期,气孔导度值有所增大及内源植物激素的调节,使脯氨酸和可溶性糖含量保持在较高水平,无明显上升或下降的趋势。
由图 1~3分析,5月31日至6月29日盛花期间,植物处于轻度水分胁迫状态,叶片中ABA含量甚微,气孔导度值在0.292~0.481 mol·m-2s-1间变化,可溶性糖呈现下降趋势,而脯氨酸含量出现上升趋势。6月29日至7月26日盛夏期间,ABA迅速积累,气孔导度值在0.232~0.292 mol·m-2s-1间变化。在夏季极端干旱条件下,同化枝叶肉细胞通过快速释放ABA到同化枝表皮来抑制气孔开放,减少水分蒸腾抵抗干旱。与此同时,可溶性糖与脯氨酸均呈现快速积累趋势,而可溶性糖积累强度明显大于脯氨酸,表明可溶性糖作为重要的渗透调节有机物,协同脯氨酸调节植物适应此阶段的重度水分胁迫。8月9日至8月22日同化枝生长发育后期,ABA急剧积累到盛夏时(7月12日)的36倍,气孔导度值较盛夏期间却有所增大,脯氨酸和可溶性糖含量也保持在较高水平,不再有上升的趋势,表明此阶段同化枝虽仍处于深度水分胁迫状态,但是从根的木质部蒸腾流运输到叶片的高浓度的ABA调节植物适应干旱的生理过程,受到CTK和IAA 2种内源植物激素的平衡抑制(图 4),导致了气孔导度明显增大,进而抑制了脯氨酸和可溶性糖继续积累。
白梭梭同化枝抗旱因子的生理生态响应呈现时空顺序性。同化枝通过脯氨酸略微积累来适应盛花期轻度干旱胁迫; 高温夏季重度干旱阶段,可溶性糖积累强度大于脯氨酸,ABA也迅速积累,CABA/CTK为0.5时,脯氨酸出现迅速积累趋势,ABA/CTK和ABA/IAA含量比值分别为2和1时,脯氨酸积累达最高水平。
陈雪梅, 王沙生. 1992. HPLC法定量分析植物组织中ABA, IAA和NAA. 植物生理学通讯, 28(5): 368-371. |
刘友良主编. 1992.植物水分逆境生理.北京:农业出版社
|
马宗仁, 刘荣堂主编. 1993.牧草抗旱生理学.兰州:兰州大学出版社
|
聂朝相, 马宗仁. 1994. 植物在水分胁迫下脯氨酸积累的研究Ⅲ.外源脱落酸、细胞分裂素与脯氨酸积累和叶气孔变化的关系. 兰州大学学报(自然科学版), 30(1): 96-99. |
汤章城. 1998.对渗透胁迫和淹水胁迫的适应机理.见:余叔文, 汤章城主编.植物生理与分子生物学.北京:科学出版社, 239-247
|
谈峰. 1986. 植物激素的高效液相色谱. 植物生理学通讯, (5): 15-23. |
夏阳. 1993. 水分逆境对果树脯氨酸和叶绿素含量变化的影响. 甘肃农业大学学报, 28(1): 26-31. |
徐东翔, 张汝民, 刘素梅, 等. 1990. 沙生植物抗旱生理学问题. 干旱区资源与环境, 1(增): 9-14. |
薛应龙主编. 1985.植物生理学实验手册.北京:科学技术出版社
|
袁朝兴, 丁静. 1990. 水分胁迫对棉花叶片IAA含量, IAA氧化酶和过氧化物酶活性的影响. 植物生理学报, 16(2): 179-180. |
张立运. 2002. 新疆荒漠中的梭梭和白梭梭(上). 植物杂志, (4): 4-6. |
邹琦. 1995. 植物生理生化实验指导. 北京: 中国农业出版社.
|
Cramer G R. 1994. Is an increase in ABA concentration the cause of growth inhibition in salt-stressed plants?. Plant Physiol, 105: 107. |
Dodd I C, Davies W J. 1996. The relationship between leaf growth and ABA accumulation in the grass leaf elongation zone. J Exp Bot, 45: 1471-1478. |
Gowing D J G, Jones H G, Davies W J. 1992. Xylem-transported abscisic acid: the relative importance of its mass and its concentration in the control of stomatal aperture. Plant, Cell & Environ, 16: 453-459. |
Hakimi A, Monneveux P, Galiba G. 1995. Soluble sugars, proline and relative water content (RWC) as traits for improving drought tolerance and divergent selection for RWC from T.polonicum to T. durum. Journal of Genetics & Breeding, 49(3): 237-243. |
Heckenberger U, Schurr U, Schulze E D. 1996. Stomatal response to ABA fed into the xylem of intact Heliarthus annuus(L). Plant J Exp Boi, 47: 1405-1412. |
Jackson G E, Irvine J, Grace J, et al. 1995. Abscisic acid concentrations and fluxes in drought conifer samplings. Plant, Cell & Environ, 18: 13-22. |
Leckie C P, Mcainsh M R, Allen G J, et al. 1998. Abscisic acid-induced stomatal closure mediated by cyclic ADP-ribose. Proc Natl Acad Sci USA, 95(26): 15837-15842. DOI:10.1073/pnas.95.26.15837 |
Puliga S, Vazzana C, Davies W J. 1996. Control of leaf growth of Mediterranean forages by chemical and hydraulic signals. J Exp Bot, 47: 529-537. DOI:10.1093/jxb/47.4.529 |
Rock C D, Ng P P F. 1999. Dominant wilty mutants of Zea mays (Poaceae) are not impaired in abscisic acid perception or metabolism. Am J Bot, 86: 1796-1800. DOI:10.2307/2656676 |
Singh T N, Aspinall F, Paley L G. 1972. Proline accumulation and varietal adaptability to drought resistance. New Biol, 236: 188-190. |
 2005, Vol. 41
2005, Vol. 41


