文章信息
- 刘会香, 张星耀.
- Liu Huixiang, Zhang Xingyao.
- 植物蛋白酶抑制剂及其在林木抗虫基因工程中的应用
- Plant Protease Inhibitors and Their Application on Forest Tree Resisting Pest Genetic Engineering
- 林业科学, 2005, 41(3): 148-157.
- Scientia Silvae Sinicae, 2005, 41(3): 148-157.
-
文章历史
- 收稿日期:2004-03-03
-
作者相关文章
2. 山东农业大学植保学院 泰安 271018
2. College of Plant Protection of Shandong Agricultural University Tai'an 271018
蛋白酶抑制剂(protease inhibitor, PI)广泛存在于动植物和微生物体内, 与机体内相应的蛋白水解酶形成动态平衡, 调节许多重要的生命活动(卢晓风等, 1998;王洪利等, 2000)。蛋白酶抑制剂是一类分子量较小的多肽或蛋白质, 它们能与蛋白酶活性部位或变构部位结合抑制酶的活性(王琛柱等, 1997)。蛋白酶抑制剂根据其作用于酶的活性部位的不同, 分为丝氨酸蛋白酶抑制剂、半胱氨酸蛋白酶抑制剂(巯基蛋白酶抑制剂)、金属羧肽酶蛋白酶抑制剂和天冬氨酸蛋白酶抑制剂。目前已发现的植物来源的蛋白酶抑制剂主要属于前3种类型, 其中, 丝氨酸蛋白酶抑制剂和巯基蛋白酶抑制剂可以明显抑制昆虫的生长发育。丝氨酸蛋白酶抑制剂主要具有抑制鳞翅目昆虫消化蛋白酶的能力;而巯基蛋白酶抑制剂则主要是通过抑制鞘翅目和半翅目昆虫消化道内的巯基蛋白水解酶而达到杀虫目的(Ryan, 1990;柳武革等, 2000;卢晓风等, 1998;孟昆等, 2000;王洪利等, 2000;王永芳等, 2001;文方德等, 1997;易自力等, 1999;贾世荣等, 2001)。目前, 有关植物蛋白酶抑制剂的报道很多, 大多集中于描述蛋白酶抑制剂的种类、结构和讨论转基因的效果与完全性(柳武革等, 2000;冯英等, 2001)。本文主要就植物蛋白酶抑制剂的分布、抗虫基因工程研究现状及其在树木抗虫基因工程中的应用前景进行论述。
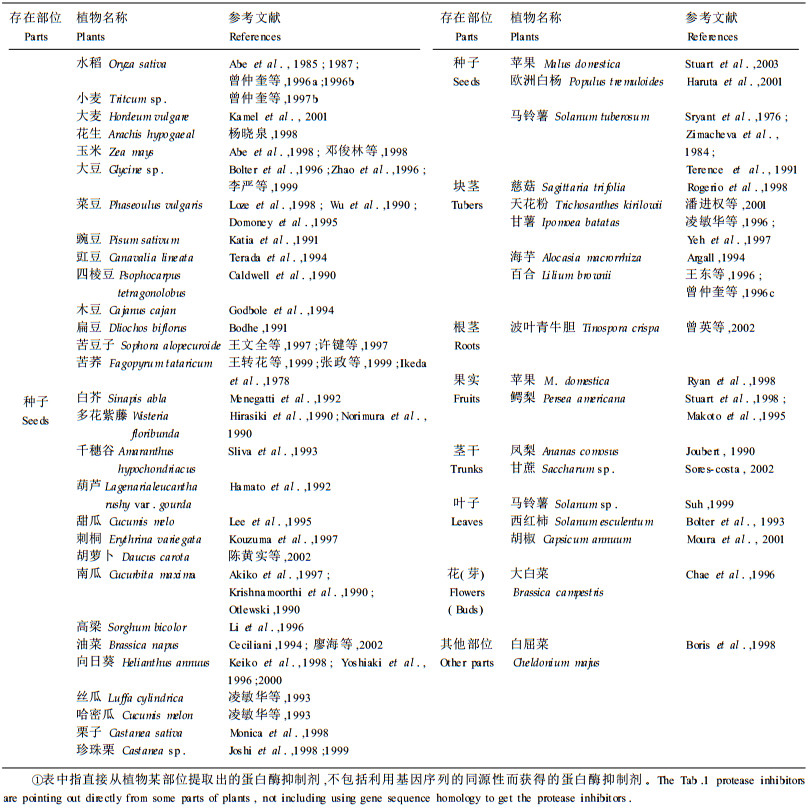
1 植物蛋白酶抑制剂的分布蛋白酶抑制剂主要存在于植物的贮藏器官中, 特别是在种子和球茎中含量最多,其含量有时高达总蛋白的1%~10%(卢晓风等, 1998),特别是在种子的胚乳、胚或子叶中含量高(Abe et al., 1998;Johnson et al., 1989)。植物叶片受到机械损伤或经化学处理,也会积累大量蛋白酶抑制剂。目前所知, 含有蛋白酶抑制剂的植物有90多种,部分见表 1。
|
|
从表 1可以看出, 目前发现的植物蛋白酶抑制剂在豆科、茄科、葫芦科、禾本科及十字花科等草本植物(农作物)中存在较多, 而在木本植物中较少, 仅在苹果等(Ryan et al., 1998;Stuart et al., 1998;Stuart et al., 2003)蔷薇科植物和杨柳科植物的欧洲白杨(Haruta et al., 2001)中发现。
2 植物蛋白酶抑制剂抗虫基因工程研究 2.1 植物蛋白酶抑制剂基因获得的途径国内外有关抗虫的植物蛋白酶抑制剂基因的获得大多通过2种途径。一种通过从植物不同部位的组织或细胞中提取抗虫活性蛋白, 然后分析其起作用的活性核苷酸序列, 继而克隆和转化到寄主细胞, 进行筛选和选育抗虫树种(Hilder et al., 1987;Sliva et al., 1993;Ceciliani et al., 1994;Lee et al., 1995;Makoto et al., 1995;Chae et al., 1996;Kouzuma et al., 1997;Keiko et al., 1998;Octavio et al., 2002)。利用该方法获得抗虫树种的研究越来越多, 该方法中最为关键的环节是蛋白酶抑制剂提取和活性测定方法的选择和建立。植物蛋白酶抑制剂分离和纯化的策略主要依据不同植物中的蛋白酶抑制剂生理生化的性质和特点, 设计试验方案和步骤。植物蛋白酶抑制剂属于分子量较小的蛋白质或多肽, 在分离和纯化时主要利用其溶解度、分子量、电荷、等电点等性质, 单独或联合使用几种如梯度洗脱、分子筛层析、亲和层析、电泳等经典技术, 达到分离和纯化的目的。但不同植物蛋白酶抑制剂的分子量、电荷等特性有差异, 在分离不同植物蛋白酶抑制剂时所选用的层析介质、缓冲液的pH和浓度大小、电泳时的分离胶和浓缩胶的浓度和交联度都有差别, 这些均需要通过深入了解不同植物来源蛋白酶抑制剂的特性设计相应的试验技术(Abe et al., 1985;1987;Argall, 1994;许键等, 1997;曾英等, 2002;曾仲奎等, 1996a;1996b;1996c;1997a;1997b;张政等, 1999)。就目前已提取的蛋白酶抑制剂而言, 大多数蛋白酶抑制剂都具有耐热性和相对分子量小的特点。Abe等(1985;1987)从水稻种子中提取的水稻巯基蛋白酶抑制剂,其分子质量为12.0 ku, 在100 ℃下温浴30 min, 其抑制活性没有改变;曾仲奎等(1996a;1996b)分离水稻种子获得的巯基蛋白酶抑制剂也具有该特点, 证实了Abe等试验结果的可靠性, 而后又分别从玉米(Abe et al., 1998;邓俊林等, 1998)、百合(曾仲奎等, 1996c)、小麦(曾仲奎, 1997a)等农作物中分离到了巯基蛋白酶抑制剂, 获得了一致的试验结果。曾英等(2002)从防己科植物波叶青牛胆分离到一种胰蛋白酶抑制剂(TCTI), 其相对分子量为10.0 kd, 在100 ℃下加热60 min, 仍保持93%的抑制活性;王东等(1996)从海芋、杨晓泉等(1998)从花生中均分离到胰蛋白酶抑制剂, 并证实了丝氨酸蛋白酶抑制剂也具有上述特点。基于蛋白酶抑制剂的特点, 在其分离时大多数研究者(Abe et al., 1985;1987;1998;邓俊林等, 1998;曾英等, 2002;曾仲奎等, 1996a;1996b;1996c;1997a;1997b)采用对蛋白酶抑制剂提取液加热的方法以除去大量不耐高温的杂蛋白, 从而极大地简化了试验步骤。为获得较纯的蛋白酶抑制剂样品, 目前通过HPLC (Abe et al., 1998)、RP-HPLC和FPLC(曾英等, 2002)色谱研究方法越来越多, 极大地提高了样品的纯度, 为获得蛋白酶抑制剂的结晶和研究其空间结构及特性提供了技术保障。有关蛋白酶抑制剂活性测定, 传统的方法主要利用酶和抑制剂作用的动力学测定法(曾仲奎等, 1996a;1996b;1996c), 但该方法的缺点是花费时间长, 试验条件不易控制, 容易造成试验误差。近年来随着电泳技术的日臻完善, 新的快速、准确的鉴定方法应运而生, Klaus等(1996)应用一种快速聚丙烯酰胺凝胶电泳鉴定了蛋白酶抑制剂, Dominque等(1996)、桑玉英等(2001)和廖海等(2002)等应用SDS-PAGE-明胶电泳检测了植物蛋白酶抑制剂。该方法主要根据特异植物蛋白酶抑制剂抑制靶蛋白酶的作用从而阻止水解的原理, 借助明胶-聚丙烯酰胺凝胶电泳分离样品, 经蛋白酶水解后, 用考马斯亮蓝染色;是一种简便、直观、灵敏的检测蛋白酶抑制剂活性的方法, 该方法还可以进行大量样品的筛选工作, 极大地加快了蛋白酶抑制剂的活性测定。另一种获得植物蛋白酶抑制剂抗虫基因的途径是利用目前已有的植物蛋白酶抑制剂基因序列, 比较其同源性, 找出保守序列, 在此基础上设计引物、扩增和测序, 同时在构建目标材料CDNA文库的基础上, 通过基因序列的比对, 查找目标材料中是否存在该植物蛋白酶抑制剂基因的序列, 在此基础上, 通过相应的分子生物学技术扩增出目标材料中蛋白酶抑制剂的序列片段, 找出基因全长的CDNA序列, 然后在一定的载体上扩增和表达, 得到目的蛋白序列, 最后鉴定其功能。
2.2 植物蛋白酶抑制剂在植物抗虫基因工程中的研究现状自从Hilder等(1987)率先将豇豆中的胰蛋白酶抑制剂基因转入烟草(Nicotiana rusti), 获得了对鳞翅目烟芽夜蛾(Heliothis virescens)和斜纹贪夜蛾(Spodoptera litura)和直翅目蝗虫(Locusta migratoria)的抗性以来, 植物蛋白酶抑制剂抗虫基因工程已经取得了很大进展, 现已获得了一些转基因植物, 见表 2。
|
|
来源于林木的植物蛋白酶抑制剂研究较少。Stuart等(1998;2003)先后从苹果果实和种子中提取到了蛋白酶抑制剂(包括丝氨酸和巯基蛋白酶抑制剂), 并测定了其中的氨基酸组成和序列。而林木方面的研究, 大多利用从农作物上提取的蛋白酶抑制剂基因进行有关的转化工作。Confalonieri等(1998)将大豆Kunitz蛋白酶抑制剂基因转化到欧洲黑杨(Populus rigra), 但对试虫的毒杀效果不好;郝贵霞(1999a;1999b)通过农杆菌介导将豇豆胰蛋白酶抑制剂和水稻巯基蛋白酶抑制剂基因分别转入到毛白杨, 获得了转基因植株;师校欣(2000)通过农杆菌介导将豇豆胰蛋白酶抑制剂转入苹果主栽品种, 但并未见到室内和田间抗虫试验报道;王洪利等(2003)将水稻巯基蛋白酶抑制剂基因转入桑树中;诸葛强等(2003)将豇豆胰蛋白酶抑制剂转入新疆杨中;郑均宝等(2000;2001)用部分改造的Bt CrylAc基因与慈姑蛋白酶抑制剂(API)基因构架的双抗虫基因表达载体, 通过农杆菌介导法转化741杨[Populus alba L. × (P.davidiana Dode × P.simonii Carr.) × P.tomentosa Carr.], 培育出转双抗虫基因741杨, 并对初步选择的转基因杨树植株用杨扇舟蛾(Clostera anachoreta)和舞毒蛾(Lymantria dispar)幼虫进行了饲虫试验, 首次在国内外报道培育出对杨扇舟蛾和舞毒蛾具有高抗虫性的转基因杨树植株;张谦(2002)将表达豇豆胰蛋白酶抑制剂的转基因三倍体毛白杨(Populus tomentosa)回交杂种, 用萌条上的叶片对3种主要杨树害虫:黄褐天幕毛虫(Malacosoma neustria testacea)、舞毒蛾和杨雪毒蛾(Stilpnotia candida)进行了离体布虫试验, 发现转基因植株显著提高了害虫的死亡率, 降低了幼虫的排粪量及蛹重,成虫的产卵量;李明亮等(2000)将结晶蛋白(Bt)基因转化杨树, 得到杨树再生植株, 然后再将蛋白酶抑制剂基因(PI)导入已含Bt基因的转基因杨树, 经PCR检测和Southern杂交分析, 最终获得既含有Bt基因又含有蛋白酶抑制剂基因的转基因杨树植株。利用这种转基因杨树叶片饲喂舞毒蛾幼虫的杀虫试验结果表明, 转基因杨树具有明显的杀虫活性, 而含有Bt和蛋白酶抑制剂双基因的植株其抗虫能力明显高于仅含单一Bt基因的植株。但上述研究表明:转植物蛋白酶抑制剂基因的林木的抗虫性研究主要局限于抗鳞翅目的食叶害虫上, 而对危害树种多、面积大、造成经济损失更为严重的蛀干害虫,特别是天牛的转基因防治研究报道较少(王洪利等, 2003), 这方面的研究亟待加强。
3 植物蛋白酶抑制剂在林木害虫防治中的应用前景 3.1 我国林木害虫的危害和防治现状危害林木的害虫种类很多, 这些害虫每年给我国造成巨大的经济损失, 被称为“不冒烟的森林火灾”, 特别是危害最为严重的松材线虫病(Bursaphelenchus xylophilus)、美国白蛾(Hyphantria cunea)、松毛虫(Dendrolimus spp.)、杨树天牛(Anoplophora spp.)、红脂大小蠹(Dendroctonus valens)以及森林鼠害, 对我国林业的可持续和健康发展造成了极大的威胁。
目前, 对于林木害虫的防治, 尽管一些学者提出了许多诸如有害生物综合治理、合理治理、总体治理、生物因素强化治理、有害生物持续治理、生态治理等战略思想(张星耀, 1998;张星耀等,2003), 但尚缺乏理论支撑和实际操作规程或模式, 因此在实际生产中仍以化学防治为主, 杀虫剂虽然在短期内能起到杀灭害虫保护林木的作用, 但长期使用会使毒性在林木体内积累, 殃及人类、害虫天敌及其他动物健康,并造成环境污染;同时还导致害虫对杀虫剂产生抗性, 降低药效并出现害虫再猖獗等恶性循环现象(3R)。这些问题的出现, 迫使人们不得不寻找新的抗虫途径(李云蚬等, 2001;王洪利等, 2000;易自力等, 1999)。
随着分子生物学技术的飞速发展, 利用基因工程手段培育抗虫品种成为可能, 将抗虫基因导入林木细胞中, 使其在细胞内稳定地遗传和表达, 从而培育新的林木抗虫品种, 是一种理想的、最有前途的防治林木害虫的方法(王洪利等, 2000;易自力等, 1999;张锐等, 2001)。同传统的林木抗虫育种相比, 利用基因工程手段培育林木抗虫品种具有如下优点:1)育种期短, 可直接在基因水平上改造林木抗性遗传物质, 提高了育种的目的性和可操作性;2)不仅可以利用存在于植物中的抗虫基因, 也可以利用某些动物、微生物中的抗虫基因以及人工合成的抗虫基因, 基因资源丰富;3)抗虫物质只存在于植物体内, 不易被环境因素破坏, 也不易污染环境;4)与开发新型杀虫剂相比, 投资相对较少(王洪利等, 2000;易自力等, 1999;张锐等, 2001;苏晓华等, 2003a;2003b)。近几年林木来转抗虫基因已由转单基因向双基因或多基因方向发展, 使抗虫效果进一步加强(崔洪志等, 1998;李明亮等, 2000;郑均宝等, 2000), 林木抗虫基因工程已成为国内外研究者关注的热点。已经发现和分离到了许多有用的抗虫基因, 如苏云金杆菌毒蛋白基因(Bt基因)和蛋白酶抑制剂基因部分已经导入林木体内而获得了转基因抗虫林木, 并有一批转基因林木进入大田试验阶段(田颖川等, 1993;李玮等, 1996;郝贵霞等, 1999a;1999b;易自力等, 1999;郑均宝等, 2000)。
3.2 植物蛋白酶抑制剂在林木害虫防治中的应用前景 3.2.1 植物蛋白酶抑制剂的抗虫作用苏云金杆菌毒蛋白基因(Bt基因)在林木抗虫基因工程中研究最早、最为深入并在生产中取得了良好的抗虫效果, 但目前也暴露出许多问题, 如抗虫谱窄, 害虫易对杀虫结晶蛋白产生耐受性(张智奇等, 1996;李明亮等, 2000;张锐等, 2001), 这些问题迫使人们改造现有的Bt基因和寻求新的抗虫基因, 蛋白酶抑制剂由于杀虫谱广、对人畜无副作用以及害虫不易产生耐受性而受到普遍关注(李明亮等, 2000), 成为林木抗虫基因工程中的又一亮点。
有关蛋白酶抑制剂的杀虫机理, 目前大多数研究者认为:植物蛋白酶抑制剂主要通过与昆虫消化道的蛋白酶相互作用, 形成酶-抑制剂复合物, 阻断或减弱消化酶的蛋白水解作用, 影响其正常消化, 使昆虫得不到足够的营养;而且该复合体能刺激消化酶过量分泌, 通过神经系统的反馈作用, 使昆虫产生厌食反应, 最终导致昆虫的非正常发育和死亡(王洪利等, 2000)。也有的学者认为蛋白酶抑制剂先与昆虫肠道蛋白酶的活性位点结合, 形成解离常数非常低的复合物(中性pH下约10 -7~10-14), 该位点被封锁后, 在抑制剂分子表面凸出一个二硫键环, 该环不仅固定了酶抑制剂复合物的构象, 而且还包含一个酶抑制剂反应位点的肽键, 此肽键在蛋白酶作用下会断裂, 但并不影响酶与抑制剂的相互作用, 也不引起产物的解离。但不同类别的植物蛋白酶抑制剂具有不同的抗虫性, 这种酶与抑制剂互作的特异性主要由蛋白水解的特异性所决定, 而蛋白水解的特异性取决于酶的特性(程仲毅等, 2002)。由于植物的害虫种类多, 且不同的蛋白酶抑制剂特性有差异, 故蛋白酶抑制剂的作用机制比较复杂, 迄今为止到目前蛋白酶抑制剂的抗虫机制尚不十分清楚(王琛柱等, 1997)。
植物蛋白酶抑制剂的抗虫作用, 最早是在1947年被发现。当时Mickel和Standish(1947)观察到一些昆虫的幼虫在豆类产物中不能发育。随后Lipke等(1954)发现大豆中的丝氨酸蛋白酶抑制剂对杂拟谷盗(Triboriam confusum)表现出毒性。在此后的研究中, 发现很多蛋白酶抑制剂抗虫的例子, 如Paulra等(2002), 王文全等(1997), 王琛柱等(1995)用大豆胰蛋白酶抑制剂在离体和人工饲养条件下测定其对棉铃虫中肠蛋白酶的抑制作用, 均取得了良好结果;植物蛋白酶抑制剂的抗虫作用还表现在生物或非生物因素胁迫下的诱导反应, Green等(1972)、Edwards等(1985)、Broadway等(1986)、Zhao等(1996)等研究发现某些真菌侵染、昆虫危害、机械损伤或茉莉酸等处理某些植物后, 其体内的蛋白酶抑制剂的累积量明显增多, 不仅在受伤的叶片, 而且在根部或整株中合成。这些研究结果极其有力地说明了蛋白酶抑制剂的抗虫作用, 但目前的文献资料大多报道的是蛋白酶抑制剂对农作物或仓储害虫的防治作用, 而对林木害虫防治报道较少, 这方面的研究亟待加强。
3.2.2 植物蛋白酶抑制剂在林木害虫防治中的应用前景植物蛋白酶抑制剂作为一种新的防治害虫途径, 除了具有不易使昆虫产生耐受性、杀虫谱广、对人畜无害、分子量小、含量丰富以及性质稳定、易于操作等优点外, 最为重要的是, 现已证明蛋白酶抑制剂转入食用作物中对人畜没有副作用。这主要是由于人畜和昆虫的消化机制不一样所致, 对人、畜来说, 蛋白质消化酶主要存在于肠道中, 而蛋白酶抑制剂在进入肠道之前, 首先要经过胃的消化, 在胃酸的作用下, 蛋白酶抑制剂被降解;而昆虫则不同, 蛋白酶抑制剂被摄食后直接进入肠道, 和肠道中的蛋白消化酶相互作用。另外一些研究还表明, 食用天然的植物蛋白酶抑制剂具有抗肠癌的作用, 如豇豆胰蛋白酶抑制剂中富含赖氨酸, 它在转基因植物中的积累会提高食物的品质和营养价值。此外再加上蛋白酶抑制剂分布广泛, 容易获得。尽管目前已发现许多植物中存在蛋白酶抑制剂, 但还有大量植物中的蛋白酶抑制剂尚未分离和鉴定, 特别是在木本植物中寻找蛋白酶抑制剂基因来防治林木害虫, 将是一个非常诱人的研究领域, 具有非常广阔的应用前景。
然而植物蛋白酶抑制剂基因在林木抗虫基因工程中仍存在一些问题, 特别是抗蛀干害虫的研究, 主要表现在以下几个方面:
1) 林木害虫消化系统的生理生化学研究基础薄弱 植物蛋白酶抑制剂主要依据靶标害虫体内某些蛋白酶生理生化特性,相应地抑制靶标害虫某种或某一类酶的活性而发挥抗虫作用。因此转植物蛋白酶抑制剂的抗虫基因工程需在深入了解目标害虫消化系统生理生化特性的基础上, 才有可能取得成功。然而目前有关林木害虫消化系统的生理生化特性报道较少, 特别是消化系统生理生化的变动规律研究更少。丁双阳等(2001b)用转豇豆胰蛋白酶抑制剂(CPTI)基因的毛白杨回交杂种[(Populus tomentosa × P.bolleana) × P.tomentosa]叶片饲喂4~5龄美国白蛾幼虫, 对其中肠解毒酶和乙酰胆碱酯酶活性进行了测定。结果表明, 酯酶、羧酸酯酶的活力受到明显抑制, 且随时间的延长抑制强度增加,饲喂48 h后, 上述2种酶的活力分别比对照降低76.42%和73.91%;多功能氧化酶在饲喂12 h后, 也受到抑制, 最大抑制率为35.78%, 但24 h后酶活力反而高于对照;谷胱甘肽S -转移酶和乙酰胆碱酯酶活力也受到抑制, 两者的表现极为相似, 均在饲喂后4 h抑制作用最强, 酶活力分别比对照降低51.40%和40.57%。以转Bt基因欧洲黑杨叶片饲喂4~5龄美国白蛾幼虫进行的测定。结果表明, 中肠多功能氧化酶受到强烈抑制, 饲喂4 h后多功能氧化酶的活性比对照降低50.89%, 48 h后该酶活性仅为对照的1/6;酯酶及羧酸酯酶的活性也受到明显抑制,饲喂48 h后上述两种酶的活性分别比对照降低73.58%和56.55%;谷胱甘肽S-转移酶变化比较特殊, 饲喂24 h后其活性出现峰值, 48 h后与对照持平。上述结果说明转基因叶片对幼虫中肠解毒酶活性的抑制可能是其毒杀害虫的机制之一(丁双阳等, 2001a)。卞学瑜等(1997)对杨扇舟蛾特异性蛋白酶抑制剂的研究表明:只有丝氨酸蛋白酶抑制剂对中肠蛋白酶活性有抑制作用, 其他特异性蛋白酶抑制剂如半胱氨酸蛋白酶抑制剂、天门冬氨酸蛋白酶抑制剂和金属蛋白酶抑制剂对中肠酶活力均无抑制作用, 可以认为杨扇舟蛾的中肠蛋白酶以丝氨酸蛋白酶为主。Bian等(1996)对离体光肩星天牛幼虫中肠中主要蛋白酶的类型和活性研究后认为, 光肩星天牛幼虫中肠主要具有丝氨酸蛋白酶、胰蛋白酶、胰凝乳蛋白酶和类凝乳蛋白酶, 而缺乏巯基蛋白酶、天冬氨酸蛋白酶和金属蛋白酶, 其中肠的pH值在10~11.5之间, 属于强碱性环境;这与Hilder等(1987)报道的一般鞘翅目害虫的中肠蛋白酶特性有差异, 其他林木害虫的消化道的生理生化机制尚未见报道。
2) 植物蛋白酶抑制剂的作用和调控机制,特别是蛋白酶抑制剂与昆虫体内蛋白酶酶系统的互作机制有待深入研究 尽管植物蛋白酶抑制剂的研究报道越来越多, 但至今蛋白酶抑制剂的抗虫机制和调控机制还不十分清楚;害虫取食含有植物蛋白酶抑制剂的转基因植物时, 其消化系统中蛋白酶与蛋白酶抑制剂的互作动态;影响蛋白酶抑制剂抗虫效果的因素诸如:蛋白酶抑制剂的种类特异性、蛋白酶抑制剂在植物体内浓度与抗虫性的关系、蛋白酶抑制剂与植物体内的其他物质的关系、蛋白酶抑制剂与昆虫体内其他非靶标蛋白酶或其他内容物的互作关系均需深入研究(王琛柱等, 1997)。植物蛋白酶抑制剂在转基因植物中的表达量较低, 害虫体内剩余的消化蛋白酶足以维持自身的正常发育和生长,甚至有些害虫可以适应转基因植物中表达的蛋白酶抑制剂。这些问题的出现, 需要研究者继续分离和寻找活性更强的植物蛋白酶抑制剂基因或改造现有基因;提高表达量或同时使用2个或2个以上抗虫机制不同或互补的抗虫基因来转化林木;或使蛋白酶抑制剂基因只在受到害虫侵袭时, 或者只在容易被害虫侵染的植物组织器官中, 抑或只在一定的条件下才高效表达, 从而在一定程度上降低对害虫的选择压力, 延缓转基因林木的抗虫寿命。故需要选择组织特异性表达和昆虫诱导型表达的启动子来调控外源基因的表达, 使林木在受到害虫攻击时,抗虫基因能经济有效地得以表达(柳武革等, 2000;程仲毅等, 2002)。
总之, 植物蛋白酶抑制剂基因为林木害虫防治的研究增添了新的内容, 随着植物蛋白酶抑制剂的分离和鉴定方法的逐渐改进, 不同植物来源、不同类型、不同特性的植物蛋白酶抑制剂基因将会获得并应用到林木害虫防治的基因工程中。深入研究不同植物蛋白酶抑制剂与昆虫肠道蛋白酶系统的相互作用;利用不同调控因子提高蛋白酶抑制剂基因的表达水平(达克东等, 2001);建立和完善一套有效的基因转移体系(郭风英等, 1997);同时与其他抗虫因子和防治方法有机地结合, 植物蛋白酶抑制剂必将在林木害虫可持续控制中发挥巨大的作用。
陈黄实, 任启生, 宋新荣, 等. 2002. 刺桐属胰蛋白酶抑制剂的结构与生物活性关系. 生物技术通讯, 13(3): 222-225. DOI:10.3969/j.issn.1009-0002.2002.03.019 |
程仲毅, 薛庆中. 2002. 植物蛋白酶抑制剂基因结构、调控及其控制害虫策略. 遗传学报, 30(8): 790-796. |
崔洪志, 郭三堆. 1998. 双价杀虫基因植物表达载体的构建及其在烟草中的表达. 农业生物技术学报, 6(1): 7-14. |
达克东, 崔德才, 张松, 等. 2001. 超强表达豇豆胰蛋白酶抑制剂基因(CPTI)转化苹果的研究. 园艺学报, (1): 57-58. DOI:10.3321/j.issn:0513-353X.2001.01.011 |
邓俊林, 曾仲奎. 1998. 玉米巯基蛋白酶抑制剂的纯化及部分性质. 四川大学学报(自然科学版), 35(1): 107-111. |
丁双阳, 李怀业, 李学锋, 等. 2001a. 转Bt基因杨树对美国白蛾幼虫中肠解毒酶及乙酰胆碱脂酶的影响. 东北林业大学学报, 29(5): 100-102. |
丁双阳, 李怀业, 李学锋, 等. 2001b. 转CpTI基因杨树对美国白蛾幼虫中肠解毒酶及乙酰胆碱脂酶的影响. 东北林业大学学报, 29(3): 28-30. |
范贤林, 石西平, 赵建周, 等. 1999. 转双基因烟草对棉铃虫的杀虫活性评价. 生物工程学报, 15(1): 6-10. DOI:10.3321/j.issn:1000-3061.1999.01.002 |
冯英, 薛庆中. 2001. 作物抗虫基因工程及其安全性. 遗传, 23(6): 571-576. DOI:10.3321/j.issn:0253-9772.2001.06.016 |
郭风英, 沙广乐. 1997. 蛋白酶抑制剂研究进展. 河南职技师范学报, 25(4): 5-7. |
郝贵霞, 朱祯, 朱之悌. 1999a. 转水稻巯基蛋白酶抑制剂基因毛白杨的获得. 高技术通讯, 11: 17-21. |
郝贵霞, 朱祯, 朱之悌. 1999b. 豇豆蛋白酶抑制剂基因转化毛白杨的研究. 植物学报, 41(12): 1276-1282. |
胡晓琴, 贾士荣. 1998. 水稻巯基蛋白酶抑制剂基因导入马铃薯和茄子. 园艺学报, 25(1): 65-69. DOI:10.3321/j.issn:0513-353X.1998.01.013 |
贾世荣, 郭三堆, 安道昌编著. 2001. 转基因棉花. 北京: 科学出版社, 32-37.
|
李明亮, 张辉, 胡建军, 等. 2000. 转Bt基因和蛋白酶抑制剂基因杨树抗虫性研究. 林业科学, 36(2): 93-97. DOI:10.3321/j.issn:1001-7488.2000.02.015 |
李玮, 陈颖, 李玲, 等. 1996. 抗菌肽LcI基因转化杨树阶段研究. 林业科学研究, 9(6): 646-649. DOI:10.3321/j.issn:1001-1498.1996.06.015 |
李严, 宗晖, 黄小莺, 等. 1999. 中国野生大豆胰蛋白酶抑制剂的初步研究. 复旦大学学报, 38(5): 529-532. |
李燕娥, 朱祯, 陈志贤, 等. 1998. 豇豆胰蛋白酶抑制剂转基因棉花的获得. 棉花学报, 10(5): 237. |
李云蚬, 秦飞, 杨学民, 等. 2001. 农林业转基因抗虫性育种的研究、应用情况概述. 江苏林业科技, 28(2): 46-48. DOI:10.3969/j.issn.1001-7380.2001.02.021 |
廖海, 杜林方, 张年辉. 2002. 一种快速检测蛋白酶抑制剂电泳活性的染色方法. 植物生理学通讯, 38(3): 257-259. |
凌敏华, 戚正武, 邵鹏柱. 1996. 天花粉胰蛋白酶抑制剂基因的克隆及DNA序列分析. 生物化学与生物物理学学报, 28(3): 233-239. |
凌敏华, 周祖荫. 1993. 丝瓜、哈密瓜蛋白酶抑制剂的研究. 生物化学与生物物理学学报, 25(1): 19-24. |
刘春明, 朱桢, 周兆斓, 等. 1992. 豇豆胰蛋白酶抑制剂抗虫转基因烟草的获得. 科学通报, 37(18): 1694-1697. DOI:10.3321/j.issn:0023-074X.1992.18.001 |
柳建军, 于洪欣, 崔德才, 等. 2001. 通过根癌农杆菌介导法将抗虫基因CPTI导入辣椒的研究. 山东农业科学, 4: 15-16. |
柳武革, 薛庆中. 2000. 蛋白酶抑制剂及其在抗虫基因工程中的作用. 生物技术通报, 1: 20-25. |
卢晓风, 夏玉先, 裴炎. 1998. 植物蛋白酶抑制剂在植物抗虫与抗病中的作用. 生物化学与生物物理进展, 25(4): 328-332. |
孟昆, 苏宁, 沈桂芳. 2000. 水稻巯基蛋白酶抑制剂研究进展. 生物技术学报, 2: 5-7. DOI:10.3321/j.issn:1673-1689.2000.01.002 |
潘进权, 刘耘. 2001. 慈菇蛋白酶抑制剂研究进展. 生命的化学, 21(5): 366-367. DOI:10.3969/j.issn.1000-1336.2001.05.008 |
桑玉英, 胡金勇, 曾英. 2001. 常规聚丙烯酰胺凝胶电泳快速检测胰蛋白酶抑制剂的方法. 云南植物研究, 23(2): 236-238. DOI:10.3969/j.issn.2095-0845.2001.02.020 |
师校欣, 王斌, 杜国强, 等. 2000. 根癌农杆菌介导豇豆胰蛋白酶抑制剂基因转化苹果主栽品种. 园艺学报, 27(4): 282-284. DOI:10.3321/j.issn:0513-353X.2000.04.009 |
苏宁, 冯丽, 杨波, 等. 2002. 水稻巯基蛋白酶抑制剂基因在烟草叶绿体中的表达. 作物学报, 28(3): 301-304. DOI:10.3321/j.issn:0496-3490.2002.03.003 |
苏晓华, 张冰玉, 黄烈健, 等. 2003a. 转基因林木研究进展. 林业科学研究, 16(1): 95-103. |
苏晓华, 张冰玉, 黄秦军, 等. 2003b. 我国林木基因工程研究进展及关键领域. 林业科学, 39(5): 111-118. |
田颖川, 李太元, 莽克强, 等. 1993. 抗虫转基因欧洲黑杨的培育. 生物工程学报, 9(4): 291-297. DOI:10.3321/j.issn:1000-3061.1993.04.017 |
王琛柱, 钦俊德. 1997. 植物蛋白酶抑制素抗虫作用研究进展. 昆虫学报, 40(2): 212-218. DOI:10.3321/j.issn:0454-6296.1997.02.020 |
王琛柱, 项秀芬, 张书芳, 等. 1995. 大豆胰蛋白酶抑制剂对棉铃虫幼虫消化生理和生长发育的影响. 昆虫学报, 38(3): 272-277. DOI:10.3321/j.issn:0454-6296.1995.03.009 |
王东, 季本仁, 曾英, 等. 1996. 海芋胰蛋白酶抑制剂的分离纯化及性质研究. 云南植物研究, 18(4): 454-458. |
王洪利, 楼程福. 2000. 半光氨酸蛋白酶抑制剂基因及其在桑树害虫防治上的应用前景. 蚕业科学, 26(增刊): 15-19. |
王洪利, 楼程富, 张有做, 等. 2003. 水稻半胱氨酸蛋白酶抑制剂基因转化桑树获得转基因植株的初报. 蚕业科学, 26(3): 261-264. |
王文全, 孟玲, 许键. 1997. 苦豆子胰蛋白酶抑制剂对几种害虫的抑制作用. 中国生物防治, 13(4): 176-178. |
王永芳, 高宝嘉, 郑均宝, 等. 2001. 杨树抗虫基因工程研究进展. 河北林果研究, 16(1): 83-90. DOI:10.3969/j.issn.1007-4961.2001.01.021 |
王转花, 荆艳萍, 毛建峰. 1999. 苦荞胰蛋白酶抑制剂提取方法研究. 山西大学学报, 22(1): 57-60. DOI:10.3969/j.issn.0253-2395.1999.01.014 |
文方德, 傅家瑞. 1997. 植物种子的蛋白酶抑制剂及其生理功能. 植物生理学通讯, 1: 1-9. |
许键, 张强, 罗淑萍, 等. 1997. 苦豆子胰蛋白酶抑制剂的分离纯化及性质研究. 生物化学与生物物理学报, 29(6): 585-589. |
杨晓泉, 文放德, 张水华, 等. 1998. 花生胰蛋白酶抑制剂的纯化及性质研究. 营养学报, 20(3): 337-341. DOI:10.3321/j.issn:0512-7955.1998.03.020 |
易自力, 刘选明, 周朴华. 1999. 植物抗虫基因的研究与应用. 高技术通讯, 6: 53-57. DOI:10.3321/j.issn:1002-0470.1999.02.001 |
曾英, 桑玉英, 胡金勇, 等. 2002. 波叶青牛胆胰蛋白酶抑制剂的纯化及其性质研究. 云南植物研究, 24(1): 103-108. DOI:10.3969/j.issn.2095-0845.2002.01.013 |
曾仲奎, 谢文胜, 鲍锦库, 等. 1996a. 水稻巯基蛋白酶抑制剂的纯化及其性质研究. 中国生物化学与分子生物学报, 12(6): 703-708. |
曾仲奎, 鲍锦库, 周红, 等. 1996b. 水稻巯基蛋白酶抑制剂的分子修饰与其对水稻瘟病菌的抑制作用. 中国生物化学与分子生物学报, 12(6): 709-713. |
曾仲奎, 杨育红, 鲍锦库, 等. 1996c. 百合巯基蛋白酶抑制剂的纯化及部分性质研究. 中国生物化学与分子生物学报, 12(2): 182-185. |
曾仲奎, 鲍锦库, 周红, 等. 1997a. 小麦巯基蛋白酶抑制剂的分子修饰与其生理活性研究. 中国农业科学, 30(1): 38-43. |
曾仲奎, 于源, 周红, 等. 1997b. 绵农小麦种子巯基蛋白酶抑制剂的纯化及性质研究. 应用与环境生物学报, 3(2): 140-147. |
张谦, 林善枝, 张志毅, 等. 2002. 表达豇豆胰蛋白酶抑抑剂转基因杨树的虫试试验. Forestry studies in China, 4(2): 27-32. |
张锐, 郭三堆. 2001. 植物抗虫基因工程研究进展. 生物技术通报, 2: 8-12. |
张星耀, 骆有庆主编.2003.中国森林重大生物灾害.北京: 中国林业出版社, 372-385
|
张星耀. 1998. 面向二十一世纪的中国林业. 北京: 中国农业出版社, 341-345.
|
张政, 王转花, 林汝法, 等. 1999. 苦荞种子胰蛋白酶抑制剂的分离纯化及部分性质研究. 中国生物化学与分子生物学学报, 15(2): 247-251. |
张智奇, 周音, 王少鸥, 等. 1996. 抗虫基因及其在植物中的应用. 吉林农业大学学报, 18(1): 91-95. |
郑均宝, 梁海永, 田颖川, 等. 2000. 转双抗虫基因741毛白杨的选择及抗虫性. 林业科学, 36(2): 13-19. DOI:10.3321/j.issn:1001-7488.2000.02.003 |
诸葛强, 王婕琛, 陈英, 等. 2003. 豇豆胰蛋白酶抑制剂(CpTI)抗虫转基因新疆杨的获得. 分子植物育种, 1(4): 491-496. DOI:10.3969/j.issn.1672-416X.2003.04.007 |
Abe K, Kondo H, Arai S. 1987. Purification and characterization of a rice cysteine proteinase inhibitor. Agric Biol Chem, 5(10): 2763-2768. |
Abe K, John R W. 1998. Purification and characterization of a cysteine proteinase inhibitor from the endosperm of corn. Agric Biol Chem, 52(6): 1583-1584. |
Abe K, Arai S. 1985. Purification of a cysteine proteinase inhibitor from rice(oryza sativa L). Agric Biol Chem, 49: 3349-3350. |
Akiko O, Hjima S, Katsumi H, et al. 1997. An extracellular insoluble inhibitor of cystine proteinase in cell culture and seeds of carrot. Plant Molecular Biology, 34: 99-109. DOI:10.1023/A:1005842719374 |
Argall M E. 1994. Amino acid sequence of a trypsin/chymotrypsin inhibitor from giant taro(Alcasia macrorrhiza). BBA Protein Struc Mol Enzymol, 1204(2): 189-194. DOI:10.1016/0167-4838(94)90008-6 |
Bian Xueyu, Christeller J T, Shaw B D, et al. 1997. Effect of proteinase inhibitors on the midgut proteinase of Clostera anachoreta larvae. Chin J Appl Environ Biol, 3(3): 240-245. |
Bodhe A M. 1991. Purification and properities of a subtilism inhibitor and an associated trypsin inhibitor Dliochos biflorus. Biochem Biophs Acta, 1073(1): 11-17. DOI:10.1016/0304-4165(91)90176-H |
Bolter C J. 1993. Methyl jasmonate induces papain inhibitor in tomato leaves. Plant Physiol, 103: 1347-1353. DOI:10.1104/pp.103.4.1347 |
Bolter M A, Yi Xu, Prabbha T N, et al. 1996. Differential expression of soybean cyteine proteinase inhibitor gene during developmentand in response to wounding and methyl jasmonate. Plant Physiol, 112: 1201-1210. DOI:10.1104/pp.112.3.1201 |
Boris R, Tajana P, Anka R, et al. 1998. Cheldocystatin, a novel phytocystatin from Cheldonium majus. Phytochemistry, 49(6): 1645-1649. DOI:10.1016/S0031-9422(98)00281-7 |
Broadway R M, Duffey S S. 1986. Plant proteinase inhibitors: Mechanism of action and effect on the growth and digestive physiology of larval Heliothis zea and Spodoptera exigua. J Insect Physiol, 32: 827-833. DOI:10.1016/0022-1910(86)90097-1 |
Caldwell J B, Strike P M, Kortt A A. 1990. Amino acid sequence of the acidic Kunitze-type trypsin inhibitor from Winged-bean seed( Psophocarpus tetragonolobus L). J Protein Chem, 9(4): 493-499. DOI:10.1007/BF01024626 |
Ceciliani F, Bortolotti F, Menegatti E, et al. 1994. Purification, inhibitory properties, amino acid sequence and identification of the relatives site of a new serine proteinase inhibitor from oil-rape( Brassica napus)seed. FEBS Lett, 342(2): 221-224. DOI:10.1016/0014-5793(94)80505-9 |
Chae O L, Soo I L, Woo S C, et al. 1996. Characterization of a CDNA encoding cysteine proteinase inhibitor from Chinese cabbage (Brassica campestris L.sp.Pekiensis) flower buds. Plant Molecular Biology, 30: 373-379. DOI:10.1007/BF00020124 |
Confalonieri M, Allegro G, Balestrazzi A, et al. 1998. Regeneration of Populus nigra transgenic plants expressing a Kunitz proteins inhibitor(Kti3) gene. Mol Breed, 4: 137-145. DOI:10.1023/A:1009640204314 |
Dominique M, Line C, Michel B B, et al. 1996. Identification of stable plant cystatin /nematode proteinase complexes using mildly denaturing gelatin/polyacrylaminde gel electrophoresis. Electrophoresis, 17: 1373-1379. DOI:10.1002/elps.1150170816 |
Domoney C, Welham T, Sidebottom C, et al. 1995. Multiple isoforms of pisum inhibitors result from modification of two primary gene products. FEBS Lett, 360(1): 15-20. DOI:10.1016/0014-5793(95)00070-P |
Edwards P J, Wratten S D, Cox H. 1985. Wound-induced changes in the acceptability of tomato to larvae of Spodoptera littoralis: A laboratory bioassay. Ecol Entomol, 10: 155-158. DOI:10.1111/j.1365-2311.1985.tb00544.x |
Godbole S A, Krishna T G, Bhatia C R. 1994. Purification and characterization of proteinase inhibitors from pigeon pea (Cajanus cajan (L)Mill), seeds. J Sci Food Agric, 64: 87-93. DOI:10.1002/jsfa.2740640113 |
Green T R, Ryan C A. 1972. Wound-induced proteinase inhibitors in plant leaves: A possible defense mechanism against insect. Science, 175: 776-777. DOI:10.1126/science.175.4023.776 |
Hamato N, Takano R, Kamei-Hayashi K, et al. 1992. Purification and characterization of serine proteinase inhibitor from gourd (Lagenaria leucantha rushy var.gourda Makino)seeds. Bios Biotechnol Biochem, 56(2): 275-279. DOI:10.1271/bbb.56.275 |
Haruta M, Major I T, Christopher M E, et al. 2001. A Kunitz trypsin inhibitor gene family from trembling aspen(Populus tremuloides Michx): Cloning, functional expression, and induction by wounding and herbivory. Plant Mol Bio, 46: 347-359. DOI:10.1023/A:1010654711619 |
Hilder V A, Gatehouse A M R, Sheerman S E, et al. 1987. A novel mechanism of insect resistance engineered into tobacco. Nature, 300: 160-163. |
Hirasiki I, Ogata F, Yoshida N, et al. 1990. Purification and complex formation analysis of a cysteine proteinase inhibitor(cystatin) from seeds of Wisteria floribunda. J Biochem, 108(4): 604-608. DOI:10.1093/oxfordjournals.jbchem.a123250 |
Ikeda K, Kusano T. 1978. Isolation and some properties of a trypsin inhibitor from buckwheat. Agric Biol Chem, 42: 309-314. |
Johnson R, Narvaez J, Gynheung A, et al. 1989. Expression of proteinase I and II in transgenic tobacco plant: effect on natural defense against Manduca Sexta larva. Proc Narl Acad Sci USA, 88: 9871-9875. |
Joshi B N, Sainani M N, Bastawade K B, et al. 1999. Pear millet cysteine proteinase inhibitor. Evidence for the presence of two distinct sites responsible for anti-fungi and anti-feedent activities. Eur J Biochem, 265(2): 556. DOI:10.1046/j.1432-1327.1999.00764.x |
Joshi B N, Sainani M N, Bastawade K B, et al. 1998. Cysteine proteinase inhibitor from pear millet: a new class of antifungi protein. Biochem Biophys Res, 246(2): 382-387. DOI:10.1006/bbrc.1998.8625 |
Joubert F J. 1990. Sulphhydryl proteinase inhibitors from pineapple plants stem. J Biochem, 22(12): 1401-1406. |
Kamel G, Jesus V, Pilar L, et al. 2001. A constitutive cystatin-encoding gene from barley (Icy) responds differentially to abiotic stimuli. Plant Molecular Biology, 45(5): 599-608. DOI:10.1023/A:1010697204686 |
Katia Valevski S, Fernandes F A, Campos P, et al. 1991. The expression of papain inhibitor during development of cowpea seeds. Plant Science,, 74: 179-184. DOI:10.1016/0168-9452(91)90044-9 |
Keiko D, Yoshiaki K, Nobuyuki Y, et al. 1998. Molecular cloning, functional expression, and mutagenesis of CDNA encoding a cysteine proteinase inhibitor from sunflower seeds. J Biochem, 124: 911-916. DOI:10.1093/oxfordjournals.jbchem.a022207 |
Klaus W, Mary O. 1996. The reliability of molecular weight determination by Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis. The Journal of Biological Chemistry, 244(16): 4406-4412. |
Kouzuma Y, Yamasaki N, Kimura M, et al. 1997. Cloning, expressing, and mutagenesis of trypsin inhibitor ETIb from Erythrina variegata seeds. Biosci Biotechnol Biochem, 61(6): 1041-1043. DOI:10.1271/bbb.61.1041 |
Krishnamoorthi R, Gong Y, Richorrdson M. 1990. A new protein inhibitor of trypsin and activated Hageman factor from pumpkin(Cucurbita maxima), seeds. FEBS Lett, 273: 163-167. DOI:10.1016/0014-5793(90)81075-Y |
Lee C F, Lin J F. 1995. Amino acids sequence of trypsin inhibitor from the melon. J Biochem, 118(1): 18-22. |
Lipke H, Fraenkel G S, Leiner I. 1954. Effect soybean inhibitor on the growth of Tribolium confusum. A Food Chem, 2: 410-414. DOI:10.1021/jf60028a003 |
Loze B, Tatjana P, Anka R, et al. 1998. Erated cystatin inhibitors from leaf and from seeds Phaseolous vulgaris L.. Plant Science, 138: 17-26. DOI:10.1016/S0168-9452(98)00147-2 |
Makoto K, Tomoko I, Daisuke F, et al. 1995. Primary structure of a cysteine proteinase inhibitor from the fruit of Avocado (Persea Americana Mill). Biosci Biotech Biochem, 59(12): 2328-2329. DOI:10.1271/bbb.59.2328 |
Masoud S A, Johnson L B, White F F, et al. 1993. Expression of a cysteine proteinase inhibitors (oryzacystatin-I) in transgenic tobacco plants. Plant Molecular Biology, 21: 655-663. DOI:10.1007/BF00014548 |
Massimo d, Gianni A, Beatrice B, et al. 2001. Transformation of white poplar (Populus alba L.) with noval Arabidopsis thaliana cysteine proteinase inhibitor and analysis of insect pest resistance. Molecular Breeding, 7: 35-42. DOI:10.1023/A:1009605001253 |
Menegatti E, Tedeschi G, Ronchi S, et al. 1992. Purification and partial proper ties and amino acid sequence of a new serine proteinase inhibitor from white mustard(Sinapis abla) seed. FEEBS Lett, 301(1): 10-14. DOI:10.1016/0014-5793(92)80199-Q |
Mickel C E, Standiah J, Mich J. 1947. Susceptibility of processed soy flour and soy grits in storage to attack by Tribolium castaneum. University of Minnesota. Agric Exp tech Bull, 178
|
Monica P, Rosa S M, Luis G, et al. 1998. A chestnut seed cystatin differentially effective against cysteine proteinases from closely related pests. Plant Molecular Biology, 38: 1235-1242. DOI:10.1023/A:1006154829118 |
Moura D S, Ryan C A. 2001. Wound-inducible proteinase inhibitor in pepper. differential regulation upon wounding, systeminn and methyl jasmonate. Plant Physiology, 126: 289-298. DOI:10.1104/pp.126.1.289 |
Norimura H, Hirashiki I, Ogata F, et al. 1990. Purification of Bowman-Birk type inhibitor of high molecular weight from wisteria seeds. Agric Biol Chem, 54: 3029-3030. |
Octavio L F, Maria F G, Mauricio P S, et al. 2002. Overlapping binding site for trypsin and papain on a Kunitz-type proteinase inhibitor from Prosopsis juliflora. Proteins: structure, function and genetics, 49: 335-341. DOI:10.1002/prot.10228 |
Otlewski J. 1990. Inhibitor of serine proteinase by squash inhibitor. Biol chem Hoppe-sevler, 371(7): 589-594. |
Paulra J K. 2002. Lawrence, Kripa Ram Koundal Plant protease inhibitor in control of phytophageous insects. Electronic Journal of Biotechnology, 5(1): 93-109. |
Rogerio M, Emerson M R, Vincent V. 1998. Structural and phylogenetic relationships among plant and animal cystatins. Arc of Bio and Bioph, 359(1): 24-30. DOI:10.1006/abbi.1998.0875 |
Ryan C A. 1990. Proteinase inhibitor in plants:Gene for improving defense against insects and pathogens. Annu Rev Phytopath, 28: 425-449. DOI:10.1146/annurev.py.28.090190.002233 |
Ryan S N, Laing W A, McManus M T. 1998. A cysteine proteinase inhibitor purified from apple fruit. Phytochemistry, 49: 957-963. DOI:10.1016/S0031-9422(98)00206-4 |
Schuler T H, Poppy G M, Kerry B R, et al. 1998. Insect-resistant transgenic plants. Trends Biotechnol, 16: 168-175. DOI:10.1016/S0167-7799(97)01171-2 |
Sliva V R, Magdalena S N, Alicia C L, et al. 1993. Purification, characterization and complete amino acid sequence of a trypsin inhibitor from maranth(Amaranthus hypochondriacus)seeds. Plant Physiol, 103(1): 1407-1412. |
Sores-costa A L M, Beltramini, Thiemann O H, et al. 2002. A sugarcance cystatin: recombinant expression, purification, and antifungal activity. Biochemical and Biophysical Research Communication, 296: 1194-1199. DOI:10.1016/S0006-291X(02)02046-6 |
Sryant J, Green T R, Gurusaddaiah T, et al. 1976. Proteinase inhibitor Ⅱ from potatoes :Isoloation and characterization of its promoter components. Biochemistry, 15: 3418-3824. DOI:10.1021/bi00661a004 |
Stuart N R, Michael T M, William A L. 2003. Identification and characterization of proteinase inhibitors and the gene from seeds of apple (Malus domestica). J Biochem, 134: 31-42. DOI:10.1093/jb/mvg110 |
Stuart N R, William A L, Michael T M. 1998. A cysteine proteinase inhibitor purified from apple fruit. Phytochemistry, 49(4): 957-963. DOI:10.1016/S0031-9422(98)00206-4 |
Suh S G, Cho J K, Suh E J, et al. 1999. Immunocytochemical intracellular coculization of the 22-ku Kunitz-type potato proteinase inhibitor in potato tubers and leaves. J Plant physiology, 155: 533-537. DOI:10.1016/S0176-1617(99)80050-9 |
Terada S, Fujimura S, Katayama H, et al. 1994. Purification and characterization of two Kunitz family subtilisin inhibitors from seeds of Canavalia lineata. J Biochem, 115(3): 369-372. DOI:10.1093/oxfordjournals.jbchem.a124345 |
Terence A, Wayne P. 1991. Two kunitz type proteinase inhibitors from potato tubers. Plant Physiol, 97: 15-18. DOI:10.1104/pp.97.1.15 |
Wu C, John R. 1990. Purification and partial characterization of trypsin/chymotrypsin inhibitors from red kidney beans (Phaseoulus vulgaris var linden). J Agric Food Chem, 38(7): 1523-1529. DOI:10.1021/jf00097a021 |
Bian Xueyu, Brian D S, Han Yifan, et al. 1996. Midgut proteinase activities in larvae of Anoplophora glabripennis(Coloptera cerambycidae) and their interaction with proteinase inhibitors. Archives of Insect Biochemistry and physiology, 31: 23-37. DOI:10.1002/(SICI)1520-6327(1996)31:1<23::AID-ARCH2>3.0.CO;2-Y |
Yeh K W, Lin M L, Tuan S J, et al. 1997. Sweetpotato(Ipomoea batatas) trypsin inhibitors expressed in transgenic tobacco plants confer resistance against Spodoptera litura. Plant Cell Report, 16: 696-699. DOI:10.1007/s002990050304 |
Yoshiaki K, Hideko I, Keiko D, et al. 2000. Molecular cloning and functional expression of cDNA encoding the cysteine proteinase inhibitor with three cystatin domain from sunflower seeds. J Biochem, 128: 161-166. DOI:10.1093/oxfordjournals.jbchem.a022736 |
Yoshiaki K, Keiko K, Makoto K, et al. 1996. Purification, characterization, and sequence of two cysteine proteinase inhibitors, Scab and Scb, from Sunflower(Helianthus annuus)seeds. J Biochem, 119: 1106-1113. DOI:10.1093/oxfordjournals.jbchem.a021355 |
Li Z Sommer A, Dingermann T, et al. 1996. Molecular cloning and sequence analysis of a cDNA encoding a cysteine proteinase inhibitor from sorghum bicolor seedlings. Mol Gen Genet, 251(4): 499-502. |
Zhao Y, Botella M A, Subramaian L, et al. 1996. Two wound inducible soybean cysteine proteinase inhibitors have greater insect digestive proteinase inhibitory activities than a constitutive homology. Plant Physiology, 111(4): 1299-1306. DOI:10.1104/pp.111.4.1299 |
Zimacheva A B, Levleva E V, Mosolov V. 1984. Isolation and characterization of inhibitor of cysteine proteinase from potato tubers. Biokhimiya, 244: 676-685. |
Wu Y R, Danny L, Anne M, et al. 1997. Adaptation of Helicoverpa armigera (Lepidoptera: Noctuidae) to a proteinase inhibitor expressed in transgenic tobacco Molecular breeding, 3: 371-380
|
 2005, Vol. 41
2005, Vol. 41