文章信息
- 张存旭, 姚增玉, 赵忠.
- Zhang Cunxu, Yao Zengyu, Zhao Zhong.
- 栓皮栎体胚诱导关键影响因素研究
- Factors Influencing the Induction of Somatic Embryogenesis in Quercus variabilis
- 林业科学, 2005, 41(2): 174-177.
- Scientia Silvae Sinicae, 2005, 41(2): 174-177.
-
文章历史
- 收稿日期:2004-07-15
-
作者相关文章
栓皮栎(Quercus variabilis)广泛分布于华北、华南、西南地区,除能进行木材、薪材、食用菌、天麻、橡子、栲胶生产外,还是最主要的软木资源树种。栓皮栎通常采用种子繁殖,由于橡实象鼻虫的侵害和种子不耐储藏,加之扦插繁殖困难,目前主要依靠天然更新(闻天声,1991)。利用器官发生和体细胞胚胎发生离体繁殖栎类树种优良基因型(张存旭等,2004c),国外已有不少研究报道(Wilhelm, 2000;Puddephat et al., 1997;Romano et al., 1992),虽然已有栓皮栎茎段离体培养的初步研究(张存旭等, 2004a; 2004b),体胚再生植株的研究尚属空白。本试验以栓皮栎未成熟合子胚为材料,研究了基本培养基、培养条件、采样时期、激素、基因型、手术方式等对体胚诱导的影响。
1 材料与方法 1.1 材料未成熟合子胚。2002年7月中旬、8月中旬,2003年6月中旬、7月中旬,于陕西省周至县楼观台镇西楼村西南紫云殿东侧栓皮栎天然林中,从彼此相距50 m以上的4株树上采集未成熟果实,用塑料袋分装带回实验室,放入4 ℃的冰箱内保存备用。
1.2 方法1) 表面消毒 接种前以修枝剪剥去壳斗,取出完整小坚果用自来水冲洗干净。先放入70%的酒精中30 s,接着在0.1%氯化汞中消毒15~20 min,最后用无菌水冲洗3~5次。无菌条件下用解剖刀剥去果皮。7、8月份所采的材料去除种皮后接种;6月份所采的材料将种子取出后,用解剖针将种皮扎破伤口向下接种于培养基上,而并不去掉种皮和胚乳。2)体胚诱导培养基 ①以MS、WPM为基本培养基,同时添加1.0 mg·L-1TDZ和2, 4-D;②以MS为基本培养基,单独添加0、0.5、1.0、2.0 mg·L-1 6-BA;③以MS为基本培养基,同时添加0、0.5、1.0、2.0 mg·L-1 6-BA和0.1、0.5 mg·L-12, 4-D。3)光照条件试验 将2002年7月采集的未成熟合子胚接种于1号体胚诱导培养基上,分光、暗2种培养条件进行培养。4)合子胚采样时期试验 将2002年8月中旬、2003年6月和7月中旬采自同一母树的未成熟合子胚接种于2号体胚诱导培养基上。5)母树基因型试验 将2003年7月采自4株树上的未成熟合子胚,分别接种于添加0.5 mg·L-1 6-BA的MS培养基上。6)合子胚手术试验 将2003年7月采自同一株树上的合子胚切去部分器官,分别以①近根端的半个胚;②具胚轴的整片子叶;③无胚轴的整片子叶;④具胚轴的整片子叶作为外植体,分别接种于添加0.5 mg.L-16-BA的MS培养基上,全胚为对照。7)培养环境 培养室温度(25±3) ℃,光照强度1 000~2 000 lx, 光照周期16 h·d-1,相对湿度40%~70%。暗培养置于同一温度条件下,无光照,并在培养瓶上覆2层黑布。8)统计分析 所有处理均为10个外植体,重复3次。以上各试验中,外植体首先在上述培养基中诱导4~5周,再转入相应的无激素培养基中诱导体胚的分化和发育。8周后观察记录体胚诱导情况。采用SAS软件对数据进行处理。9)形态观察 采用Motic解剖镜观察外部形态并记录照相。
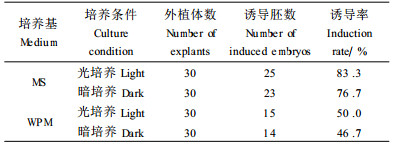
2 结果与分析 2.1 基本培养基对体胚诱导的影响将栓皮栎未成熟合子胚以全胚的方式接种于同时添加1.0 mg·L-1TDZ和2, 4-D的MS和WPM培养基上, 1周左右即见在伸长的胚轴上有白色半透明或无色透明的早期体胚,以及颗粒状愈伤组织。诱导率见表 1,与WPM相比,培养于MS上的合子胚不但生长健壮,胚轴伸长迅速,诱导出的体胚数量较多,个体较大,而且诱导率也较高(F1, 9=69.23, P<0.000 1)。
|
|
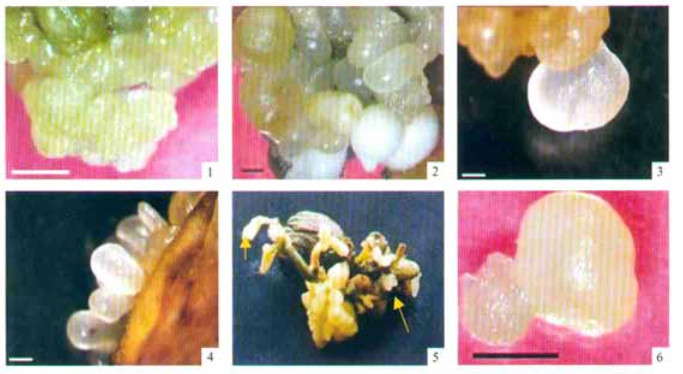
光照条件下,合子胚生长旺盛,一段时间后子叶变绿,下胚轴停止伸长,少数长出根。暗培养条件下,外植体能长时间保持新鲜,下胚轴伸长的同时也有根的形成。无论是光培养还是暗培养,合子胚萌发形成的根均不能正常生长,而是膨大并形成米黄色的紧实愈伤组织。这类愈伤组织虽然生长最为迅速,但经过数代培养仍无体胚发生。培养条件对体胚诱导率并无显著影响(F1, 9=2.77, P=0.130 5),但光培养下的体胚生长迅速而且健壮,多为乳白色或淡黄绿色(图版Ⅰ-5),个体较大;暗培养下的体胚则多为无色透明或白色半透明,部分体胚在发育过程中会愈伤组织化。暗培养诱得的胚性愈伤组织颜色较淡,生长旺盛,但在去掉激素后需要较长的时间才能有体胚发生。
|
图版Ⅰ Plate Ⅰ |
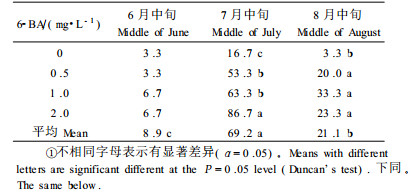
将不同采样时期的未成熟合子胚,接种于不同浓度6-BA的MS培养基上,体胚诱导率见表 2。7月中旬的合子胚体胚诱导率远高于其他2个时期(F2, 30=48.48, P<0.000 1)。6月中旬的合子胚初代培养4周后才出现鱼雷形体胚,9周后才有部分体胚发育到子叶期。7月中旬和8月中旬的合子胚培养1周左右,即见在伸长的胚轴上有白色半透明或无色透明的早期体胚以及颗粒状愈伤组织形成,2周后即有部分直接体胚发育至子叶期,将初代愈伤组织继代于无激素MS培养基上6周后,即见有间接体胚发育至子叶期。
|
|
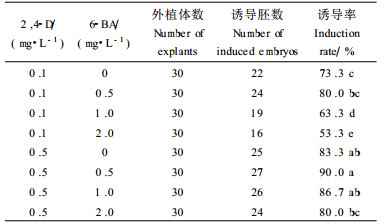
栓皮栎未成熟合子胚在无激素的MS培养基上也能诱导体胚发生,但诱导率较低(表 2),添加激素可以显著提高7月份和8月份未成熟合子胚的体胚诱导率(表 1~3)。
|
|
单独使用6-BA以直接体胚发生为主,合子胚萌发后,在胚轴上形成簇生的体胚,有些合子胚萌发形成的幼嫩苗茎上也产生了单生体胚(图版Ⅰ-5),少数合子胚在膨大的子叶上也有体胚形成。这些体胚为乳白色或淡黄绿色,个体较大且大小较为一致,发生较早,发育迅速,2周后即有部分体胚发育至子叶期。
|
|
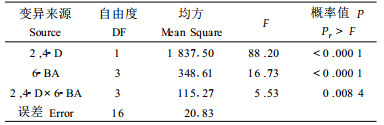
2, 4-D无论是单独使用还是与6-BA或TDZ配合使用,均以间接体胚发生为主。在合子胚伸长的胚轴上形成米黄色或无色透明的颗粒状愈伤组织(图版Ⅰ-1)。这些愈伤组织生长迅速,在转入无激素培养基后会分化出大量体胚(图版Ⅰ-2),但是如果长时间在含有2, 4-D的培养基上培养,则会在其表面产生白色细腻质地松软的新愈伤组织。间接体胚多呈簇生状(图版Ⅰ-2),一般数个体胚合生在一起。有些体胚则在基部产生次生体胚(图版Ⅰ-6)。单独使用2, 4-D时合子胚萌发受到抑制,胚轴的伸长和膨大缓慢,形成的胚性愈伤组织不多。2, 4-D与6-BA或TDZ配合使用时,虽然胚轴的伸长受到一定的抑制,但其膨大迅速,表面形成的愈伤组织较多,诱导率也较高。
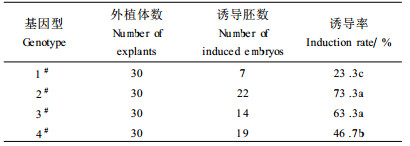
2.5 基因型对体胚诱导的影响统计分析表明:母树基因型对体胚诱导率有显著影响(F3, 8=43.00, P<0.000 1)。2#和3#诱导率较高,4#次之,1#最低(表 5)。采自1#和4#母树的部分合子胚朝正常发育途径进行,即长根和抽梢。观察发现2#、3#母树合子胚的体积明显小于1#和4#,同时也发现在采种地的同一林分中,不同个体上的种子发育程度不同,物候不齐,果落期前后相差近半月。
|
|
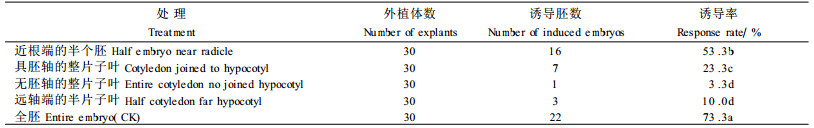
将合子胚按不同手术方式接种,全胚为对照。结果发现,胚的手术加剧了褐变,部分体胚因褐变而死亡。在伤口处并无体胚或愈伤组织产生。合子胚手术后,胚轴伸长受抑,子叶也膨大较少,整个外植体长势较弱。合子胚的手术对诱导率有显著影响(F4, 10=56.93, P < 0.000 1)。全胚接种不仅诱导率最高,而且长出的体胚数量也多,品质也好。手术切除部分子叶后体胚仍然主要发生于胚轴(图版Ⅰ-4)。无胚轴的子叶体胚诱导率较低(表 6)。
|
|
栎属植物体胚诱导大多以MS或WPM为基本培养基(张存旭等,2004c;Wilhelm,2000)。本试验结果表明,MS的无机盐含量高,微量元素种类齐全,浓度也较高(李浚明,1992),有利于栓皮栎幼胚的体胚发生。特别是MS中含有重金属Co2+,可以提高体胚诱导频率,加速胚性愈伤组织发生,是乙烯形成酶(EFE)的抑制剂。乙烯抑制体胚发生,多胺促进体胚发生,而乙烯和多胺的生物合成又是相互抑制的(黄学林等,1995)。
不同树种不同外植体对光的敏感性不同。欧洲白栎(Q. rubra)的幼嫩叶盘只有在光下才会有体胚发生,而幼胚则在16 h光下和暗培养中均有体胚发生,但后者诱导率较高(Rancillac et al., 1996);青冈栎(Cyclobalanopsis glauca)的体胚诱导只能在光下进行,移至黑暗处则不再形成体胚,转而形成愈伤组织(王亚男,2001);北美鹅掌楸(Liriodendron tulipifera)胚状体在黑暗条件下发育健壮,在光下多形成畸形胚,且生长缓慢(Merkle,1990)。光照和暗培养均能诱导栓皮栎未成熟合子胚的体胚发生,诱导率无显著差异,但光培养下诱导出的体胚品质较佳。
一般来讲,处于分化程度较低的组织更有利于体胚的诱导发生。未成熟合子胚是诱导体胚发生的最好材料,尤以心形胚期到早子叶期幼胚为最佳(Wilhelm,2000)。但是,处于发育早期的合子胚体积小,分离困难,而且抗性差,离体培养容易夭亡,对培养基要求较为严格。不同发育时期的未成熟合子胚体胚诱导率差异很大,花后第2年7月中旬的未成熟合子胚体胚诱导率较高。
激素是影响体胚发生发育的重要因素之一。6-BA和TDZ是常用于体胚诱导的2种细胞分裂素,可单独使用也可与生长素类激素配合使用。在以往,6-BA可单独使用来诱导体胚,效果不错;近年来,组织培养诱导体胚时最常用的则是TDZ,其不仅对外植体种类作用范围大,且诱导率也较高。6-BA和TDZ的体胚诱导效率可能因物种和使用浓度而异。本试验以未成熟合子胚作为外植体对单独使用6-BA或TDZ作了比较。二者相比:6-BA诱导速度快,诱导出的体胚数量较多,大小一致,品质较佳;TDZ诱导出的体胚数量少,品质差,同时也能诱导出少量的愈伤组织。王亚男等(2001)以青冈栎的未成熟合子胚作为外植体,也得到类似的结果。6-BA或TDZ与2, 4-D配合使用时,诱导效果无明显差异。据徐华松等(1996)报道TDZ可以促进乙烯的产生,其促进效应远大于6-BA。2, 4-D是诱导体胚发生的重要激素。细胞分裂素和生长素间交互效应对体胚诱导影响显著,有的树种对细胞分裂素和生长素的配比有一定要求,如欧洲白栎叶片诱导体胚时2类激素之比不能小于1(Rancillac et al., 1996)。以栓皮栎未成熟合子胚外植体诱导体胚发生时,在诱导培养基中含有2, 4-D时以间接体胚发生为主,同时诱导愈伤组织和体胚形成,而只有去掉2, 4-D后才会有大量体胚形成。否则会抑制体胚的正常发育,诱导产生球形次生体胚,部分愈伤组织变为水煮状而死亡。
基因型是影响体细胞胚胎发生的重要内在因素。麻栎(Q. acutissima)的各个家系幼胚的大小和培养条件都相同时,有的家系体胚诱导率高达91.2%,而有的家系没有体胚发生(Kim et al., 1997);不同地理起源的欧洲白栎幼苗叶片体胚诱导率变化也很大(0~56%)(Rancillac et al., 1996)。本试验中4棵母树诱导率的差异最高达3倍多,这种差异说明,体胚发生能力很大程度受遗传的影响。当然,同一母树在不同培养基及其激素组合上的表现也有不同(表 2)。因此,体胚诱导率不仅取决于基因型,而且受环境的影响。
胚的离体手术试验是研究胚的各个组成部分形态发生潜力的重要手段之一(李浚明,1992)。本试验观察到未成熟合子胚伸长的胚轴是体胚发生的主要部位。但是在胚轴的伸长过程中,子叶起着重要作用。失去部分子叶后,胚轴伸长受到抑制,因而诱导出的体胚数量减少。切割刺激,并未使切口处形成愈伤组织或体胚,反而影响了胚轴的伸长和合子胚的健康生长,加剧了褐变,对合子胚造成了毒害。
黄学林, 李筱菊. 1995. 乙烯和多胺的生物合成与植物体细胞胚胎发生. 植物生理学通讯, 31(2): 81-85. |
李浚明. 1992. 植物组织培养教程. 北京: 中国农业大学出版社, 233-236.
|
王亚男, 章友萱. 2001. 青冈栎之组织培养——体胚之诱导. 中华林学季刊, 34(2): 147-159. |
闻天声. 1991. 栓皮栎的培养与用途. 中国林副特产, 17(2): 29. |
徐华松, 徐九龙, 黄学林. 1996. TDZ在植物组织培养中的作用. 广西植物, 16(1): 77-80. |
张存旭, 宋敏, 赵忠, 等. 2004a. 植物生长调节物质对栓皮栎茎芽增殖和生长的影响. 西北林学院学报, 19(2): 64-66. |
张存旭, 宋敏, 赵忠. 2004b. 栓皮栎茎段离体培养的研究. 西北植物学报, 24(7): 1260-1265. |
张存旭, 姚增玉. 2004c. 栎属植物体细胞胚胎发生研究现状. 西北植物学报, 24(2): 356-362. |
Kim Y W, Youn Y, Noh E R, et al. 1997. Somatic embryogenesis and plant regeneration from immature embryos of five families of Quercus acutissima. Plant Cell Rep, 16: 869-873. DOI:10.1007/s002990050336 |
Merkle S A. 1990. Maturation and conversion of Liriodendron tulipifera somatic embryos. In Vitro Cell Dev Biol, 26: 1086-1093. DOI:10.1007/BF02624445 |
Puddephat I J, Alderson P G, Wright N A. 1997. Influence of explant source, plant growth regulator and culture environment on culture initiation and establishment of Quercus robur L. in vitro. Journal of experimental botany, 309(48): 951-962. |
Rancillac M, Klinguer A, Klinguer S, et al. 1996. Preliminary investigation on somatic embryogenesis from leaf discs of red oak(Quercus rubra L.). Plant Growth Regul, 20: 67-73. DOI:10.1007/BF00024061 |
Romano A, Noronha C, Martins-loucao M A. 1992. Influence of growth regulators on shoot proliferation in Quercus suber L. Annals of botany, 70: 531-536. DOI:10.1093/oxfordjournals.aob.a088513 |
Wilhelm E. 2000. Somatic embryogenesis in oak (Quercus spp.). In Vitro Cell Dev Biol Plant, 36: 349-357. DOI:10.1007/s11627-000-0062-y |
 2005, Vol. 41
2005, Vol. 41