文章信息
- 白钢, 王玉嬿, 马洪周, 李海燕, 杨文博.
- Bai Gang, Wang Yuyan, Ma Hongzhou, Li Haiyan, Yang Wenbo.
- 疫木中松材线虫的免疫学检测方法的研究
- Development and Application of an Immunoassay Method for Identification of Bursaphelenchus xylophilus in Pinewood
- 林业科学, 2005, 41(2): 91-95.
- Scientia Silvae Sinicae, 2005, 41(2): 91-95.
-
文章历史
- 收稿日期:2003-03-03
-
作者相关文章
2. 国家林业局森林病虫害防治总站 沈阳 110034
2. General Station of Forest Pest and Disease Control, The State Administration of Forestry Shenyang 110034
松材线虫(Bursaphelenchus xylophilus)是对松树具有严重危害的一种病原生物,它借助于媒介昆虫松墨天牛(Monochamus alternatus)成虫传播危害松树,造成严重的松林毁灭性灾害,为国内外重要的森林植物检疫对象。自从1982年秋在南京紫金山松林中首次发现松材线虫病害后,至今已有多个省份观测到松材线虫病害的存在,对我国国民经济及生态环境等造成十分巨大的损失。目前因对松材线虫病的防治尚无经济有效的措施,严格检疫是阻止该病的发生、传播和蔓延的最重要的途径之一,因此多年来松材线虫病的检测方法的研究一直是一个热点(陈玉惠等,2001)。长期以来对松材线虫的鉴定多采用传统的形态学鉴定方法,20世纪80年代以后,采用聚丙烯酰胺凝胶电泳的同工酶分析(胡凯基等,1995)、PCR-RFLP(陆伟等,2001)、RAPD(张路平等,2002)以及PCR-SSCP(张立海等,2001)分析等分子生物学技术,在鉴别松材线虫和拟松材线虫株系的理论研究方面取得了一定进展。本文利用免疫学原理,建立微量线虫蛋白的ELISA检测方法,可直接用于测定疫木中的松材线虫,为疫木的快速鉴定及口岸检疫提供一种实用型的新方法。
1 材料和方法 1.1 材料试剂:弗氏佐剂(GIBCOBRL);硝酸纤维素膜(MILLIPORE);辣根过氧化物酶(HRP)标记羊抗兔IgG,邻苯二胺(OPD),3, 3′-二氨基联苯胺(DAB),牛血清白蛋白(BSA)购于华美生物工程公司,其他试剂均为分析纯。
主要仪器:酶标仪(BIOTECH,ELX800),冷冻干燥机(Christ,ALPHA1-4),高速冷冻离心机(Beckman,20RP52D),电泳及电转移系统(国产),超声波细胞粉碎仪(国产)。
1.2 线虫样品的制备本试验从江苏、安徽、浙江、广东、湖南等地共采集了25株黑松(Pinus thunbergii)和45株马尾松(P. massoniana)样木,分别采用贝尔曼漏斗法分离线虫,镜检,根据形态学分类法鉴定线虫的种类。并根据分离到的线虫的量以及纯度(95%以上)筛选出了7个株系的线虫进行研究,其中松材线虫4株,拟松材线虫3株。然后再分别对所选中的样木,仍采用贝尔曼漏斗法收集线虫,收集后即置于冰箱内冷藏,逐渐积累线虫,直到足够分析用的量,作为本试验线虫样品。
1.3 抗松材线虫血清(Anti-BX抗松)的制备取清洗后的松材线虫(1~10万条)记数,并加入2 mL PBS (0.01 mol·L-1磷酸缓冲液,0.1 mol·L-1 NaCl, pH7.2)中,于冰水浴中超声波粉碎虫体(200 W,10 min)。4 ℃,3 000 r·min-1离心10 min,以Lowry法(Lorry et al., 1951)测定蛋白含量,约67条线虫的蛋白含量为1 μg。取上述1 mg·mL-1松材线虫蛋白提取液1 mL与等体积的弗氏完全佐剂混合乳化后,对家兔皮下进行多点注射进行免疫。每隔2周加强注射一次,定期测定抗血清效价,待获得最高效价后,收集血清,灭活,-20 ℃保存备用。
1.4 抗体效价的测定取松材线虫抗原溶液于0.05 mol·L-1 NaHCO3缓冲液(pH 9.6)中,制成10 μg·mL-1包被液。取100 μL包被液于酶标板的各孔中,室温放置3 h,包被酶标板。以200 μL封闭液(0.01 mol·L-1磷酸缓冲液,0.1 mol·L-1 NaCl,1% BSA,0.1% NaN3,pH7.2)室温放置3 h,封闭酶标板。分别加入以稀释液(0.01 mol·L-1磷酸缓冲液,0.01 mol·L-1 EDTA,0.1% BSA,pH7.4)系列稀释的Anti-BX血清100 μL,室温反应3 h。用200 μL PBST(0.01 mol·L-1磷酸缓冲液,0.1 mol·L-1 NaCl,0.1% Tween 20,pH7.2)清洗4次后,加入2 000倍稀释的辣根过氧化物酶(HRP)标记羊抗兔IgG的酶标二抗100 μL,室温反应1 h。PBST清洗4次后,加入新配OPD底物溶液(0.5 mg·mL-1邻苯二胺,0.012% H2O2,0.1 mol·L-1柠檬酸缓冲液,pH5.2)100 μL,反应5 min后,加入50 μL 1 mol·L-1 H2SO4终止反应,于490 nm处测定吸光度。
1.5 免疫印迹分析分别取松材线虫BX a, b, c, d以及拟松材线虫BM a等5种抗原(20~40 μg·well-1),按照Laemmli方法(1970)采用10%SDS-PAGE凝胶电泳分离线虫蛋白。按照Towbin方法(1979)将分离的线虫抗原电转移至硝酸纤维素膜上。经封闭液封闭后,加入1 000倍稀释的Anti-BX血清10 mL,室温反应3 h。以PBST充分冲洗后,加入500倍稀释的HRP标记的羊抗兔IgG抗体溶液5 mL,室温继续反应1 h,充分洗涤,加入DAB底物显色。
1.6 ELISA检测方法的建立取10 μg·mL-1松材线虫抗原溶液100 μL于酶标板的各孔中,包被酶标板。封闭后,分别加入系列稀释的线虫抗原溶液(或样品)100 μL,和20 000倍稀释的Anti-BX血清100 μL,室温反应6 h。PBST清洗后,分别加入2 000倍稀释的酶标二抗100 μL,室温反应1 h。充分冲洗后,再加入OPD底物显色,并于490 nm处测定吸光度。
2 结果与分析 2.1 松材线虫特异性抗原的分析经4次追加注射后,Anti-BX血清对松材线虫抗原包被的固相显示很高的结合活性。线虫中的特异性抗原采用免疫印迹方法,通过对松材线虫和拟松材线虫5种抗原样品的分析进行了确认(图 1)。凝胶分析的结果表明,2种线虫在22~99 ku之间存在多种相近的蛋白成分,其中31和40 ku处较明显。免疫印迹的结果也表明Anti-BX血清对2种线虫中存在40 ku以上的蛋白显示良好的反应性,分别在40, 43, 64和78 ku等多处均呈现了相同的抗原带。虽然在22,34,99 ku处线虫蛋白存在一定的差别,但Anti-BX血清尚不能明确地区分2种线虫。

|
图 1 5种线虫的SDS-PAGE和免疫印迹分析 Fig. 1 SDS-PAGE and western blot analyses of five kinds of nematode |
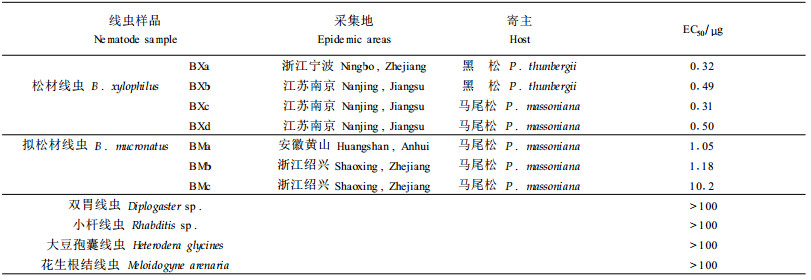
以松材线虫蛋白为固相抗原,使抗Anti-BX抗体与游离松材线虫抗原和固相抗原相竞争,以HRP标记的羊抗兔IgG为示踪抗体,如图 2所示,在0.1~10 μg·well-1浓度范围内,线虫蛋白浓度与HRP的结合酶活性呈现良好的剂量关系。该竞争型ELISA在上述测定范围内的变异系数(c.v.)为1.6%~8.2% (n=5),检测灵敏度为0.1 μg·well-1。特异性的考察结果表明(表 1),5种松材线虫呈现良好的反应性,其50%的抑制酶活性(EC50)在0.31~0.50 μg之间。拟松材线虫也呈现了一定的交叉反应,其EC50为1.05~10.2 μg明显高于松材线虫,松树中腐生的小杆目的双胃线虫、小杆线虫,以及其他植物线虫如大豆孢囊线虫和花生根结线虫则未检出,说明该方法对松材线虫和拟松材线虫具有一定的专属性。

|
图 2 线虫蛋白的ELISA法测定曲线 Fig. 2 Typical dose response curves of nematode antigen measured by ELISA method |
|
|
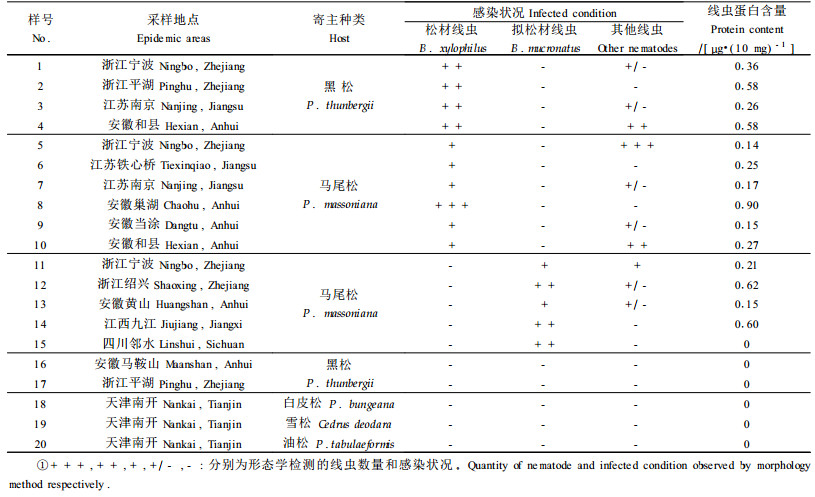
分别将2002年8—11月采自安徽、浙江、江苏、江西、四川和天津等松材线虫病疫区和非疫区不同类型的松木样木共计20株,分别利用贝尔曼漏斗法进行线虫分离,根据形态学分类方法进行常规检验(表 2),确认松材线虫疫木10株(No.1~10),无松材线虫但有拟松材线虫的病死木或濒死木5株(No.11~15),无任何线虫的健康木5株(No.16~20)。分别用电钻在木质部多点钻取以上样木的木屑,混匀后各取1 g木屑于10 mL PBS中超声波处理,各取上清液100 μL,用上述ELISA法检测线虫抗原含量,每个样品重复测定3次,结果取平均值列于表 2。
|
|
测试结果表明,感染松材线虫的4株黑松和6株马尾松疫木均被检出,5株健木的线虫蛋白含量均为0。另外,拟松材线虫也呈现一定的交叉反应,5株感染了拟松材线虫的马尾松中有4株被检出,说明该方法尚不能区分松材线虫和拟松材线虫。但与健木相对照,松材线虫感染疫木的检出率为100%,形态学鉴定的感染状况也同ELISA法的检测结果基本相符合,疫木中混生的其他线虫如腐生线虫对ELISA检测不产生干扰。
3 讨论生物物种的多样性基于基因的多态性,而基因的多态性可以体现在形态表征、组成成分等不同的水平上。分子生物学技术的发展使松材线虫的鉴定从传统的形态表征、理化性质的判别扩展到生物信息大分子如DNA、RNA和蛋白质等生命信息载体的研究。抗体作为分析试剂则具有优越的特异性和亲和性,分析样品不需要或只要简单的预处理即可直接测定,并且具有较高的稳定性,因此已广泛应用于细菌、病毒、支原体等的定性定量的检测手段。
Lawler等(1993a)曾采用以葡萄孢培养的松材线虫和拟松材线虫提取总蛋白为材料,分别免疫家兔制备抗血清,用ELISA和免疫印迹方法鉴定线虫。培养线虫提取物的SDS-PAGE电泳分析的结果未见二者的明显区别,以其制备的抗血清之间也呈现一定的交叉反应,其中31~97 ku的线虫蛋白为主要抗原。进一步,Lawler等(1993b)用抗松材线虫的多克隆抗体检出了存在于欧洲赤松(Pinus sylvestris)木材表面的0.4 μg微量的线虫蛋白质,相当于25条线虫。但由于Lawler等认为木材的种类和感染情况的不同,松材线虫常常以1至10条不等的数量分散或聚集于木材内部,因而未能对自然感染松材线虫的疫木进行更深入的研究。本研究以直接从疫木上分离的松材线虫为抗原制备抗血清,可避免人工培养中产生的非特异性干扰提高了特异性,采用竞争型ELISA法本研究可检测出10 mg木屑中0.1 μg微量线虫蛋白质,约相当于7条线虫。试验结果表明,形态学鉴定的结果同免疫学的检测数据基本吻合,树种、采样地点和疫木中其他腐生线虫等因素并不影响该方法的检测结果。
松材线虫和拟松材线虫均为伞滑刃属的种,这2种线虫常混生或单独出现在病树木上,二者形态极其相似,较难区分(张路平等,2000)。同工酶谱以及基因的多态分析等分子生物学的研究结果也表明二者有十分相近的同源性,给鉴定带来了不便,但也存在一定的差异。本研究虽然利用多克隆抗体不能完全区分2种线虫,但能发现特定松材线虫株系的特异性抗原之间存在一定的差异,这同Lawer研究的结果相吻合,也为进一步筛选松材线虫的特异性抗原,制备其单克隆抗体,建立松材线虫的特异性免疫学分析方法提供了可能性。从这个角度来看,这种方法优于利用有机溶液萃取被检木再进行指示反应的检测方法(王玉嬿等,2001)。
综上所述,建立快速免疫学鉴定方法可以为松材线虫检疫提供实用的方法,与电泳法和核酸分析相比,免疫学检测具有简便快速、利于普及应用的特点,对森林检疫特别是口岸检疫具有重要的意义。
陈玉惠, 叶建仁, 魏初奖. 2001. 松材线虫病诊断方法研究进展. 南京林业大学学报, 25(6): 83. DOI:10.3969/j.issn.1000-2006.2001.06.022 |
胡凯基, 杨宝君. 1995. 松材线虫和拟松材线虫不同株系酶电泳的研究. 林业科学研究, 8(1): 73-77. |
刘伟, 杨宝君, 徐福元, 等. 1998. 松材线虫病早期诊断的研究——马尾松、黑松松材线虫病树的早期诊断. 林业科学研究, 11(5): 455-460. DOI:10.3321/j.issn:1001-1498.1998.05.001 |
陆伟, 陈学新, 郑经武, 等. 2001. 松材线虫和拟松材线虫rDNA中ITS区的比较研究. 农业生物技术学报, 9(4): 387-391. DOI:10.3969/j.issn.1674-7968.2001.04.021 |
王玉嬿, 李海燕, 舒朝然, 等. 2001. 几种松树松材线虫病木和健木pH值差异的研究. 植物病理学报, 31(4): 342-348. DOI:10.3321/j.issn:0412-0914.2001.04.011 |
杨宝君, 刘伟, 徐福元, 等. 1999. 松材线虫病早期诊断的研究——Ⅱ松树品种、接种量及线虫来源对流胶法的影响. 林业科学研究, 12(3): 251-255. DOI:10.3321/j.issn:1001-1498.1999.03.005 |
张立海, 廖金铃, 冯志新. 2001. 松材线虫rDNA的测序和PCR-SSCP分析. 植物病理学报, 31(1): 84-89. DOI:10.3321/j.issn:0412-0914.2001.01.013 |
张路平, 孔繁瑶, 杨宝君. 2002. 松材线虫和拟松材线虫不同株系线粒体DNA RAPD分析. 林业科学研究, 15(1): 7-12. DOI:10.3321/j.issn:1001-1498.2002.01.002 |
张路平, 李记标, 孔繁瑶. 2000. 松材线虫和拟松材线虫扫描电镜的结构的比较研究. 电子显微学报, 19(5): 679-683. DOI:10.3969/j.issn.1000-6281.2000.05.003 |
Laemmli U K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature (London), 227: 680-685. DOI:10.1038/227680a0 |
Lawler C, Harmey M A. 1993a. Immunological detection of nematode antigens on the surface of a wood section. Fundamental and Applied Nematology, 16(6): 521-523. |
Lawler C, Joyce P, Harmey M A. 1993b. Immunological differentiation between Bursaphelenchus xylophilus and B. mucronatus. Nematologica, 39(4): 536-546. |
Lowry O H, Rosebrough N J, Farr A L, et al. 1951. Protein measurement with the folin phenol reagent. J Biol Chem, 193: 265-275. |
Towbin H, Staehelin T, Gordon J. 1979. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: Procedure and some applications. Proc Natil Acad Sci USA, 76(9): 4350-4354. DOI:10.1073/pnas.76.9.4350 |
 2005, Vol. 41
2005, Vol. 41