文章信息
- 吕守芳, 张守攻, 齐力旺, 孙晓梅, 王建华.
- Lü Shoufang, Zhang Shougong, Qi Liwang, Sun Xiaomei, Wang Jianhua.
- 日本落叶松体细胞胚胎发生的研究
- Somatic Embryogenesis from Immature Embryos of Larix kaempferi
- 林业科学, 2005, 41(2): 48-52.
- Scientia Silvae Sinicae, 2005, 41(2): 48-52.
-
文章历史
- 收稿日期:2003-12-05
-
作者相关文章
日本落叶松(Larix kaempferi)是我国东北南部及亚热带高海拔山区优良的造林树种,生长快、产量高、材质好、用途广,可供建筑、造纸等用材。在东北地区已成为重要用材造林树种,全国已有14个省、市(区)引种造林,总面积已达30万hm2。日本落叶松通过体细胞胚胎发生可以开展以下研究:1)大规模生产体胚苗;2)进行原生质体研究;3)进行超低温保存研究;4)进行基因转化研究;5)进行人工种子研究。进而使现代生物技术得以应用到日本落叶松的遗传改良和繁殖工作中,培育出速生、丰产、优质、抗逆的日本落叶松新种质。目前欧洲落叶松(Larix decidua)(Chalupa, 1991)、欧日(日欧)杂种落叶松(Larix×leptoeuropaea)(Klimaszewska, 1989)、西部落叶松(Larix occidentalis)(Thompson et al., 1992)、华北落叶松(Larix principis-rupprechtii) (齐力旺等,2000; 2004)的体细胞胚胎发生均有报道,日本落叶松体细胞胚胎发生的研究报道很少。本文通过研究其体细胞胚胎发生的过程及调控机制,建立较为稳定的日本落叶松体细胞胚胎发生系统。
1 材料与方法 1.1 材料日本落叶松未成熟种子和成熟种子都采自辽宁省清源县大孤家林场日本落叶松国家级种子园,选用5株优树,其中包含日永10、日永69和日草34三个优株,未成熟种子于2002年6月10、20、25日及7月6、15日5次分批采集,每株树每次采20~30个球果,剥开球果取种;成熟种子则于9月上旬采集。
1.2 外植体 1.2.1 未成熟胚日本落叶松未成熟种子先后用70%酒精消毒1 min与0.1%升汞溶液消毒6 min,无菌水冲洗5次,由于种子小,在超净台中用2种方法剥取种胚:1)从侧部划开种壳,取出种仁,划破内种皮,挑开胚乳,将嫩胚接种于培养基上;2)纵裂种子取出种胚,切口向下同胚乳一起接种于培养基上。
另外一种方式是不用升汞溶液消毒,取未成熟种子用自来水冲洗,将种子移到无菌培养皿中,75%的酒精喷洒消毒20~30 min,用小镊子剥开种壳取出白色种粒放入另一无菌培养皿中,解剖刀划开种粒取出种胚,移入培养基中。若种胚过小,可于胚乳一同接入培养基中。每皿中接种15~20个,重复3次(3个皿),22~25 ℃下暗培养。
1.2.2 成熟胚日本落叶松成熟种子可用上述方法取出成熟胚,接入培养基中诱导。
1.2.3 胚根、胚轴和愈伤组织取成熟种子用清水浸泡24 h,自来水冲洗,将种子移到无菌培养皿中,75%的酒精喷洒消毒30 min,用小镊子剥开种壳取出白色种粒,移入培养基中萌芽,取胚根和胚轴作为外植体进行诱导;另外,让萌芽的小苗继续生长继代,无根小苗基部产生许多绿色愈伤组织,用作外植体诱导胚性愈伤组织。
1.3 培养基和培养条件 1.3.1 胚性愈伤组织诱导培养基胚性愈伤组织诱导培养基为S培养基(表 1)+6-BA 0.5 mg·L-1+KT 0.5 mg·L-1+2, 4-D,其中2, 4-D质量浓度分别为0.5, 1.0, 1.5, 2.0, 2.5 mg·L-1。整个培养基要加入蔗糖30 g·L-1,谷氨酰胺450 mg·L-1,水解酪蛋白500 mg·L-1,凝胶(Sigma#)3 g·L-1,pH5.8。
|
|
胚性愈伤组织保持与增殖培养基为S培养基+6-BA 0.25 mg·L-1+KT 0.25 mg·L-1+2, 4-D,其中2, 4-D质量浓度分别为0.1, 0.2, 0.3 mg·L-1。整个培养基要加入蔗糖30 g·L-1,谷氨酰胺450 mg·L-1,水解酪蛋白500 mg·L-1,凝胶(Sigma#)3 g·L-1,pH5.8。继代转接时,挑取最新分化的愈伤组织,20 d左右继代一次,22~25 ℃下暗培养。
1.3.3 体细胞胚成熟培养基体细胞胚成熟培养基为S培养基+ABA+PEG4000 100 g·L-1,其中,ABA质量浓度分别为10,12.5,15,17.5,20 mg·L-1;另外要加入蔗糖30 g·L-1,谷氨酰胺450 mg·L-1,水解酪蛋白500 mg·L-1,凝胶(Sigma#)3 g·L-1,pH5.8。
1.3.4 体细胞胚萌发培养基体细胞胚萌发培养基为S培养基,不加任何激素,附加蔗糖25 g·L-1,凝胶(Sigma#)3 g·L-1,pH5.8。
在胚性愈伤组织诱导至体细胞胚成熟等各个阶段,分别记载胚性愈伤组织与体细胞胚发生数量,在显微镜和解剖镜下镜检,观察胚性愈伤组织、体细胞胚的形态。接种的胚性愈伤组织质量为G0=G2-G1。式中:G1为有培养基的培养皿全重,G2为接入胚性愈伤组织后的培养皿全重。G1和G2可以在试验室内天平上称量,此称量方法不会造成污染。
2 结果与分析 2.1 胚性愈伤组织的诱导日本落叶松5种外植体(未成熟胚、成熟胚、胚根、胚轴、绿色愈伤组织)中只有未成熟体胚诱导出胚性愈伤组织(图版Ⅰ-1),其在后期的成熟体胚诱导中获得了能萌发的成熟体胚(图版Ⅰ-9);胚性愈伤组织形态为白色略黄、透明丝状、晶亮有粘性,在显微镜下观察可见其细胞核大、细胞质浓厚,其中一些不均等分裂成胚细胞和胚柄细胞,进一步发育成体胚(图版Ⅰ-5, 6, 7, 8);而非胚性愈伤组织为浅黄白色、结构稍松、质地软、颗粒状,不能形成早期原胚。胚根、胚轴和绿色愈伤组织都诱导出类似胚性愈伤组织的培养物,但没有保持下来;成熟胚没有诱导出胚性愈伤组织的类似物。
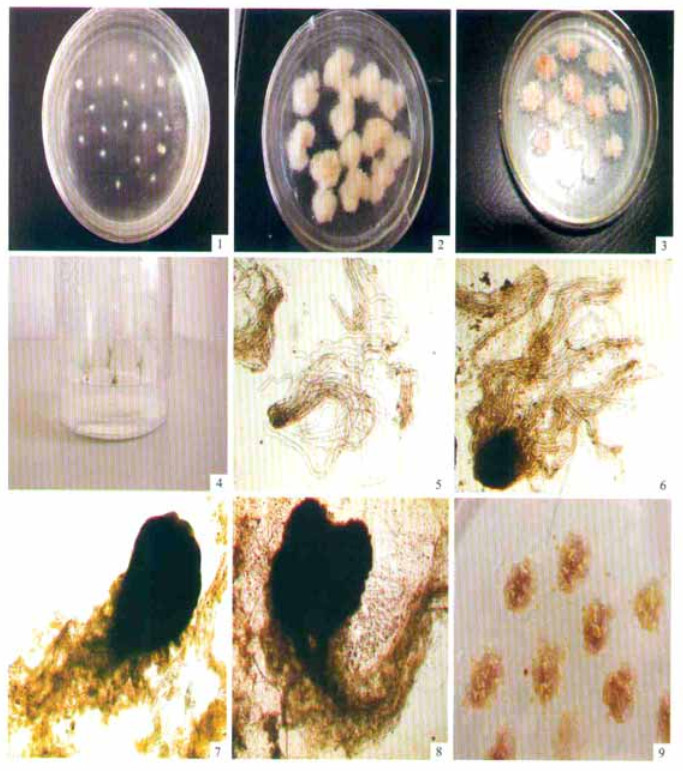
|
图版Ⅰ Plate Ⅰ |
未成熟胚采集的时间严重地影响着胚性愈伤组织的诱导,只有在6月下旬(20日)至7月上旬(6日)采集的3批未成熟胚获得了胚性愈伤组织,其母株为日永10、日永69和日草34。
胚性愈伤组织诱导培养基中,以2, 4-D为1.0和1.5 mg·L-1的诱导效果好,其诱导频率分别为15.5%和10.4%。
2.2 胚性愈伤组织的保持与增殖胚性愈伤组织增殖培养1、2次后,愈伤组织不断增殖,胚柄包着胚性团形成胚性细胞系,培养物中有一系列大小的胚性团,保持适宜的条件,分散的多胚能不断地无序分裂,细胞系得以正常继代,其胚性能够持续保持而不会丧失(图版Ⅰ-2)。获得稳定细胞系3个,为日永10、日永69和日草34。胚性愈伤组织增殖培养基中,2, 4-D为0.1, 0.2, 0.3 mg·L -1的3个处理,增殖效果都很好,但在后期成熟体胚诱导中,0.1 mg·L-1 2, 4-D的增殖培养基中保持的胚性愈伤组织诱导成熟体胚的效果较好,诱导频率较高,质量较好,其他2个处理不能诱导出成熟体胚,即使诱导出来,也是畸形胚。胚性愈伤组织接入0.1 mg·L-12, 4-D增殖培养基后,其生长量是随着日期的变化而变化(图 1)。
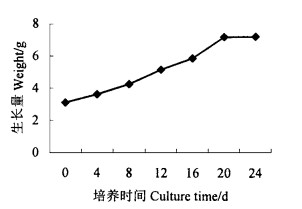
|
图 1 胚性愈伤组织生长状况 Fig. 1 The curve of embryogenic tissue proliferation |
接种胚性愈伤组织3.12 g(平均值),4 d为一间隔,0~24 d为一周期,其生长量分别增殖到3.62,4.27,5.17,5.87,7.2,7.22 g(平均值);生长曲线显示胚性愈伤组织逐渐增殖,在20 d左右获得较大的增殖量,20~24 d期间增殖缓慢。另外,胚性愈伤组织培养20 d左右后,开始老化,少新鲜感,变硬,颗粒状。因此,以20 d为转接时期比较适宜,既能保持胚性愈伤组织的新鲜和活力,又能获得较大的增殖量。
3种胚性愈伤组织日草34、日永69和日永10在0.1 mg·L-1 2, 4-D增殖培养基上增殖状况见表 2。胚性愈伤组织日永69增殖最快(平均值),增殖量为4.53 g,增殖率为165.2%;日草34次之,增殖量为4.45 g,增殖率为139.1%;日永10增殖最慢,增殖量为3.27 g,增殖率为95.7%。
|
|
待胚性愈伤组织大量增殖后,将其接入体细胞胚成熟培养基中,ABA分别为10,12.5,15,17.5,20 mg·L-1的5个处理中,以15 mg·L-1 ABA的处理效果较好,诱导频率较高,体细胞胚质量较好(图版Ⅰ-3)。在大量的成熟体胚诱导处理中,首先获得成熟体胚的处理见表 3。
|
|
从表 3可定性地分析出,0.1 mg·L-1 2, 4-D的增殖培养基中保持的胚性愈伤组织容易诱导出体细胞胚;0.2 mg·L-1 2, 4-D的增殖培养基中只有日永10产生5个畸形胚;0.3 mg·L-1 2, 4-D的增殖培养基中没有形成成熟体胚。另外,15 mg·L-1ABA的体胚成熟培养基诱导体胚效果好,日永69、日永10和日草34三种胚性愈伤组织均获得成熟体胚。
在确定0.1 mg·L-1 2, 4-D的增殖培养基和15 mg·L-1 ABA的体胚成熟培养基后,定量研究了3种胚性愈伤组织形成体细胞胚的状况(表 4)。胚性愈伤组织日永69获得成熟体胚数最多,诱导率为10.57个·g-1(平均值);日草34次之,诱导率为2.87个·g-1;日永10相近,诱导率为2.4个·g-1。
|
|
成熟体胚的外型在胚性细胞系间和细胞系内都不一样,正常成熟体胚的外型概念还没有明确,成熟体胚相似于合子胚的地方在于都有一条根、一个胚轴和几片子叶,合子胚有5~6片子叶,而体胚的子叶数变化不定,体胚的胚轴一般比合子胚的长,这些差异主要取决于细胞系,特别取决于ABA的处理。
2.4 成熟体胚的萌发将成熟体细胞胚轻轻挑出,转至无激素的体细胞胚发育培养基中,置光强1 000~1 600 lx下培养,15~20 d后,体细胞胚萌发,呈绿色,下胚轴伸长,白色胚根向下延伸,红色根尖正常分化,部分产生2~3条侧根;25~30 d再转接一次,60 d后,完整小植株形成,待小苗生长健壮后,体胚苗移入玻璃广口瓶中(图版Ⅰ-4),培养基质为沙子、蛭石和堆肥按体积比1:1:1配制,需消毒,用0.1%营养液(N:P:K摩尔比为1:1:1)湿润,置于光照50 μE·m-2s-1、温度24 ℃条件下。培养1个月后,将温度降为20 ℃,瓶盖打开1 cm以便通气,随后渐渐移开瓶盖,1个星期后,完全将瓶口打开, 将驯化的体胚苗盆栽后移入温室。
3 讨论外植体的选择对日本落叶松体细胞胚胎发生有着重要意义,它决定着体细胞胚胎发生的可行性,如本试验和其他相关试验表明落叶松只有未成熟胚作为外植体才能使体细胞胚胎发生成功。但未成熟胚的采集受时期限制,作为外植体很不方便,且其体胚苗需要无性系选择。如果作为营养器官的外植体(如成年树芽中的嫩梢)其体细胞胚胎发生成功,则其体胚苗与母株的性状一致可不需无性系选择直接用于造林。因此,对营养器官外植体的探索不断地进行着。Bonga(19921);1996)从30年生的成年树芽中取出嫩梢进行诱导,形成的粘性培养物外型上与胚性培养物相似,然而,这些粘性培养物没有进一步发育成胚。在本试验中,尝试了5种外植体诱导胚性愈伤组织,只有未成熟胚获得成功,成熟胚表现最差,形成的愈伤组织明显地非胚性化;胚根、胚轴和绿色愈伤组织诱导出的愈伤组织中,有一些形似胚性愈伤组织,但不能保持和增殖延续。
1) Bonga J M. 1992. Somatic embryogenesis in explants from a 30-year-old Larix decidua tree. In:Sixth meeting intern. conifer biotechn. working group. Raleigh, NC(abstract).
日本落叶松体细胞胚胎发生过程可分成4个阶段,每一阶段培养基中的激素类型和浓度配比的组合复杂,工作量大。根据体细胞胚胎发生的自身规律,其在胚性愈伤组织诱导和增殖中,以2, 4-D为主要激素类型,在体胚成熟培养中,以ABA为主要激素类型,故而,采取固定其他激素的类型和浓度,重点筛选2, 4-D和ABA的浓度。同时,在胚性愈伤组织增殖中,对不同处理获得的大量胚性愈伤组织分别进行体胚成熟诱导,根据其体胚诱导数量和质量来取舍增殖培养基,而不是单纯以愈伤组织的增殖量来取舍,这样可简化工作量,提高研究工作效率,获得较好的效果。
日本落叶松体细胞胚胎发生过程有许多偶然性,其间胚性愈伤组织诱导和成熟体胚诱导试验的重复性较差,同一培养皿中同一细胞系不同愈伤块之间体胚诱导数量差别很大,存在同步化问题,可能是胚性愈伤组织在培养过程中内在理化性质有所变化,在长期培养过程中失去了体胚发生能力(Pitel et al., 1992)。在整个体细胞胚胎发生过程中,只有胚性愈伤组织保持与增殖试验比较稳定。造成试验偶然性的可能原因是材料的基因型不同,而用于诱导的培养基成分和条件却一致;另外,对于同一愈伤组织,可能是愈伤组织与培养皿中培养基和培养条件没有吻合好。
日本落叶松的体细胞脱分化后再分化为胚性细胞是受细胞内外多种因子所调控,而这些因子作用的实质是调节特定基因的表达。特定胚胎发生相关基因在已脱分化的细胞中表达是体细胞胚胎发生的重要环节,也是体细胞胚发生机理的关键。构建胚性细胞的胚性发育相关基因的cDNA扣除文库是揭示这一机理的基础工作(Cairney et al., 1999),这方面分子机理的研究正在进行。
齐力旺, 韩一凡, 李玲, 等. 2000. 华北落叶松体细胞胚发生及植株再生实验系统的建立. 实验生物学报, 33(4): 357-365. DOI:10.3321/j.issn:1673-520X.2000.04.010 |
齐力旺, 韩一凡, 韩素英, 等. 2004. 麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响. 林业科学, 40(1): 52-57. |
Bonga J M. 1996. Frozen storage stimulates the formation of embryo-like structures and elongating shoots in explants from mature Larix decidua and L. × eurolepis trees. Plant Cell Tissue Organ Cult, 46(2): 91-101. |
Cairney J, Xu X, Pullman G S, et al. 1999. Natural and somatic embryo development in loblolly pine:gene expression studies using differential display and DNA arrays. Appl Biochem Biotech, 77-79, 5-17 https://link.springer.com/article/10.1385/ABAB%3A77%3A1-3%3A5
|
Chalupa V. 1991. Larch(Larix decidua Mill.).In: Bajaj Y P S(ed). Biotechnology in agriculture and forestry. Springer-Verlag, Berlin, 446-470
|
Klimaszewska K. 1989. Plantlet development from immature zygotic embryos of hybrid larch through somatic embryogenesis. Plant Sci, 63: 95-103. DOI:10.1016/0168-9452(89)90105-2 |
Pitel J A, Yoo B Y, Klimaszewska K, et al. 1992. Changes in enzyme activity and protein patterns during the maturation phase of somatic embryogenesis in hybrid larch(Larix × eurolepis). Can J For Res, 22(4): 553-560. DOI:10.1139/x92-073 |
Thompson R G, von Aderkas P. 1992. Somatic embryogenesis and plant regeneration from immature embryos of western larch. Plant Cell Rep, 11: 379-385. DOI:10.1007/BF00234365 |
 2005, Vol. 41
2005, Vol. 41