文章信息
- 白淑兰, 白玉娥, 方亮, 刘勇.
- Bai shulan, Bai yu'e, Fang Liang, Liu Yong.
- 土生空团菌与虎榛子形成的菌根及其对虎榛子生长的影响
- Mycorrhiza of Cenococcum geophilum (Fr.) Formed on Ostryopsis daidiana and Mycorrhizal Affection on the Growth of Ostryopsis davidiana
- 林业科学, 2004, 40(6): 194-196.
- Scientia Silvae Sinicae, 2004, 40(6): 194-196.
-
文章历史
- 收稿日期:2004-05-14
-
作者相关文章
2. 北京林业大学资源与环境学院 北京 100083
2. College of Resources and Environment, Beijing Forestry University Beijing 100083
菌根是高等植物根系与土壤中的一类特殊真菌形成的互惠联合体。研究证明,菌根不但决定植物的分布,影响群落的组成,改变植物之间的相互关系,而且还对生态系统的稳定与物质运输、能量转化,生物多样性的维持,受损生态系统的恢复均产生很大的影响(杨国亭等, 1999)。深入研究不同植物的菌根生态及其对宿主的作用,对于筛选各地优良乡土菌株,尽快恢复受损生态系统具有重要的科学意义。
虎榛子(Ostryopsis davidiana)分布于辽宁西部、内蒙古、河北、山西、陕西、甘肃和四川北部,为我国特有种(内蒙古植物志编辑委员会, 1990),是内蒙古大青山极度退化生态系统造林先锋树种。土生空团菌[(Cenococcum geophilum (Fr.)]是抗逆性极强的外生菌根真菌,可与200多种树木形成菌根(Pigott, 1982;Trappe, 1964;Trappe et al., 1966)。笔者多年对内蒙古大青山外生菌根资源与生态调查发现,虎榛子与土生空团菌共生现象普遍,即使在极度干旱的阳坡,其菌根感染率也在30%以上。在其他植被不断退化的大青山脆弱生态系统中,虎榛子能够正常生长,可能与菌根共生有重要的联系。本文通过对从虎榛子菌根组织分离获得的土生空团菌的回接试验,试图探明虎榛子与土生空团菌菌根关系,同时希望揭示土生空团菌对虎榛子的作用机理,为大青山植被建设提供一条新途径。
1 试验材料与方法 1.1 试验材料供试菌种:土生空团菌,分离于大青山中、高山阴坡、半阴坡的虎榛子小根的菌根组织,菌落灰黑色致密(图 1)。供试树种:供试虎榛子种子采自于内蒙古大青山劈柴沟生长健壮的虎榛子灌丛,种子发芽率为90%,千粒质量31.25 g。

|
图 1 纯培养时土生空团菌的菌落特征(1×) Fig. 1 The characteristic of C.geophilum(Fr.) colony in pure culture |
菌根的采集与分离:在虎榛子灌丛根基周围, 用小铲挖取营养根上的菌根, 放入塑料袋, 保持湿润, 带回实验室,同时采集适量根际土筛菌核,用于人工回接后比较鉴定;分离时,把采集的虎榛子小根用清水冲洗干净, 然后在体视显微镜下切取营养根上的菌根,放在无菌水内, 再在超净工作台内用30%的H2O2消毒30 s, 用无菌水冲洗3次, 最后用无菌手术刀切开消毒冲洗后的菌根组织, 摆放于含硫酸链霉素(质量浓度为1 mg·mL-1)的PDA琼脂培养基上, 置于25 ℃暗培养室内培养, 5 d后挑取萌发的菌丝进行转接、纯化, 获得纯种。
菌剂制备:试验所用菌剂为固体菌剂。按花晓梅(1995)MMN固体培养基配方,配制一定量的营养液,然后称取蛭石混拌,固体培养基的含水量70%为宜,混匀后装入罐头瓶高温高压灭菌1 h。冷却后在超净工作台内把生长健壮的平板菌种接于其中,并同时做一定数量的未接种空白培养基(用于对照处理),同时放入24~25 ℃的暗培养室培养,1个月后备用。
苗木培育:育苗基质选用蛭石和林地土(质量比为1:2),把准备好的基质混合后过5 mm筛,用自来水混拌使之含水量为50%。充分混匀后装入塑料袋内进行高温高压灭菌1.5 h,冷却后晾晒于干净的地方7 d后备用;选择发育良好的虎榛子种子,温水浸泡24 h,然后在超净工作台内用体积分数10%H2O2消毒30 min,再用无菌水冲洗3~4次,摆在准备好的无菌发芽皿内,置于发芽箱内催芽,一般7~10 d可以完成种子催芽。在育苗盆内放入准备好的灭菌基质,把发芽一致、健壮的芽苗播入其中,置于光照培养室内培养。
幼苗接种:试验使用120 mm×100 mm的育苗杯,先在杯底放约20 mm深的灭菌基质,称取5 g生长旺盛固体菌剂撒于其上(为了保证接入的菌剂菌丝活力最大,需除去菌剂瓶内表层5 mm厚的老化菌剂)。选择在光照培养室内生长均匀的2个月龄虎榛子盆栽幼苗栽入其中,每杯栽1棵。剪去长≥100 mm的根系,注意把菌剂与苗根密接,以利于菌根的形成。定量覆土使杯与基质共重250 g。并设1个对照处理(接上述空白培养基),接种处理与对照处理各设20个重复,然后置于照度为1.9×104 lx光照培养室培养。光期14 h·d-1,温度27~28 ℃;暗期温度20~21 ℃。用天平称量及时补水,使含水量保持在40%~50%,并且每2周浇一次稀释10倍的Hongland营养液,每次30 mL·杯-1,以提供必要的营养。
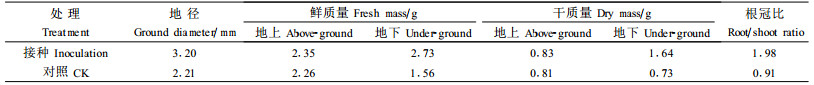
菌根感染率、地上、地下生物量的测定:接种5个月时,采用弓明钦等(1997)划线交叉法进行菌根感染率的统计,即随机抽取10杯幼苗连同基质从杯中倒出,轻轻抖掉根上大量基质,用清水浸泡2 min,洗净后分别将幼苗小于1 mm的根系剪下,并剪成10 mm的根段,在体视显微镜下观察统计菌根感染率;对另外10株苗木地上、地下分别收获,并测定地径、鲜重、干重,最后换算为根茎比,对测得数据进行方差分析;对育苗基质进行菌核的筛取。
2 结果与分析 2.1 接种对虎榛子菌根感染率的影响人工回接后平均菌根感染率达67.2%,而未接种处理没有菌根感染现象(图 2、3)。人工回接得到的菌根形态与野外分离时的完全一致,并从育苗基质中筛出了典型的菌核(图 4),而对照无菌核。

|
图 2 回接后土生空团菌与虎榛子形成的菌根形态(7.5×) Fig. 2 The mycorrhiza configuration of back-inoculated C.geophilum(Fr.) on O.davidiana |

|
图 3 对照虎榛子的根系(7.5×) Fig. 3 The comparison of O.davidiana' roots |

|
图 4 回接后虎榛子根际土中形成的菌核形态(30×) Fig. 4 The sclerotium configuration of back-inoculated O.davidiana' roots in soil |
土生空团菌对虎榛子幼苗高生长的影响:接种5个月后对苗木高生长进行测定,接种土生空团菌的苗木高为197.3 mm,而对照为189.7 mm,从而,也许说明土生空团菌对虎榛子幼苗高生长促进作用不明显。
土生空团菌对虎榛子幼苗地径、地上、地下生物量生长的影响:由表 1可知,土生空团菌对虎榛子幼苗地径及地下生物量的促进作用显著,而对地上生物量的影响不显著,这与对高生长的影响趋势相同。林业上衡量苗木质量的一个重要指标就是根冠比,从本试验结果看,土生空团菌对虎榛子幼苗根冠比的影响极显著(P=0.01),接种处理的根冠比为对照幼苗的2.18倍,这将大大增强苗木抗逆性。
|
|
目前,外生菌根研究主要集中在针叶树上的水分、养分的吸收问题,尤其对磷素的研究更为深入(Hogetsu, 1998)。有关阔叶树外生菌根的研究相对较少,特别对灌木的研究就更少。许多研究表明,菌根作用的发挥在恶劣生境中才能显示更突出的优势(Pigott, 1982)。本研究表明:虎榛子幼苗的回接菌根感染率达67.2%,有学者研究认为植物菌根感染率达50%~60%时就会达到良好的效果,菌根感染率超过70%效果反而降低(Brundrett et al., 1996)。所以,土生空团菌是大青山上虎榛子的一个优良乡土菌株。研究结果还表明,土生空团菌对虎榛子的高生长虽然没有明显的促进作用,但对地径、地下生物量的促进作用极显著。这可能是由于苗木根系生长先于地上部分生长,随着苗木培养时间的延长,发达的根系生长最终会导致地上部生物量的有效积累;或可能该菌虽然对虎榛子地径、根系发育有极显著的促进作用,但对其高生长确实没有明显作用。这种机制,一方面可以减少地上部分对营养的消耗,同时使有机物绝大多数储存在根系中,促进根系的生长与扩张,从较广泛的范围内吸收有限的水分,以最大限度地提高虎榛子的抗旱性,最终维持自身的生存,这一问题有待于进一步研究证实。许多研究表明,土生空团菌是恶劣生境地区造林的重要外生菌根真菌(Mexal et al., 1973;Meyer, 1987;Saleh-Rastin, 1976;黄亦存等,1991)。这也可能就是虎榛子在其他植被严重退化的生境中能够较正常生长的重要原因,而我国在这方面的研究尚属空白,目前笔者正在深入探讨。
弓明钦, 陈应龙, 仲崇禄. 1997. 菌根研究及应用. 北京: 中国林业出版社, 109-110.
|
黄亦存, 沈崇尧, 裘维蕃. 1991. 土生空团菌及其在火炬松上形成的菌根. 真菌学报, 10(3): 203-207. |
花晓梅. 1995. 林木菌根研究. 北京: 中国科学技术出版社, 367-369.
|
内蒙古植物志编辑委员会.内蒙古植物志.第二版.呼和浩特: 内蒙古人民出版社, 1990, 第二卷: 100-102
|
杨国亭, 宋关玲, 高兴喜. 1999. 外生菌根在森林生态系统中的重要性(Ⅰ)--外生菌根对宿主树木的影响. 东北林业大学学报, 27(6): 72-77. DOI:10.3969/j.issn.1000-5382.1999.06.018 |
Brundrett M, Bougher N, Dell B, et al. 1996. Working with mycorrhizas in forestry and agriculture. Canberra:ACIAR, Monograph: 261-268. |
Hogetsu T. 1998. A hidden actor in the forest ecosystem: symbiosis between trees and ectomycorrhizal fungi. Protein, Nucleic Acid and Enzyme, 43: 1246-1253. |
Mexal J, Reid C P. 1973. The growth of selected mycorrhizal fungi in response to induced water stress. Can J Bot, 51(9): 1579-1688. DOI:10.1139/b73-201 |
Meyer F H. 1987. Extreme sites and ectomycorrhiza (particularly Cenococcum geophilum). Angew Bot, 61(1-2): 39-46. |
Pigott C D. 1982. Fine structure of mycorrhiza formed by Cenococcum geophilum (Fr.) On Tilia cordata Mill. New Phytologist, 92: 501-502. DOI:10.1111/j.1469-8137.1982.tb03408.x |
Saleh-Rastin N. 1976. Salt tolerance of the mycorrhizal fungus Cenococcum graniforme (Sow.) Ferd. Ferd. Europ J For Pathol, 6(3): 184-187. DOI:10.1111/j.1439-0329.1976.tb00523.x |
Trappe J M. 1964. Mycorrhizal hosts and distribution of Cenococcum graniforme. Lloydia, 27(2): 100-106. |
Trappe J M, Quinard R S. 1966. Cenococcum graniforme in Mexico. Mycologia, 58: 647-648. |
 2004, Vol. 40
2004, Vol. 40