文章信息
- 刘会超, 孙振元, 彭镇华.
- Liu Huichao, Sun Zhenyuan, Peng Zhenhua.
- NaCl胁迫对五叶地锦生长及某些生理特性的影响
- Effect of Salt Stress on the Growth and Some Physiological Characteristics in Parthenocissus quinquefolia Cuttings
- 林业科学, 2004, 40(6): 63-67.
- Scientia Silvae Sinicae, 2004, 40(6): 63-67.
-
文章历史
- 收稿日期:2004-01-14
-
作者相关文章
五叶地锦(Parthenocissus quinquefolia)系葡萄科(Vitaceae)地锦属木本植物,具有生长势强、在短期内能形成浓荫、秋季叶色红艳等特点。既可用作高大建筑物、假山、公园棚架、高大树干以及围墙等的垂直绿化和美化材料(陈有民,1988),也可作为荒山绿化、防止水土流失的覆盖材料(张毅功等,2000)。然而其耐盐性及其耐盐机理尚不清楚,为此,有必要对五叶地锦在盐胁迫下的生长及生理反应进行研究,以期从中探讨五叶地锦的耐盐能力,进而为五叶地锦应用于盐碱地区绿化提供理论依据。
1 材料与方法 1.1 试验材料材料为2003年4月1日扦插的幼苗。试验在中国林业科学研究院科研温室内进行。在苗龄为1个半月时,选择生长健壮、生长势一致的幼苗进行盆栽沙培,每隔1 d浇灌Hoagland营养液一次,浇透为止。培养1个月后,将沙培苗进行随机区组设计,7个处理,每小区5株,4次重复,分别用0,25,50,100,150,200,300 mmol·L-1 NaCl(用Hoagland营养液配制)处理,每天每盆浇150 mL不同浓度的NaCl溶液,连续处理7 d。
1.2 测定指标及方法植株生长量的测定:包括蔓高、新蔓长度、新叶数量及叶面积增长量、新根数量和主根长度等指标;光合速率、蒸腾速率、气孔导度及胞间CO2的测定:用LI-6200型便携式光合测定仪,在9:30—11:30进行;可溶性糖和脯氨酸测定:利用Waters-244型高效液相色谱仪测定;丙二醛(MDA)测定:参照中国科学院上海植物生理所(1999)的方法,在721型分光光度计上测定;膜透性测定:采用电导法,参照上海植物生理研究所(1999)的方法测定;矿质元素测定:利用原子吸收分光光度计测定叶片中K、Ca、Na等3种元素的含量。
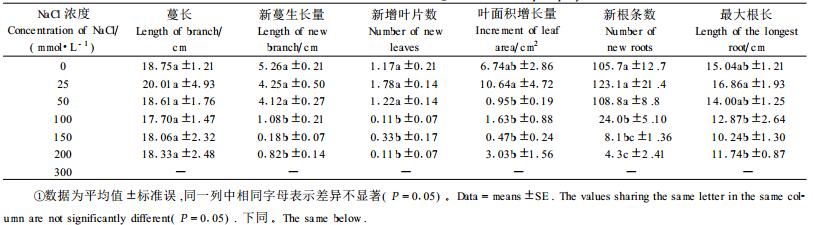
2 结果与分析 2.1 NaCl胁迫对生长的影响由表 1看出,25 mmol·L-1 NaCl处理,对五叶地锦生长没有明显影响,与对照相比,除新梢生长量稍有降低外,其他各项指标均高于对照,说明五叶地锦能忍耐轻度的盐胁迫;50 mmol·L-1 NaCl处理,对植株生长表现出一定的抑制作用,主要表现在新叶的生长受到抑制,叶面积只增长了0.95 cm2,是对照的14.5%;大于100 mmol·L-1 NaCl处理,对五叶地锦的生长有明显的抑制作用,处理3 d后,处理植株开始出现盐害症状,叶片出现褐斑,处理的第5天开始,部分处理植株出现萎蔫、枯叶等症状,NaCl浓度越高,盐害症状越严重。到处理的第7天时,新蔓增长量、新增幼叶数及新根数量分别是对照的20.5%、9%和22.7%;处理浓度为300 mmol·L-1时,有7株处理植株死亡,可以认定五叶地锦不能忍耐大于300 mmol·L-1的NaCl胁迫。
|
|
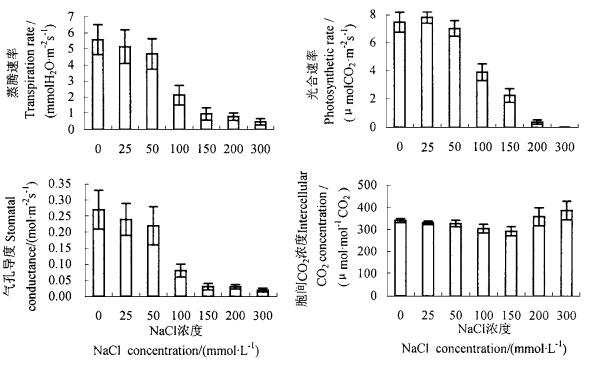
由图 1看出,25、50 mmol·L-1NaCl处理,对光合速率没有明显影响;NaCl浓度大于100 mmol·L-1,光合速率急剧降低;当NaCl浓度为300 mmol·L-1时,光合速率仅为0.008 μmol·m-2s-1。另外,蒸腾速率、气孔导度等指标随着盐浓度升高逐渐降低,当NaCl浓度超过100 mmol·L-1,二者明显减少;NaCl浓度为300 mmol·L-1时,均降为最低值。不同浓度的NaCl处理对胞间CO2浓度没有明显的影响。
|
图 1 NaCl胁迫对叶片光合速率、蒸腾速率、气孔导度及细胞间隙CO2浓度的影响 Fig. 1 Effect of NaCl on photosynthetic rate, transpiration rate, stomatal conductance and intercellular CO2 concentration |
表 2表明,盐胁迫增加了可溶性多糖、葡萄糖、果糖等不同类型糖的含量,尤其在NaCl浓度超过100 mmol·L-1后,叶片中糖的含量有明显的增加,NaCl浓度为200 mmol·L-1时,可溶性多糖、葡萄糖、果糖的含量与对照相比分别增加了20.8%、86.2%和82.8%,说明盐胁迫下,随着NaCl浓度增高,可溶性糖含量亦增加,而且可溶性糖的增加以葡萄糖和果糖为主。在各种处理中,脯氨酸的含量有增加的趋势,除了在100 mmol·L-1处理时有显著增加外,其他处理与对照相比,稍有增加。
|
|
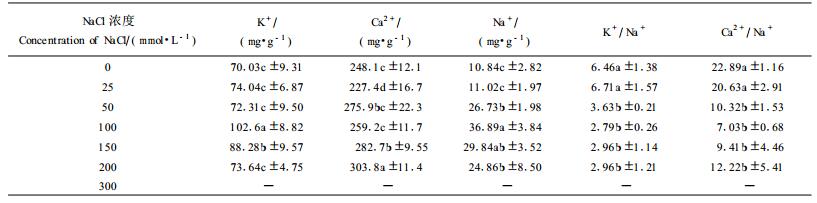
由表 3看出:不同浓度的NaCl处理,使K+的含量增加,100 mmol·L-1 NaCl处理,与对照相比,增加了32.57 mg·g-1,增加量最大;对于Ca2+而言,盐胁迫具有使叶片中Ca2+增高的趋势,随着盐浓度增高,叶片中Ca2+浓度逐渐增大,大于50 mmol·L-1,Ca2+浓度超过对照,200 mmol·L-1时,Ca2+浓度最大,为303.8 mg·g-1,比对照增加了55.7 mg·g-1;不同处理使叶片中Na+浓度增加,当处理浓度大于50 mmol·L-1,与对照相比,处理植株叶片中Na+含量均有显著的增加。从K+、Ca2+与Na+的关系来看,25 mmol·L-1的NaCl处理影响不大,当处理浓度大于50 mmol·L-1,K+/Na+下降至2.79~3.63,下降了178%~231%,Ca2+/Na+下降至12.22~7.03,减少了187%~327%。
|
|
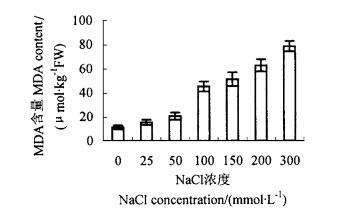
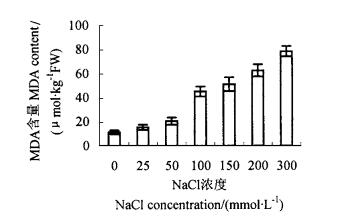
由图 5、6看出,不同浓度NaCl处理后,均增加了细胞膜透性和MDA含量。大于50 mmol·L-1 NaCl处理,使细胞膜透性明显增加,是对照的137.5%~548%,其中300 mmol·L-1 NaCl处理,细胞膜透性最大(图 2);大于100 mmol·L-1 NaCl处理,处理植株的MDA含量急剧增加,与对照相比,是对照的402%~697%(图 3)。膜透性和MDA含量是衡量膜受到伤害的指标,因此说明随着盐浓度增高细胞受伤害程度增大。
|
图 2 NaCl胁迫对MDA含量的影响 Fig. 2 Effect of NaCl on MDA content |
|
图 3 NaCl胁迫对膜相对透性的影响 Fig. 3 Effect of NaCl on cell membrane permeability |
试验表明,五叶地锦对盐胁迫的忍耐能力存在着一定的极限。红花(Cartharaus tinctorius)、田箐(Sebenia cannabina)、碱苋菜(Amaranthus sp.)在小于100 mmol·L-1 NaCl的胁迫下,生长及一些生理指标变化不大,当处理浓度大于200 mmol·L-1,上述3种植物明显产生盐害(李明亮等,1994)。张宝泽等(1992)对沙枣(Elaeagnus argustifolia)在盐胁迫下的生长和生理特性的研究表明,100 mmol·L-1的NaCl对叶片生长几乎无影响,大于此浓度,随着盐浓度的增大,叶片生长受抑制越来越明显。本试验结果表明,25和50 mmol·L-1 NaCl处理对植物生长没有明显的抑制作用,等于或大于100 mmol·L-1的处理,对五叶地锦生长造成显著的抑制作用,主要表现为新蔓生长量、叶片生长量明显地减小。虽然植物对盐的敏感程度存在着差异,但是,每种植物都有一个生长明显受到抑制的临界浓度,也就是阈值。从本试验的结果可以推测,100 mmol·L-1 NaCl是五叶地锦盐胁迫的阈值。
盐渍条件下,植物都要受到渗透胁迫的伤害,而它们只有通过渗透调节减轻或避免伤害(武维华,2003)。植物通过在细胞液泡中积累无机离子或合成有机溶质等方式进行渗透调节(赵可夫,1999)。可溶性糖、脯氨酸、无机离子等物质是植物体内重要的渗透调节剂(武维华,2003)。本试验中,NaCl处理后,叶片的K+、Ca2+、Na+等离子含量增加,可能是细胞为了进行渗透调节,而大量积累3种离子的结果,但是大于50 mmol·L-1的处理,使K+/Na+、Ca2+/Na+的比值明显减小,说明打破了原有的K+、Na+和Ca2+的平衡;同时,盐胁迫下,可溶性糖增加,但脯氨酸含量没有随盐浓度增加明显升高,说明五叶地锦主要是通过增加可溶性糖的含量而不是增加脯氨酸的含量进行渗透调节。可溶性糖是很多非盐生植物的主要渗透调节剂(赵可夫,1999),也是合成别的有机溶质的碳架保护和能量来源,对细胞膜和原生质胶体也有稳定作用,还可在细胞内无机离子浓度高时起保护作用(张海燕等,1998)。细胞的渗透调节作用是有一定限度的,当盐离子浓度过高,细胞极度失水,细胞膜受到损伤,细胞产生膜泄露现象,离子和可溶性有机物质失去平衡,叶绿素分解,蛋白质合成受到抑制,此时渗透调节能力不能阻挡生理上的恶化过程。本试验中,NaCl浓度大于150 mmol·L-1的处理,MDA含量、膜相对透性急剧增加,且变化趋势一致,说明在高盐浓度胁迫下,五叶地锦的膜系统受到了损伤,而细胞中的渗透调节物质,无论是无机离子还是有机物质,并没有随着盐浓度增高而明显升高,可能是细胞渗透调节能力下降所致,NaCl浓度大于100 mmol·L-1,对植物造成的伤害,在生长上表现为萎蔫、脱落、新叶和新蔓生长极为缓慢,生理上表现为光合作用、蒸腾作用受到显著抑制,这些都是恶化过程中的明显表现。
本试验中,盐胁迫下五叶地锦光合速率降低,气孔导度下降,这与冯立田等(1999)和郭书奎等(2001)在玉米(Zea mays)、菜豆(Phaseolus vulgaris)等材料上的研究结果一致。盐胁迫下,气孔导度降低,限制了CO2向叶绿体的输送(Delfine et al., 1999),Farquhar等(1982)认为,只有气孔导度和胞间CO2浓度同时下降,才能表明光合作用的抑制受气孔的限制。盐胁迫下光合作用下降的证据和观点很多,Ott等(1999)认为,NaCl胁迫下光合还原能力(NADH)的利用速率降低,光合电子传递速率超过消耗能力,结果驱动Mehler反应,产生活性氧,活性氧的增加,类囊体的叠垛程度减小,从而抑制了光合速率;另外,盐胁迫下膜透性的增加引起酶的失活及蛋白质的降解(Wang et al., 1999),并诱导膜脂中不饱和脂肪酸发生过氧化作用,导致叶绿体膜及质膜透性的增大(赵可夫,1999;刘宛等,1995),叶绿体及胞质介质外流,破坏了细胞正常代谢环境并造成营养元素的缺失,从而影响光合作用;盐胁迫下可溶性糖的增加反馈性抑制光合作用(Munns, 1993; Ott et al., 1999)。但也有试验证明,盐胁迫抑制光合作用,是由于胞质内过多的Na+进入类囊体膜中抑制光系统Ⅰ和光系统Ⅱ的活性所致(Allakaberdiev et al., 2000)。本试验结果表明,CO2并没有随盐浓度增高而表现出降低的趋势,因此不能据此断定光合速率的下降是由于气孔导度下降所致。大于或等于100 mmol·L-1 NaCl处理造成光合作用明显下降的同时,膜透性、MDA含量、可溶性糖含量显著增加,K+/Na+、Ca2+/Na+的比值明显减小,因此,可以认为,盐胁迫下光合作用的下降与膜的伤害、糖的反馈性抑制及细胞内离子的平衡关系破坏有关,而与气孔导度和胞间CO2浓度无关。
陈有民. 1988. 园林树木学. 北京: 中国林业出版社.
|
冯立田, 赵可夫, 邓振旭. 1999. NaCl对菜豆叶片光合CO2和水分交换效应的研究. 山东师范大学学报, 14(2): 180-183. |
郭书奎, 赵可夫. 2001. NaCl胁迫抑制玉米光合作用的可能机理. 植物生理学报, 27(6): 461-466. DOI:10.3321/j.issn:1671-3877.2001.06.004 |
李明亮, 王宝山, 张宝泽, 等. 1994. 几种经济草本植物耐盐性的研究. 曲阜师范大学学报, 20(2): 70-73. |
刘宛, 胡文玉, 谢甫缔, 等. 1995. NaCl胁迫对离体小麦叶片膜过氧化脂类物质的影响. 植物生理学通讯, 31(1): 26-29. |
武维华. 2003. 植物生理学. 北京: 科学出版社.
|
张宝泽, 曹子谊, 赵可夫. 1992. 盐分胁迫下沙枣某些生理特性的研究. 林业科学, 28(2): 167-169. |
张海燕, 赵可夫. 1998. 盐分和水分胁迫对盐地碱蓬幼苗渗透调节效应的研究. 植物学报, 40(1): 56-61. |
张毅功, 孙振元, 陆诗雷. 2000. 爬山虎绿化荒山作用的初步研究. 林业科技通讯, (3): 15-18. DOI:10.3969/j.issn.1671-4938.2000.03.006 |
赵可夫. 1999. 植物抗盐生理. 北京: 中国科学技术出版社.
|
中国科学院上海植物生理研究所. 1999. 现代植物生理学实验指南. 北京: 科学出版社.
|
Allakaberdiev S I, Sakamoto A, Nishiyama Y. 2000. Ionic and osmotic effects of NaCl-induced inactivation of photosystems Ⅰ and Ⅱ in Synechococcus sp. Plant Physiol, (123): 1047-1056. |
Delfine S, Alvino A, Concettavillani, et al. 1999. Restrictions to carbon dioxide conductance and photosynthesis in spinach leaves recovering from salt stress. Plant Physiol, 119: 101-1106. DOI:10.1104/pp.119.1.101 |
Farquhar G D, Sharkey T D. 1982. Stomatal conductance and photosynthesis. Annu Rev Plant Physiol, (33): 317-345. |
Ott J C, Birks K, Johnson G. 1999. Regulation of the photosynthetic electron transport chain. Planta, 209: 250-258. DOI:10.1007/s004250050629 |
Munns R. 1993. Physiological processes limiting plant growth in saline soils: some dogmas and hypotheses. Plant Cell Environ, 16: 15-24. DOI:10.1111/j.1365-3040.1993.tb00840.x |
Wang Y, Meny Y L, Ishikawa H, et al. 1999. Photosynthetic adaption to salt stress in three-color leaves of a C4 plant Amaranthus tricolor. Plant Cell Physiol, 40: 668-674. DOI:10.1093/oxfordjournals.pcp.a029591 |
 2004, Vol. 40
2004, Vol. 40