文章信息
- 赵世伟, 刘东焕, 张佐双, 高荣孚, 刘玉军.
- Zhao Shiwei, Liu Donghuan, Zhang Zuoshuang, Gao Rongfu, Liu Yujun.
- 夏季温室遮荫对榕树和三雄蕊槟榔光合作用的影响
- Effect of Shading on Photosynthetic Characteristics of Areca triandra and Ficus microcarpa in Greenhouse in Summer
- 林业科学, 2004, 40(6): 50-55.
- Scientia Silvae Sinicae, 2004, 40(6): 50-55.
-
文章历史
- 收稿日期:2003-03-31
-
作者相关文章
2. 北京林业大学生物科学与技术学院 北京 100083
2. College of Biological Sciences and Biotechnology, Beijing Forestry University Beijing100083
在温室植物栽培过程中常常观察到有些高大乔木的上层叶片在夏季存在明显的日灼现象。日灼现象实际上是一种严重的光氧化和光破坏(Osmond,1994)。一般情况下,强光容易导致光氧化和光破坏(Hong et al., 1999a;1996b; Pathre et al., 1998; Saccardy et al., 1998),但伴随其他环境胁迫(如高温、干旱等)时,植物光合作用的饱和光强会降低,从而导致过剩光能增加,因此中等光强也能使叶片发生光氧化和光破坏(Nair et al., 1999; Daniel, 1997)。温室气象数据显示,夏季温室一层平台向阳处的最高气温可达35 ℃左右,而温室顶部可高达40 ℃,远远超过了大多数植物光合的最适温度。高温下,气孔导度降低;高温还影响光合过程的光反应和暗反应(刘东焕等, 2002; Berry et al., 1980)。因此,夏季温室的高温可能是植物发生光氧化或光破坏的重要诱因。为调控温室内的温度,保证温室植物的正常生长,在夏季常常要对温室进行遮荫降温。
遮荫能够降温,但也降低光照强度。光是推动光合作用的动力,一般来说遮荫不利于植物最大光合潜力的发挥,因此也不利于植物的正常生长(Cartechini et al., 1995),但不同程度遮荫其影响效果也不同(刘贤赵等,2002)。为减少遮荫对植物光合作用的不利影响,北京市植物园在夏季对温室采取了不完全遮荫措施。为验证不完全遮荫的效果,选取喜光植物榕树和耐荫植物三雄蕊槟榔为研究材料,分析其遮荫前后的生态因子、光合气体交换参数和叶绿素荧光的变化,为温室夏季遮荫调控提供理论依据。
1 材料与方法 1.1 试验地点试验在北京市植物园热带植物展览温室四季花园区进行。温室内的温度和湿度是依靠温度传感器、湿度传感器自动记录并通过空调、通风装置以及加湿计调控的。温室内环境因子在不同季节变化明显,强光、高温是夏季午间前后明显的特征。
1.2 试验材料榕树(Ficus microcarpa)为桑科(Moraceae)榕属(Ficus)常绿乔木,产华南、印度、越南及缅甸,澳大利亚、马来西亚、菲律宾等国也有分布,喜阳光充足、温暖潮湿气候。三雄蕊槟榔(Areca triandra)为棕榈科(Parmaceae)槟榔属(Areca)丛生灌木至小乔木,原产印度、马来西亚,现热带各地均有栽培,为热带典型的观叶植物。
1.3 试验方法 1.3.1 光合曲线以及光合气体交换因子测定2001年6月10—12日,每日8:30—11:00用英国产CIRAS-1型便携式光合仪在控光、控温条件下,测定净光合速率(Pn)-光合有效辐射(PAR)响应曲线和光合速率(Pn)-温度(t)响应曲线。在进行Pn-PAR曲线测定时,叶室二氧化碳浓度(ca)控制为400 μmol·mol-1, 叶室温度控制为25 ℃,叶室相对湿度为70%,设定以光量子通量密度(PFD)表示的PAR梯度为0、20、40、80、100、200、300、400、600、800 μmol·m-2s-1。每一PAR适应10 min后测定。Pn最大时的PAR为光饱和点(LSP)。
在进行Pn-t响应曲线测定时,按叶室温度15、20、25、30、35、40 ℃的顺序对植物材料进行连续测定,ca控制为400 μmol·mol-1,PAR控制为400 μmol·m-2s-1,叶室相对湿度为70%。每一温度下适应10 min后测定,Pn最大时的温度为光合适宜温度。
2001年6月14—16日(遮荫前)以及2001年6月21—26日(用TAL-B500型铝箔针织、遮阳率85%的一层遮阳网进行不完全遮荫,每2网之间的间隔大约2.5 m)晴朗的天气,用英国产CIRAS-I型便携式光合仪进行Pn、PAR、大气温度(ta)、叶面温度(tL)的日变化测定,并可同时获得间隙二氧化碳浓度(ci)和气孔导度(gs)日变化的数值。每2 h测定一次,每株植物选择向阳枝条3~5片功能叶作为重复,共测定3株。
1.3.2 荧光参数日变化测定在光合气体交换因子测定的同时,使用英国制造便携式植物效率分析仪(PEA UK)进行叶绿素荧光测定。测定前先将植物叶片用暗适应夹作暗适应15 min, 测定时可获得初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)和光系统Ⅱ最大光化学反应效率(Fv/Fm)等参数。每次测定重复5~6次。
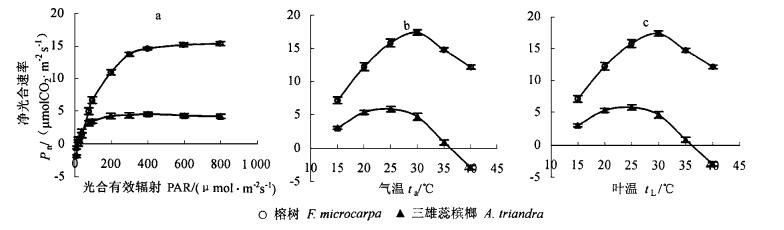
2 结果 2.1 榕树和三雄蕊槟榔的光合特性从光合-光强响应曲线(图 1a)可看出,榕树的Pn在PAR 600 μmol·m-2s-1左右趋于饱和,而且强光下Pn也没有表现出下降;三雄蕊槟榔在PAR 300~400 μmol·m-2s-1时Pn已达饱和,PAR超过600 μmol·m-2s-1后, Pn开始呈现出下降趋势。
|
图 1 榕树和三雄蕊槟榔叶光合速率对光合有效辐射、气温和叶温的响应曲线 Fig. 1 Response curves of leaf photosynthetic rate(Pn) of F. microcarpa and A. triandra to photosynthetically active radiation (PAR), air temperature(ta) and leaf temperature(tL) |
分析光合-气温曲线(图 1b),榕树光合作用的最适气温约为30 ℃,气温超过30 ℃以后,Pn开始下降。但榕树的Pn在高温下下降幅度较小,35 ℃时的Pn比最适气温下的Pn低约15%,而40 ℃时的Pn也不过比最适气温下的Pn低约30%。三雄蕊槟榔光合作用的最适气温是25 ℃。与榕树相比,三雄蕊槟榔高温下Pn下降幅度大,35 ℃时的Pn比最适气温下的Pn下降了85%,而在40 ℃时没有测到Pn。光合-叶温曲线与光合-气温曲线表现出相似的规律。以上数据揭示榕树耐强光和高温,而三雄蕊槟榔对强光和高温敏感。
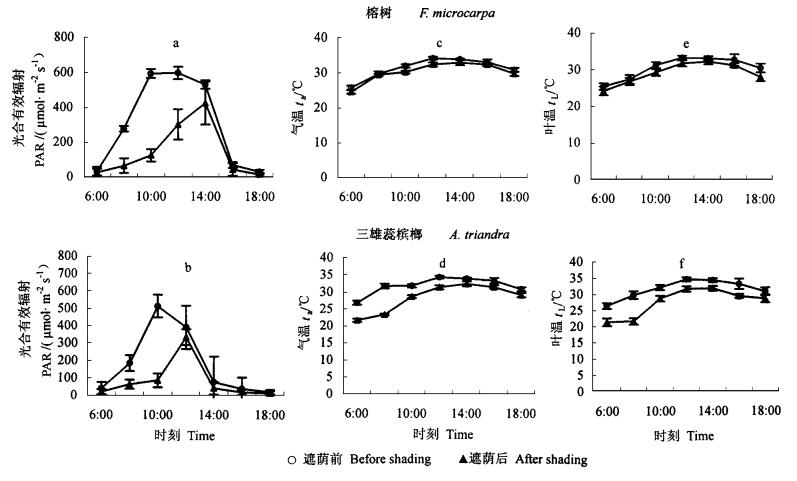
2.2 遮荫前后试验地主要生态环境因子的日变化如图 2所示,遮荫前,早晨的PAR变化于32~276 μmol·m-2s-1之间,中午前后400~600 μmol·m-2s-1,傍晚20~69 μmol·m-2s-1;日最大PAR榕树可达597 μmol·m-2s-1(图 2a),三雄蕊槟榔可达514 μmol·m-2s-1(图 2b),刚刚超过光饱和光强。早、中、晚的气温依次是26~30 ℃,32~34 ℃,30~33 ℃。气温在中午前后达最高值,约为34 ℃(图 2c),分别超出榕树和三雄蕊槟榔的光合最适气温约4 ℃和9 ℃。此时,三雄蕊槟榔的叶温略高于气温,但榕树的叶温低于气温。而且在1 d的大部分时间内,三雄蕊槟榔的叶温明显高于榕树。
|
图 2 试验地点遮荫前后主要生态因子日变化 Fig. 2 Daily changes of main ecological factors in the experiment field before and after shading |
遮荫后,午间前后的PAR榕树最大,可达424.7 μmol·m-2s-1,比遮荫前降低了28.7%;三雄蕊槟榔遮荫后的PAR最大为334.3 μmol·m-2s-1,比遮荫前降低了34.9%;二者的日均PAR分别比遮荫前降低了55%和54%。午间前后的最高气温约为32.5 ℃,比遮荫前降低约1.5 ℃;此时,最高叶温榕树是32.3 ℃,比遮荫前降低了1 ℃,而日均叶温降低了1.5 ℃;三雄蕊槟榔的叶温最高可达31.7 ℃,比遮荫前降低了2.8 ℃,日均叶温降低了4.2 ℃。以上数据说明,遮荫降低了光合有效辐射,而由此也降低了气温和叶温。
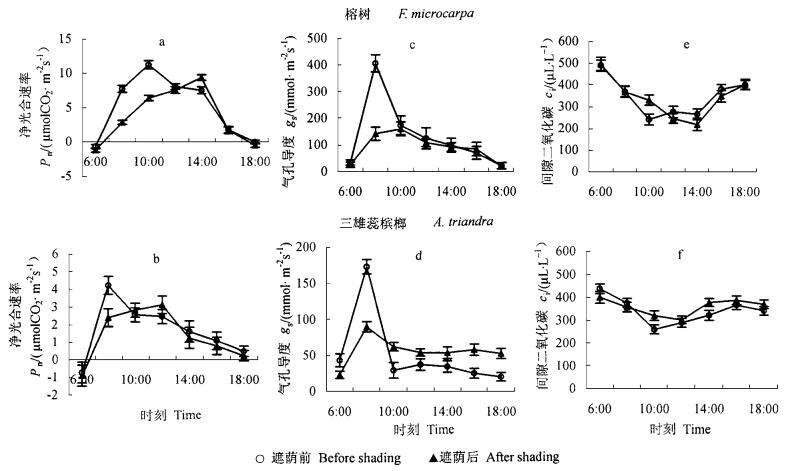
2.3 遮荫前后光合气体交换参数日变化如图 3所示,遮荫前,榕树的Pn在10:00达到最大值11.25 μmol·m-2s-1 (图 3a),而三雄蕊槟榔在8:00达到最大值4.23 μmol·m-2s-1(图 3b);之后,在持续的饱和光强下,随气温的继续升高,Pn下降。中午榕树光合速率比1 d之中的最大Pn低约28%,而中午三雄蕊槟榔比最大值低42%左右。气孔导度(gs)的变化与Pn有相似的趋势(图 3c,d),但榕树的gs远高于三雄蕊槟榔。午间榕树的gs较1 d之中的最大gs低57%~69%,三雄蕊槟榔的gs比其最大值低79%~83%。伴随Pn和gs的下降,榕树的细胞间隙二氧化碳浓度(ci)呈现出上升趋势;三雄蕊槟榔与榕树稍有不同,ci呈现出先下降后上升的趋势(8:00—10:00, ci下降;10:00—12:00,ci上升)。数据表明,遮荫前,榕树午间光合下降是非气孔限制,三雄蕊槟榔8:00—10:00光合下降是气孔限制,午间光合下降是非气孔限制。
|
图 3 遮荫前后榕树和三雄蕊槟榔叶片光合气体交换日变化 Fig. 3 Daily changes of the photosynthetic gas exchange factors in F. microcarpa and A. triandra before and after shading gs:Stomatal conductance; ci:Intercellular CO2 concentration. |
遮荫后,榕树和三雄蕊槟榔的Pn都随光强的增大而增大,二者都在午间前后光合有效辐射最大时达到峰值,榕树的最大Pn是9.4 μmol·m-2s-1,三雄蕊槟榔的最大Pn是3.13 μmol·m-2s-1,都比遮荫前同一时刻的Pn有所提高,榕树提高24%,三雄蕊槟榔提高30%;但二者日均Pn降低,榕树降低24%,三雄蕊槟榔降低13%。与遮荫前相比,榕树的气孔导度却比遮荫前有所降低,中午期间和日均gs分别降低7%和32%;但三雄蕊槟榔中午期间的gs和日均gs都比遮荫前有所提高, 分别提高45%和5.9%。
遮荫前后的气体交换因子日变化显示,遮荫影响了榕树和三雄蕊槟榔的光合日进程,也影响了二者的日均Pn和日均gs。
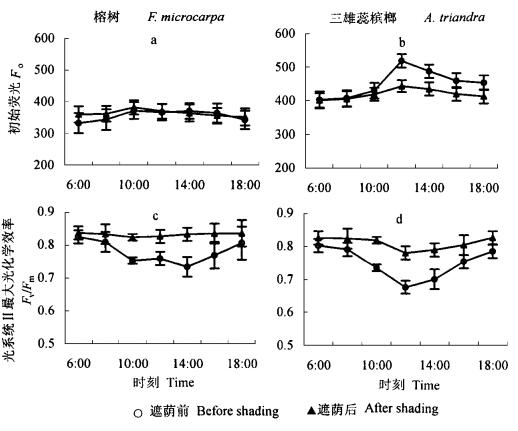
2.4 遮荫前后的荧光日变化如图 4所示,遮荫前,在中午光照和高温协同作用下榕树和三雄蕊槟榔PSⅡ的最大光化学效率(Fv/Fm)都下降(图 4a, b),三雄蕊槟榔下降更显著;遮荫后,没有观察到Fv/Fm的明显下降。这表明遮荫前榕树PSⅡ反应中心活性仅发生轻微的下调,三雄蕊槟榔PSⅡ反应中心活性下调较严重,但这种下调在下午光强、温度降低后逐渐恢复;遮荫能够有效地减轻PSⅡ反应中心活性的下调。图 4c, d也表明遮荫前后榕树Fo没有明显增加;而遮荫前三雄蕊槟榔中午Fo明显上升,遮荫后Fo增加较少,说明三雄蕊槟榔的PSⅡ反应中心可能发生一定程度的破坏(Hong et al., 1999b)。
|
图 4 遮荫前后榕树和三雄蕊槟榔的光系统Ⅱ光化学效率和初始荧光日变化 Fig. 4 Daily changes of photochemical efficiencies and original fluorescences of the PSⅡ in F. microcarpa and A. triandra before and after shading |
光合作用受许多环境因素的影响,如光强、温度、湿度、二氧化碳浓度等,光强和温度是主要的影响因子(Baker, 1996)。本试验结果表明,遮荫前的中午前后Pn下降,此时光合有效辐射仅仅饱和,但气温和叶温超出了光合最适温度范围,榕树叶温达到了33.3 ℃,比最适温度高3.3 ℃,三雄蕊槟榔达到了34.5 ℃,比最适温度高9.5 ℃,推测遮荫前榕树和三雄蕊槟榔光合作用的下降与高的叶温有关。高温对光合的影响涉及气孔限制及光反应和暗反应(Arquhar et al., 1982; 刘东焕等,2002),高温引起光合下降的程度也因品种而异(Karim et al., 2000)。本文结果证明,榕树喜光耐高温,三雄蕊槟榔对强光和高温敏感。榕树和三雄蕊槟榔在遮荫前的午间高温条件下,光合下降,气孔导度降低,间隙二氧化碳浓度升高(图 3),说明高温下二者光合的下降属于非气孔限制。高的叶温可能导致与暗反应有关的酶钝化(Robinson et al., 1989; Kobza et al., 1987),从而使榕树和三雄蕊槟榔的光合速率下降。
此外,PSⅡ反应中心的伤害也能够使光合速率下降(Hong et al., 1999b)。Fv/Fm代表PSⅡ的原初光化学活性,它的下降反映PSⅡ反应中心活性下调(Demmig et al., 1987),初始荧光(Fo)的增加是反应中心光合机构破坏的结果(Demmig et al., 1992;Anderson et al., 1997)。数据揭示遮荫前的午间高温条件下,榕树的PSⅡ反应中心活性只发生了轻微下调,而三雄蕊槟榔的PSⅡ反应中心活性发生了严重的下调,而且这种下调可能涉及PSⅡ反应中心的破坏。遮荫后中午榕树PSⅡ反应中心活性的下调程度减轻,三雄蕊槟榔的PSⅡ反应中心活性下调程度明显减轻;同时二者光合速率都比遮荫前同一时刻的光合速率有所提高,遮荫后午间的Pn榕树提高了24%,三雄蕊槟榔提高了30%。因此,遮荫前中午的这种非气孔限制可能也与PSⅡ反应中心的活性下调有关。
夏季温室的不完全遮荫能降低气温和叶温,但也降低了光合有效辐射。而光是光合作用的动力,这在一定程度上势必影响光合潜力的发挥。从日均Pn和日均gs来看,榕树的Pn和gs比遮荫前分别降低24%和32%,三雄蕊槟榔的Pn降低13%,而gs提高5.9%。
以上分析表明,夏季温室遮荫能够降低午间的气温、叶温,并减轻PSⅡ反应中心的活性下调,但全天遮荫也会因光合有效辐射的降低而降低其日均净光合速率;降低程度因植物种类而异,榕树光合速率的降低程度略大于三雄蕊槟榔的降低程度。为此,在夏季温室植物的环境调控中,以通风降温为好,或者只在中午期间实施遮荫降温措施。
刘东焕, 赵世伟, 高荣孚, 等. 2002. 植物光合作用对高温的响应. 植物研究, 22(2): 205-212. |
刘贤赵, 康绍忠. 2002. 番茄不同生育阶段遮荫对光合作用与产量的影响. 园艺学报, 29(5): 427-432. DOI:10.3321/j.issn:0513-353X.2002.05.006 |
Anderson J M, Park Y I, Chow W S. 1997. Photoinactivation and Photoprotection of PSⅡ in nature. Physiologia Plantarum, 100: 214-223. DOI:10.1111/j.1399-3054.1997.tb04777.x |
Arquhar G D, Sharkey T D. 1982. Stomatal conductance and photosynthesis. Ann Rev Plant Physiol, 33: 317. DOI:10.1146/annurev.pp.33.060182.001533 |
Baker N R. 1996. Photosynthesis and the Environment. The Netherlands: Kluwer Academic Publishers: 281-304. |
Berry J A, Bjorkman O. 1980. Photosynthetic response and adaptation to temperature in higher plants. Ann Rev Plant Physiol, 31: 491-543. DOI:10.1146/annurev.pp.31.060180.002423 |
Cartechini A, Palliotti A. 1995. Effects of shading on vine morphology and productivity and leaf gas exchange characteristics in grapevines in the field. Amer J Enol Viticult, 46: 227-234. |
Daniel E. 1997. The temperature dependence of photoinhibition in leaves of Phaseolus vulgaris (L.): Influence of CO2 and O2 concentrations. Plant Science, 124(1): 1-8. DOI:10.1016/S0168-9452(96)04574-8 |
Demmig B, Bjärkaman O. 1987. Comparison of the effect of excessive light on chlorophyll fluorescence (77K) and photo yield of O2 evolution in leaves of higher plants. Planta, 171(2): 171-184. DOI:10.1007/BF00391092 |
Demmig-Adams B, Adams W W. 1992. Photoprotection and other responses of plant to high light stress. Ann Rev Plant Physiol Plant Mol Biol, 43: 599-626. DOI:10.1146/annurev.pp.43.060192.003123 |
Hong S S, Xu D Q. 1999a. Reversible inactivation of PS Ⅱ reaction centers and the dissociation of LHC Ⅱ from PS Ⅱ complex in soybean leaves. Plant Science Limerick, 147(2): 111-118. DOI:10.1016/S0168-9452(99)00106-5 |
Hong S S, Xu D Q. 1999b. Light-induced increase in initial chlorophyll fluorescence Fo level and the reversible inactivation of PS Ⅱ reaction centers in soybean leaves. Photosynthesis Research, 61(3): 269-280. |
Karim M A, Fracheboud Y, Stamp P. 2000. Effect of high temperature on seedling growth and photosynthesis of tropical maize genotypes. J Agron Crop Science, 184(4): 217-223. DOI:10.1046/j.1439-037x.2000.00376.x |
Kobza J, Edwards G E. 1987. Influences of leaf temperature on photosynthetic carbon metabolism in wheat. Plant Physiol, 83: 69-74. DOI:10.1104/pp.83.1.69 |
Krause G H, Weis E. 1991. Chlorophyll fluorescence and photosynthesis: the basis. Annu Rev Plant Physiol Plant Mol Biol, 42: 313-349. DOI:10.1146/annurev.pp.42.060191.001525 |
Nair D B, Nathan K A, Acob J J. 1999. Light damages cell membranes under stress environments: measurements on membrane stability, photosynthesis and respiration in Hevea. Journal of Plant Biology, 26(1): 65-68. |
Osmond C B. What is photoinhibition? Some insights from comparisons of shade and sun plants. In: Baker N R, Bowyer J R (eds). Photoinhibition of photosynthesis: from molecular mechanisms to the field. Oxford: Bios Scientific, 1994: 1-24
|
Pathre U, Sinha A K, Shirke P A, et al. 1998. Factors determining the middy depression of photosynthesis in trees under monsoon climate. Trees: Structure and Function, 12(8): 472-481. DOI:10.1007/s004680050177 |
Robinson S P, Portis A R. 1989. Adenosine triphosphate hydrolysis by purified Rubisco activase. Arch Biochem Biophysics, 268: 93-99. DOI:10.1016/0003-9861(89)90568-7 |
Saccardy K, Pineau B, Roche O, et al. 1998. Photochemical efficiency of Photosystem Ⅱ and xanthophylls cycle components in Zea mays leaves exposed to water stress and high light. Photosynthesis Research, 56(1): 57-66. |
 2004, Vol. 40
2004, Vol. 40

