文章信息
- 王敦, 胡景江, 刘铭汤.
- Wang Dun, Hu Jingjiang, Liu Mingtang.
- 从臭蜣螂中提取甲壳素/壳聚糖的研究
- The Study of Isolation Chitin and Chitosan from Dung Beetle
- 林业科学, 2004, 40(5): 180-185.
- Scientia Silvae Sinicae, 2004, 40(5): 180-185.
-
文章历史
- 收稿日期:2003-09-10
-
作者相关文章
甲壳素(Chitin)又名甲壳质、几丁质、蟹壳素等,广泛存在于低等动物,特别是节肢动物,如昆虫、甲壳动物的体壳中,为一种生物高分子。甲壳素是一种可再生的丰富的天然资源,据估计自然界每年生物合成的甲壳多达100亿吨,是地球上最丰富的有机物之一,也是20世纪没有被充分利用的天然资源之一(蒋挺大, 1996)。由于其用途广泛,甲壳素的开发应用受到了国际社会的高度重视,应用范围也从纺织、造纸扩展到了食品环保、医药、农业、林业、轻工业、生物工程等领域(蒋挺大, 1996;严瑞煊, 1998;Keisuke, 1998)。
市面上的甲壳素产品基本上都来源于虾、蟹壳,昆虫甲壳资源尚未得到开发。其实,昆虫的体壁中甲壳素的含量远远超过了虾、蟹壳,高出虾、蟹壳数倍,加之昆虫是世界上种类最多的生物种群,已知的种类超过100万种,为地球上最大的优势动物种类。据估算昆虫的总生物量超过了地球上所有动物总生物量,其适应能力分布范围都超过了其它动物群,但被人类利用的昆虫资源却很少,只占昆虫种类的万分之一左右(杨冠煌, 1998)。因而昆虫甲壳素资源是有待开发的优势资源。
目前,以虾、蟹壳为原料制备壳聚糖工艺是用一定浓度的烧碱溶液加热来脱除蛋白质,用稀盐酸浸泡脱除矿物质,再经过脱色处理获得甲壳素。甲壳素在高温下与浓碱反应脱去乙酰基,得到溶解于稀酸的壳聚糖(Skjak-Braek et al., 1986;蒋挺大, 1996),但尚缺乏以昆虫为原料提取甲壳素与壳聚糖的具体工艺。本研究依据试验材料特点及与虾、蟹壳的差异,以上述提取方法为基础,研究了酸、碱液浓度,反应时间和温度对制备甲壳素与壳聚糖的理化性质影响,提出了制备出较高纯度的甲壳素与较高粘度壳聚糖的工艺,并比较分析了分别从臭蜣螂和虾、蟹壳制备的甲壳素/壳聚糖的理化特征,明确了昆虫甲壳素/壳聚糖的品质优势。
1 材料与方法 1.1 材料臭蜣螂(Copris ochus Motschulshy),采集地:陕西淳化县。样品预处理:洗净→捣碎→筛洗→烘干(60℃)→试样。标准样品为分析纯甲壳素(原料:虾壳),美国SIGMA公司生产。虾、蟹壳购自烟台海产品公司。
1.2 提取方法参照Skjak-Braek等(1986)、陈长琨(1991)、钱合生(1998)、王敦等(2001)的方法进行。甲壳素脱色方法:用质量分数为3%的KMnO4浸泡30 min→洗净→质量分数为2%的草酸70℃浸泡5 min→洗净并至pH=7。
1.3 提取工艺试验设计采用单因素法,分析提取工艺的不同反应条件对甲壳素中残留灰分、蛋白含量以及对壳聚糖粘度的影响。包括:脱除矿物质采用稀盐酸的不同浓度、处理温度、处理时间对甲壳素中残留灰分含量以及对壳聚糖粘度的影响;脱除蛋白采用NaOH的不同浓度、处理温度、处理时间对甲壳素中残留蛋白以及对壳聚糖粘度的影响;脱乙酰基反应采用高浓度NaOH的不同碱浓度、处理温度、处理时间对壳聚糖粘度的影响。
1.4 定性与定量分析 1.4.1 定性分析采用红外光谱对比法,分析壳聚糖的前体甲壳素。仪器为EQUINOX55型红外光谱仪(德国),测定条件为:将甲壳素样品烘干、KBr压片;测定波数为400~4 000 cm-1。
1.4.2 含量分析每种昆虫样品烘干,称重(W1)。采取相同的提取方法,分别从不同昆虫种类中提取甲壳素,并烘干后分别称重(W2)。昆虫甲壳素含量计算方法:

|
采用灼烧称重法(黄伟坤等, 1989)。
1.4.4 残留蛋白分析方法采用紫外分光光度法(张志良等, 1986)。
1.4.5 壳聚糖粘度分析方法壳聚糖的粘度的高低,是衡量甲壳素和壳聚糖质量优劣的重要标准,壳聚糖(完全可溶)粘度高,则说明甲壳素或壳聚糖的分子链降解反应少、质量好。本研究采用的测定仪器为NDJ-1型旋转式粘度计(上海天平仪器厂),测定条件为以1%的醋酸为溶剂的1%的壳聚糖溶液(所标示浓度为质量分数)。所采用粘度单位为厘泊(c.p)。
1.4.6 脱乙酰度的测定脱乙酰度测定采用酸碱滴定法(蒋挺大, 1996)。以上试验重复3次。
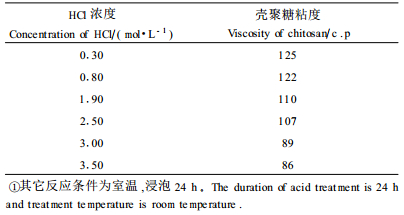
2 结果与分析 2.1 脱除矿物质反应条件选择 2.1.1 不同酸浓度对甲壳素中残留灰分含量以及壳聚糖粘度的影响如表 1,随着HCl浓度增加,壳聚糖的粘度下降。分析原因为,随着酸浓度的增大,甲壳素长分子链发生了酸降解反应,从而导致粘度降低。0.3~0.8 mol·L-1的HCl处理,所得壳聚糖粘度较大。但从脱除矿物质的角度看,HCl浓度在0.8 mol·L-1以下,残留灰分量太高(图 1),因此,在脱矿物质处理中,酸浓度取0.8 mol·L-1较为合适。
|
|

|
图 1 酸浓度对残留灰分的影响 Fig. 1 The effect of acid solution concentration on residual ash content |
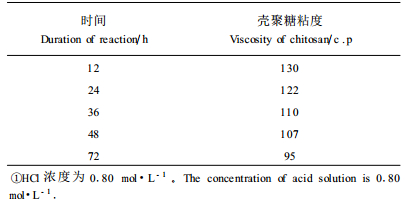
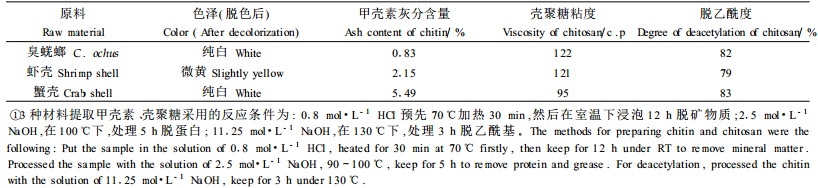
从表 2知,随着酸处理时间的增长,甲壳素长分子链逐渐发生了酸降解反应,粘度下降,在处理12~24 h时粘度较大。酸处理时间达到12 h以后,灰分残留较少,随时间的延长,残留灰分量减少的变化幅度不大(图 2),因此酸处理以12 h为好。
|
|
|
图 2 酸处理时间对残留灰分的影响 Fig. 2 The effect on residual ash content from time of acid treatment |
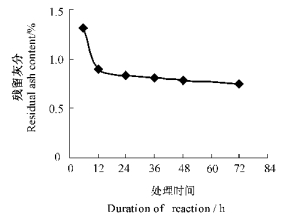
从表 3知,随着酸处理温度的升高,促进了甲壳素长分子链发生酸降解反应,粘度下降,但在70℃以下,粘度变化幅度不大。由于昆虫体壁表层为蜡质,为昆虫试样与稀HCl溶液混合后,体壁表层的蜡质由于其疏水性,阻碍了HCl与矿物质的反应。因此在采取加热处理后破坏了蜡质层,矿物质脱除效果明显好于常温处理,并且随着温度升高,残留的灰分含量减少(图 3)。因此,酸处理时应适当加热,酸溶液温度以70℃为宜。
|
|
|
图 3 酸处理温度对残留灰分的影响 Fig. 3 The effect of acid solution temperature on residue ash content |
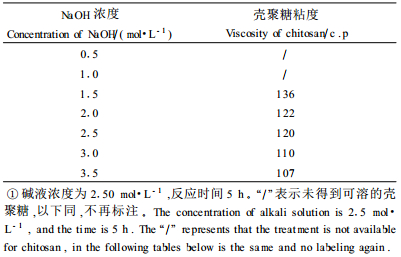
脂类物质与强碱发生皂化反应而易于洗脱除去,故只分析了蛋白质的影响因素。由表 4知,NaOH浓度小于1.0 mol·L-1时,在后续反应中得不到可溶的壳聚糖, 分析是由于脱除蛋白质程度低,甲壳素分子与蛋白质分子吸附结合的胶团状结构大量存在, 从而导致在随后的脱乙酰基反应中,不能正常脱去乙酰基得到壳聚糖。随着NaoH浓度增大,壳聚糖粘度呈下降趋势,是由于高浓度的碱液在脱去蛋白质的同时,使甲壳素长分子链发生了断链降解反应。而NaOH浓度小于2.0 mol·L-1的情况下残留蛋白质含量较高,NaOH浓度达2.0 mol·L-1以后,残留蛋白质含量变化幅度减小(图 4)。因此,要降低残留蛋白含量又保持较高的壳聚糖粘度,碱处理浓度以2.0~2.5 mol·L-1为好。
|
|

|
图 4 碱浓度对残留蛋白的影响 Fig. 4 The effect of alkali solution concentration on residual protein content |
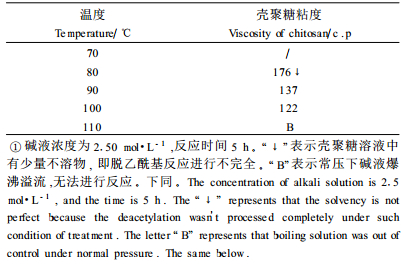
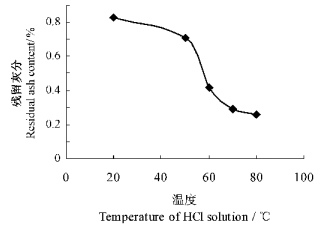
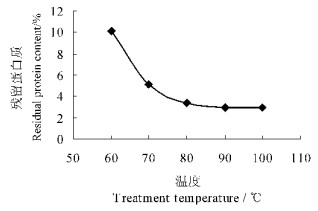
在80℃以下,脱除蛋白质极不充分, 残留蛋白量高(图 5);而从表 5知,在80℃时尽管壳聚糖粘度较大,但壳聚糖溶液中有少量不溶物,说明在80℃条件下脱蛋白不充分,导致随后进行脱乙酰基反应不很充分,无法进一步脱除乙酰基而得到壳聚糖,因此脱蛋白质温度应在80℃以上。在常压条件下,80~100℃范围内,随温度升高,壳聚糖粘度下降(表 5),是由于温度升高,在碱液作用下,甲壳素分子长链发生降解程度加重造成的。温度达到110℃又因碱液爆沸溢流无法进行脱蛋白反应,在90~100℃时壳聚糖粘度较大,且完全可溶,是脱除蛋白适宜的温度条件。
|
图 5 碱处理温度对残留蛋白质的影响 Fig. 5 The effect on residual protein content from temperature of alkali treatment |
|
|
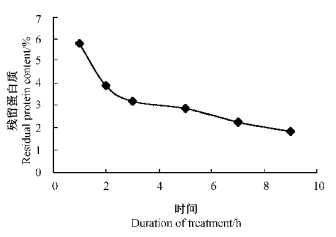
由表 6知,随碱处理时间增长,壳聚糖粘度随之下降,但残留蛋白量渐低(图 6)。时间过短,又脱除蛋白不充分,后续反应制备不到可溶的壳聚糖。仅在4~5 h间,反应正常进行,残留蛋白较少,且粘度较大。因此,要降低残留蛋白含量又保持较高的壳聚糖粘度,处理时间以4~5 h为宜。
|
|
|
图 6 碱处理时间对蛋白质残留的影响 Fig. 6 The effect on residual protein content from temperature of alkali treatment |
如表 7,在碱液浓度小于8.75 mol·L-1时,得不到可溶的壳聚糖,分析是由于反应底物浓度过低,发生脱乙酰基反应少,无法正常进行脱乙酰基反应,造成脱乙酰基不充分而导致。而随着碱液浓度的升高,导致壳聚糖分子链发生了断裂、降解,致使壳聚粘度下降,而脱乙酰度却随之有小幅度提高,这是由于高浓度的碱液促进脱乙酰基反应,但随着乙酰基的不断减少,残留的乙酰基更难于脱去。10.00~11.25 mol·L-1 NaOH溶液条件下,制得的壳聚糖粘度较大,脱乙酰度较高,完全符合“把可溶解于1%的醋酸或盐酸中的甲壳素叫做壳聚糖”的定义(蒋挺大,1996)。
|
|
由表 8知,温度过低,脱除乙酰基不充分,得不到完全可溶的壳聚糖,过高又无法在常压下进行反应。仅在130℃下正常进行。
|
|
从表 9看,反应时间少于1 h,则不能脱除乙酰基得到壳聚糖。在2 h以下时,脱除很不完全,得不到完全可溶的壳聚糖。而时间过长,虽然壳聚糖脱乙酰度提高了,但易发生壳聚糖分子链的降解反应,使粘度大大下降,在反应时间3 h的条件下,脱除乙酰基较充分,粘度也较大。
|
|
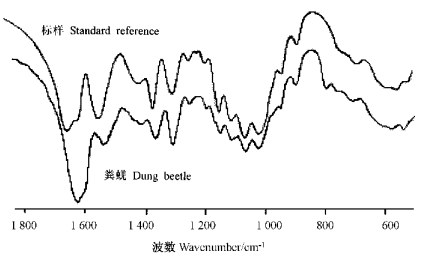
图 7为臭蜣螂甲壳素与标准样品(虾壳,SIGMA)红外谱图,两谱图均显示甲壳素特征谱带:在1 650 cm-1,1 560和1 315 cm-1左右为酰胺谱带,1 203 cm-1为多聚糖谱带,1 425和1 260 cm-1是CH2摆动、弯曲谱带。两谱图谱带特征吻合,可以断定从臭蜣螂中提出的甲壳素与标样化学构成一致。
|
图 7 两种样品的红外谱图 Fig. 7 IR spectra of two samples |
臭蜣螂虫体甲壳素含量高达28.7%,远高于常规的甲壳素生产原料——虾、蟹壳的含量(6%~14%)(蒋挺大,1996)。
2.6 虫源性甲壳素与常规原料甲壳素的品质性状比较分别用试虫与虾、蟹壳在相同反应条件下,提取甲壳素/壳聚糖,进行品质性状比较(表 10),可以看出:从外观品质上看,昆虫体提取的甲壳素色泽较白,而虾壳提取的甲壳素偏黄;在甲壳素残留灰分含量上,虾、蟹壳提取的甲壳素残留灰分含量明显偏高,分别是臭蜣螂甲壳素的2.6倍和6.6倍;在壳聚糖粘度上比较,从臭蜣螂和虾壳提取的壳聚糖粘度较高,而从蟹壳提取的壳聚糖粘度明显偏低;脱乙酰度上,三者差别不大,但虾壳壳聚糖略低(差异小于5%)。总体来看,臭蜣螂甲壳素/壳聚糖产品品质在甲壳素残留灰分、色泽以及壳聚糖粘度方面比虾、蟹壳提取的好,分析造成这种差异的原因与虾、蟹壳中高含量的石灰质有关。
|
|
臭蜣螂体内甲壳素含量达到28.7%,远高于目前常规的甲壳素生产原料——虾、蟹壳,而且其品质在壳聚糖粘度、甲壳素色泽和残留灰分等方面也比虾蟹壳好,是很好的甲壳素资源。
从臭蜣螂中提取甲壳素和壳聚糖的工艺为:①脱矿物质:0.8 mol·L-1 HCl预先70℃加热30 min, 然后在室温下浸泡12 h。②脱蛋白质:2.0~2.5 mol·L-1 NaOH,在90~100℃下,处理4~5 h。③脱乙酰基:10.00~11.25 mol·L-1 NaOH,在130℃下,处理3 h。
陈长琨. 1991. 昆虫生理生化实验. 北京: 农业出版社, 4-6.
|
黄伟坤(主编).食品检验与分析.北京: 轻工业出版社, 1989: 17-18
|
蒋挺大. 1996. 甲壳素. 北京: 中国环境科学出版社, 1-460.
|
钱合生. 1998. 甲壳素脱乙酰化反应. 中国纺织大学学报, 24(2): 100-103. |
王敦, 胡景江, 保从方. 2001. 从金龟子体中提取甲壳素的初步研究. 西北林学院学报, 16(4): 57. DOI:10.3969/j.issn.1001-7461.2001.04.016 |
严瑞煊. 1998. 水溶性高分子. 北京: 化学工业出版社, 519-565.
|
杨冠煌. 1998. 中国昆虫资源利用和产业化. 北京: 中国农业出版社, 1-4.
|
张志良, 吴光耀. 1986. 植物生物化学技术和方法. 北京: 农业出版社, 114-116.
|
Keisuke K. 1998. Chemistry and application of chitin and chitosan. Polymer Degradation and Stability, 59(2): 117-120. |
Skjak-Braek G, Anthosen T, Sandford P. 1986. Chitin and Chitosan. London: Elsevier, 1-217.
|
 2004, Vol. 40
2004, Vol. 40