文章信息
- 王克荣, 周扬, M G Milgroom.
- Wang Kerong, Zhou Yang, M G Milgroom.
- 中日美栗疫病菌群体遗传结构比较
- Comparison of Genetic Structures among Cryphonectria parasitica Populations from China, Japan and the USA
- 林业科学, 2004, 40(5): 127-131.
- Scientia Silvae Sinicae, 2004, 40(5): 127-131.
-
文章历史
- 收稿日期:2002-10-10
-
作者相关文章
2. 美国康乃尔大学植病系 NY 14853
2. Department of Plant Pathology, Cornell University NY 14853
栗疫病菌(Cryphonectria parasitica)是引起栗树(Castanea spp.)枝杆树皮腐烂并导致植株死亡的一种子囊菌,自20世纪初传入美国后,在美洲栗(C. dentata)分布区迅速蔓延,使数十亿株美洲栗感病死亡(Anagnostakis,1987),给美国造成严重的经济损失,美洲栗自此很难长成结实期的大树而受到灭种的威胁(Roane et al., 1986)。
东亚地区,包括中国和日本,是栗疫病的起源地(Anagnostakis, 1987)。据报道,美国的栗疫病菌是100a前自亚洲传入美国的(Roane et al., 1986)。1992年,笔者曾对中美两国的少数栗疫病菌菌株的群体遗传结构进行初步的比较(Milgroom et al., 1992a),结果表明中国菌株间的遗传变异性大于美国菌株间的遗传变异性,此结果符合母群体与子群体间关系的特征,但少数探针又产生相反的令人困惑的杂交结果。
本研究试图对中国和日本栗疫病菌群体的遗传分化特征以及美国栗疫病菌的可能地理来源进行分析。
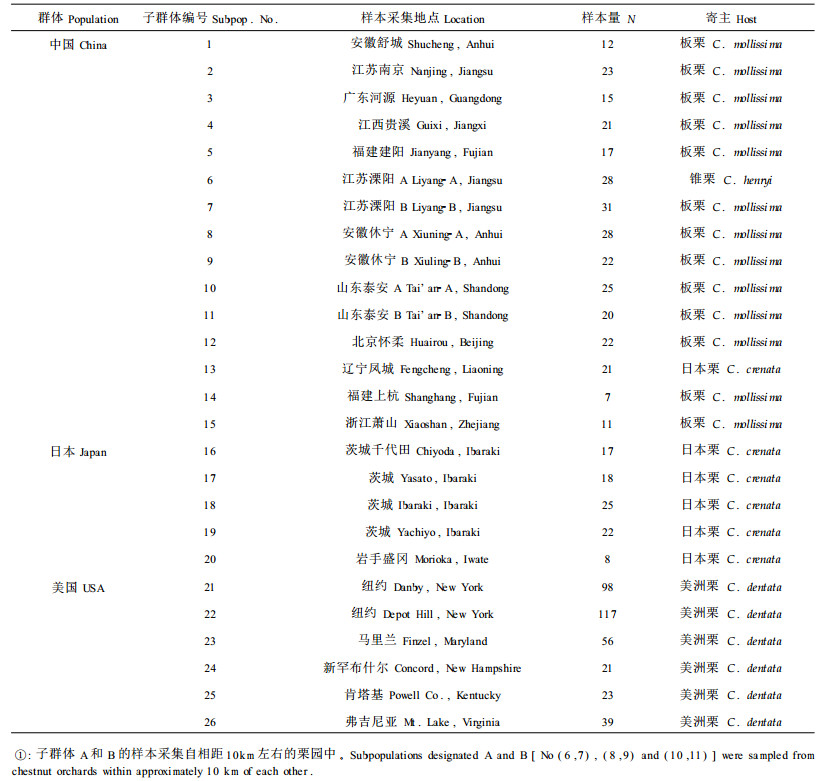
1 材料与方法 1.1 栗疫病菌菌株的群体样本自中国的15个子群体,日本5个子群体和美国6个子群体的不同栗树上采集并分离了757个栗疫病菌菌株,每棵树上只分离一个菌株。参试菌株的采集地点、子群体编号及样本量见表 1, 大多数子群体的样本量都超过20个菌株,菌株的采集和分离方法见文献(Milgroom et al., 1992a; 1992b; 1993)。
|
|
1992年的初步结果表明参试的中国栗疫病菌的指纹图谱结果与美国群体存在很大差异(Milgroom et al., 1992b),因而本实验中美国群体的全部菌株,日本群体的一半菌株以及中国群体的11个子群体各取3个随机样本菌株(经随机过程)参与了DNA指纹图谱的分析,发现中国群体辽宁子群体菌株的指纹图谱与其他子群体不同后,增加了中国辽宁凤城和北京怀柔两子群体的全部菌株参与指纹图谱分析。
1.2 遗传标记栗疫病菌的核DNA的RFLP和指纹图谱的分析方法见文献(Milgroom et al., 1992a; 1992b; 1993)。有9个探针用于对中国和日本群体RFLP的分析,这9个探针可对总共13个核DNA的基因位点(PMS11、PMS26、PMS29、PCB2、PCB4、PCB17、PCB35、PCB15-1、PCB15-2、PCB15-3、PCB15-4、PCB19-1和PCB19-2)进行杂交,各基因位点及其等位基因位点均通过对菌株间杂交产生的后代进行测定分析得出,等位基因的分离符合孟德尔的1:1遗传规律。采用一套能与8个位点杂交的5个探针比较美国和亚洲群体的遗传结构。参与指纹图谱分析的各菌株DNA用PstⅠ酶切后电泳,转移尼龙膜上的DNA与同位素32P标记的指纹探针pMS5.1杂交后进行自显影。
1.3 数据处理采用Nei and Chesser公式(1983)估计群体内和群体间的遗传变异。
以HS估计群体内的平均遗传分化: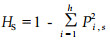
以HT估计子群体间的平均遗传分化: 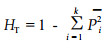
以GST间接估计因子群体间差异而产生的遗传差异部分:
不同探针检测的栗疫病菌DNA的相应基因位点,不同群体的子群体存在不同的频率。对于探针PCB4、PCB17、PCB19和PCB35,美国群体菌株不产生适宜的基因位点杂交带(见图 1a的EP155),因而只在其他5个探针(PMS11、PMS26、PMS29、PCB15和PCB2)上的杂交结果与中日群体有可比性。日本群体菌株与这4个探针的杂交结果,除PCB17与子群体17、19和20的杂交结果表现出一定的等位基因多样性(主等位基因频率分别为0.94、0.83和0.91)外,PCB4、PCB19和PCB35与日本群体菌株的DNA杂交结果均表现一致,主等位基因频率都为1.0。中国群体菌株DNA与探针PMS26杂交结果比日本、美国群体菌株表现出更大的复杂性,福建建阳子群体(编号5)在7个等位基因位点上都有杂交带分布(见图 1b),等位基因位点超过4个的中国群体中有8个子群体,日本群体有4个子群体,美国群体只有弗吉尼亚1个子群体(编号26)。
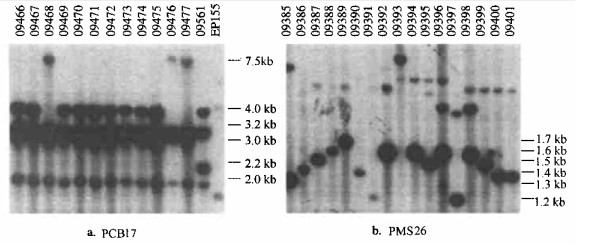
|
图 1 栗疫病菌中国群体菌株(EP155为美国菌株)DNA与探针PCB17和PMS26杂交后放射自显影指纹图谱 Fig. 1 Fingerprinting pattern of autoradiograph of southern blot with Pst Ⅰ-digested DNA from Chinese isolates (EP155 from USA) of C. parasitica probed with random plasmid PCB17 and PMS26 |
中国和美国群体菌株与PMS29和PCB2探针的杂交结果正相反。中国群体的各子群体在PMS29上基因位点表现一致,8.0 kb杂交带的等位基因频率都为1.0;美国群体的各子群体菌株则都表现出等位基因的多态性,该等位基因的频率分布在0.14~0.90之间。中国群体的各子群体在PCB2探针上基因位点表现多样,除泰安B子群体在6.8 kb杂交带的等位基因频率为1.0,其他14个子群体在该等位基因的频率分布在0.26~0.91;美国群体的各子群体菌株则都表现出等位基因的一致性,该6.8 kb的等位基因的频率均为1.0,同样,日本群体各子群体在这两个探针杂交的基因位点的频率也介于中美群体之间。
2.2 栗疫病菌各群体的遗传分化中国和日本群体的遗传分化值分别为0.15和0.20(见表 2)。中国的子群体间在遗传分化程度上有一定的差异,该值(GST)在中国群体中为0.10, 而日本群体的GST为0.00, 表明日本子群体间在遗传分化上没有差异。中国群体和日本群体间存在中度的遗传差异,GST的估计值为0.28。在对一组基因位点进行分析以比较中国、日本和美国群体间的遗传差异时, HT值差不多比中日群体间的HT值大一倍, GST值也上升为0.43。由此可以看出,美国群体与中日群体间极少或没有发生基因的交流。
|
|
本研究采用了Biosys-1中的Rogers相似指数进行子群体间遗传相似性的计算,采用UPGMA统计方法(Swofford et al., 1981)各子群体的杂交数据进行聚类分析,并由此作出各子群体间的遗传关系树状图(图 2)。从聚类分析图中可以清楚地看出中国群体与日本、美国的群体间存在明显的遗传差异,而美国群体与日本群体间则关系密切,其中美国有一个子群体(编号24, 采自新罕布什尔州的Concord县)与日本群体被分在同一个大类中(见图 2)。

|
图 2 中日美栗疫病菌子群体的聚类分析 Fig. 2 Phenogram of genetic similarities among C. parasitica subpopulations from China, Japan and the USA |
由探针PMS5.1杂交而得到的DNA指纹图谱(见图 3)表明,所有杂交的美国和日本群体的菌株都具有8~12条杂交带,而且相互间图谱很少相同,揭示了这两个地区栗疫病菌在指纹图谱上的高度变异性和复杂性。在中国群体中,只有辽宁凤城子群体(编号13)与日本和美国群体菌株的指纹图谱相似,平均每个菌株有12.3个杂交带,其他14个子群体的随机样本杂交结果表明,PMS5.1探针对这些菌株杂交只产生2~4条杂交带,而且菌株间的杂交图谱非常相似(图 3),而凤城子群体病菌的寄主也为日本栗系统的丹东栗。

|
图 3 栗疫病菌中国辽宁子群体(左)和北京子群体(右)菌株的DNA指纹图谱 Fig. 3 DNA fingerprinting pattern of C. parasitica isolates from Liaoning (left) and Beijing (right) subpopulations in China Std:标样Standard.DNA提取自美国菌株V8-1-32, Pst I酶切,该菌株含有可与pMS5.1杂交的17条限制性酶切片段 Pst Ⅰ-digested DNA from American isolate V8-1-32, which contains 17 restriction fragments that hybridize to PMS5.1. |
本研究结果表明,中国的栗疫病菌各子群体间具有一定的遗传分化,这种差异表现在子群体间的GST为0.10,而日本的子群体间没有遗传差异的实验证据。不过需要说明的是,参试的日本5个子群体中,有4个子群体样本都采自一个120 km范围的地区内[筑波(Tsukuba)附近],而另一个子群体[编号20, 采自盛冈(Morioka)]的样本含量又很少,因此,这个GST是否反映了日本群体的实际情况, 需要在更大范围采集更多样本进行研究来验证。
栗疫病菌的亚洲群体与美国群体间存在高度的遗传差异(GST=0.43),有力表明在两大洲的栗疫病菌群体间极少或没有基因流的发生, 病菌群体的遗传分化可能主要由于遗传漂变产生的,但也不能完全排除自然选择的作用。
从RFLP的聚类分析以及核DNA的指纹图谱结果的分析,可以认为美国的栗疫病菌与日本病菌群体的遗传关系更密切。PMS5.1探针对日本、美国菌株来说是个指纹图谱探针,但对中国大多栗疫病菌群体(非日本栗寄主)来说只是个普通探针,而辽宁凤城的丹东栗据传说为引自日本的日本栗后在我国的称呼。本研究结果中栗疫病菌各群体的遗传特征说明美国的栗疫病菌极可能是从日本传入的,而不可能来自中国。
Anagnostakis S L. 1987. Chestnut blight: the classical problem of an introduced pathogen. Mycologia, 79: 23-37. DOI:10.1080/00275514.1987.12025367 |
Milgroom M G, Lipari S E, Wang K R. 1992a. Comparison of genetic diversity in the chestnut blight fungus, Cryphonectria parasitica, from China and the U S. Mycol Res, 96: 1114-1120. DOI:10.1016/S0953-7562(09)80123-8 |
Milgroom M G, Lipari S E, Powell W A. 1992b. DNA fingerprinting and analysis of population structure in the chestnut blight fungus, Cryphonectria parasitica. Genetics, 131: 297-306. |
Milgroom M G, Lipari S E, Ennos R A, et al. 1993. Estimation of the outcrassing rate in the chestnut blight fungus, Cryphonectria parasitica. Heredity, 70: 385-392. DOI:10.1038/hdy.1993.54 |
Nei M, Chesser R K. 1983. Estimation of fixation indices and gene diversities. Ann Hum Genet, 47: 253-259. DOI:10.1111/j.1469-1809.1983.tb00993.x |
Roane M K, Griffin G J, Elkins J R. 1986. Chestnut blight, other Endothia disease, and the genus Endothia. Minnesota: APS Press.
|
Swofford D L, Selander R B. 1981. BIOSYS-1: a FORTRAN program for the comprehensive analysis of electrophoretic data in population genetics and systematics. J Hered, 72: 281-283. DOI:10.1093/oxfordjournals.jhered.a109497 |
 2004, Vol. 40
2004, Vol. 40