文章信息
- 孙守家, 赵兰勇, 仇兰芬, 于守超, 赵汝侍.
- Sun Shoujia, Zhao Lanyong, Qiu Lanfen, Yu Shouchao, Zhao Rushi.
- 平阴玫瑰鲜花花蕾采后衰老生理机制研究
- Study on the Physiological Mechanism of Postharvest Senescence in Flower Buds of Rosa rugosa Cultivars in Pingyin County
- 林业科学, 2004, 40(5): 79-83.
- Scientia Silvae Sinicae, 2004, 40(5): 79-83.
-
文章历史
- 收稿日期:2003-03-07
-
作者相关文章
2. 山东农业大学林学院 泰安 271018;
3. 青岛职业技术学院 青岛 266555;
4. 山东平阴玫瑰研究所 平阴 250400
2. College of Forestry, Shandong Agricultural University Tai'an 271018;
3. Qingdao Vocational and Technical College Qingdao 266555;
4. Research Institute of Pingyin Rose Pingyin 250400
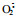 production rate increased as the progress was developing. The time of initial decreasing point of POD activity appeared later than that of other factors. The result of correlation analysis showed that protein was strongly related with factors of membrane permeability, MDA,
production rate increased as the progress was developing. The time of initial decreasing point of POD activity appeared later than that of other factors. The result of correlation analysis showed that protein was strongly related with factors of membrane permeability, MDA, 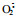 , SOD and CAT. The membrane lipid peroxidation and enzyme system detriment were primarily considered to be the major physiological factors in postharvest senescence in flower buds of R.rugosa cultivars in Pingyin County.
, SOD and CAT. The membrane lipid peroxidation and enzyme system detriment were primarily considered to be the major physiological factors in postharvest senescence in flower buds of R.rugosa cultivars in Pingyin County.玫瑰(Rosa rugosa)属蔷薇科(Rosaceae)蔷薇属植物,原产我国北部,现南北各地及日本、朝鲜等国均有栽培。平阴玫瑰(R.rugosa cv.)是优质的玫瑰品种,产于山东济南市平阴县,以花大色艳、香气浓郁、含油量高而驰名中外。玫瑰鲜花含有多种微量元素,维生素C含量很高,珍贵的玫瑰油含量高达0.046%(金敬宏, 2000; 唐舜庆, 1994),由玫瑰鲜花提炼的天然香精和香料产品具有极高的经济价值,是配制高级香精、香烟、饮料、印刷用油墨、高级香水、高级化妆品等重要原料之一,玫瑰精油在国际市场有“液体黄金”之称。但是,玫瑰鲜花开花时间短,采集时间集中,若短时间不能及时加工完毕,就会衰败变质。试验证明玫瑰鲜花完全盛开后出油率就会降低50%左右,严重地影响了玫瑰鲜花的出油量。自然摊放在水泥地上的玫瑰鲜花2 d就会败落衰老,含油量由0.042 3%降到0.025 2%(张海云等, 1997)。可见,玫瑰花蕾的衰老对其产品质量影响很大。而迄今为止,国内外学者对平阴玫瑰鲜花花蕾的采后衰老生理研究不多。本文研究了平阴玫瑰花蕾在贮藏过程中的生理生化变化,旨在探讨花蕾衰老的生理原因,为其储藏保鲜提供理论依据。
1 材料和方法 1.1 材料平阴玫瑰品种采自济南市平阴县玫瑰研究所,选用的品种有重瓣玫瑰(R. rugosa cv.‘Plena’)、唐紫(R.rugosa cv. ‘Tang purple’)、紫枝玫瑰(R.rugosa cv. ‘Purple branch’)、唐白(R.rugosa cv. ‘Tang white’)4个品种(杨明等,2003)。采收萼片向外反折到水平、花瓣开始松散的花蕾,采后在0~2℃冰壶保存,2 h内送回实验室,在室温22~25℃、相对湿度40%~50%条件下自然摊放。采样时从外向内取第2到4轮的花瓣,每6 h取样一次, 相同试验重复进行3次。
1.2 方法细胞质膜透性:电导法(乔爱民等,2000);酶液制备:取花瓣1 g于预冷的研钵中,加50 mmol·L-1 pH 7.8(POD用pH 6.0)磷酸缓冲液2 mL在冰浴下研磨成浆,加缓冲液定容为10 mL,匀浆在10 000 r·min-1离心10 min,取上清液用作SOD、CAT、POD活性和可溶性蛋白质含量测定;可溶性蛋白:考马斯亮蓝G-250染色法(邹琦, 2000);SOD活性:氮蓝四唑(NBT)光还原法,以抑制NBT光还原的50%为一个酶活性单位;POD活性:愈创木酚氧化法(Zhang et al., 1994),以470 nm下光密度每min升高0.01为一个酶活性单位;CAT:按Zhang等(1994)方法进行,以240 nm每min光吸收值减少0.01为一个酶活性单位;MDA含量:硫代巴比妥酸(TBA)双组分分光光度计法测定;超氧自由基(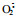
从图 1可以看出,花蕾贮藏过程中蛋白质含量先上升后下降,不同品种之间的变化幅度不同,但变化趋势一致。蛋白质与植物器官的衰老密切相关(高勇等,1990),蛋白质含量先上升后下降的趋势主要与采收时的成熟度有关。贮藏初期可溶性蛋白质仍以合成为主,含量随时间推移而上升,合成产物可能是与衰老有关的各种酶;当花蕾进入衰老阶段,蛋白质以分解为主,其含量逐渐下降。下降的趋势在各品种之间差别不大,但出现时间的早晚不同,重瓣玫瑰、唐白贮藏6 h时可溶性蛋白质含量达到最高,6~30 h蛋白质急剧降解,30 h以后蛋白质降解趋缓;唐紫、紫枝玫瑰贮藏0~12 h时蛋白质含量上升,12 h后蛋白质含量下降,12~36 h蛋白质含量迅速下降,36 h后下降趋缓。蛋白质含量降解速率由快到慢说明在6~30 h蛋白质作为能源物质维持生命活动大量被消耗,其后由于生命活动减弱,蛋白质降解速度变慢。

|
图 1 贮藏期间花瓣中可溶性蛋白质含量变化 Fig. 1 Changes of soluble protein content in petals during storage |
SOD是植物体内清除超氧自由基的关键酶之一,它催化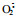

|
图 2 贮藏期间花瓣SOD、CAT和POD的活性变化 Fig. 2 Changes of SOD, CAT and POD activities in petals during storage |
POD是消除过氧化物、降低活性氧伤害的主要酶类之一,由图 2c可以看出,花蕾在贮藏过程中POD的活性变化是前期(0~30 h)缓慢上升后期迅速下降,活性达到最高值的时间因品种而异,唐白最早,重瓣玫瑰次之,唐紫和紫枝玫瑰最后。前期升高的原因可能是POD利用SOD消除自由基时产生的H2O2进行与衰老有关的氧化反应,也有研究认为POD活性升高与乙烯自身催化合成和衰老细胞的活性有关(莱谢姆等,1990)。后期下降的原因可能是平阴玫瑰花蕾贮藏过程中蛋白质大量降解,酶的含量下降。
2.4 质膜透性和MDA的变化电导率是反映细胞膜透性的重要指标之一,膜透性变化反映了膜的稳定性和细胞的完整性。由图 3可见,随着贮藏期的延长,花瓣的相对电导率逐渐上升,在前期膜透性上升缓慢,后期透性增加迅速。唐白和重瓣玫瑰后期有一个迅速升高的过程,这表明它们的细胞膜已经受到伤害,细胞内含物大量外渗,加剧了水分的丧失,从而加速了衰老。而唐紫在贮藏过程中细胞膜透性变化较缓,紫枝玫瑰后期有一个上升的过程。MDA是由膜质中不饱和脂肪酸发生脂膜过氧化作用而产生的,它的生成和积累会对生物膜造成严重的损伤,与花蕾的衰老密切相关。由图 4可以看出,MDA的摩尔数逐渐增加,贮藏前期(0~12 h)缓慢上升,其后上升的速度加快,各品种之间的变化趋势一致。MDA增加是过氧化作用加剧、膜受到损伤的重要表现,其含量越高表明膜质过氧化作用越强,多种酶和膜系统受到的损伤越严重。因此质膜透性和MDA大幅度增加是平阴玫瑰花蕾贮藏过程中加速衰老的重要标志之一。

|
图 3 贮藏期间花瓣质膜相对透性变化 图 4 贮藏期间花瓣中MDA含量变化 图 5 贮藏期间花瓣超氧自由基产生速率变化 Fig. 3 Changes of membrane relative permeability in petals during storage Fig. 4 Changes of MDA content in petals during storage Fig. 5 Changes of  |
超氧自由基能与细胞中不饱和脂肪酸作用,在铁离子催化下通过Haber-Weiss反应产生大量的羟自由基,羟自由基使脂类R-H转化为R自由基,产生脂类过氧化的链式产物,使过氧化脂质在细胞内积累,影响细胞功能的发挥。从图 5可以看出,超氧自由基产生速率0~12 h上升缓慢,12~42 h迅速上升,42~48 h缓慢上升或略有下降,呈现“S”型曲线,其中唐白和重瓣玫瑰的
蛋白质含量和植物衰老关系密切,Halevy等(1981)认为蛋白质含量下降是植物衰老的一个重要指针。但本试验观察到平阴玫瑰花蕾中蛋白质含量先略有上升后逐步下降,原因是花蕾尚未完全发育成熟,贮藏初期蛋白质以合成为主,包括合成各种与衰老有关的酶,在以后的衰老过程中蛋白质大量降解,含量下降。
3.2 酶系统与平阴玫瑰花蕾衰老关系根据目前的研究成果,植物体对潜在的活性氧伤害存在精细而复杂的防御体系,主要有SOD、CAT、POD等酶类和VE、VC、类胡萝卜素等抗氧化剂(宋纯鹏,1998)。在衰老早期SOD能够有效地清除体内超氧自由基,减轻自由基对细胞膜的伤害作用,衰老后期SOD不能有效地清除超氧自由基,从而引发膜质过氧化作用,活性氧代谢失调与积累是加速衰老的一个重要原因(熊运海,2000)。SOD催化超氧自由基发生歧化反应产生O2和H2O2,而CAT和POD可以催化H2O2分解(Chris et al., 1992),从而避免羟自由基的破坏作用。从表 1中可以看出,SOD酶活性变化和CAT酶活性变化呈显著的正相关,相关系数分别高达0.947、0.965、0.960、0.863,而与POD酶活性变化呈负相关,其中唐紫和紫枝玫瑰呈现显著负相关关系,这说明SOD和CAT在清除自由基方面有一定的相关性,它们之间存在某些协同作用,这是今后值得研究的方向之一。SOD和POD呈负相关原因主要是SOD活性高峰出现在衰老的前期,POD活性高峰出现在衰老的后期。2种酶活性高峰出现的次序不同,可能与顺序调节着衰老期间自由基的产生有关。
|
|
贮藏过程中花瓣的细胞膜透性随着贮藏时间的推移逐渐上升。相关分析表明,花瓣中可溶性蛋白质含量下降和细胞质膜透性上升呈显著的负相关关系,重瓣玫瑰、唐紫、紫枝玫瑰、唐白的相关系数分别为-0.933、-0.914、-0.793、-0.863,品种之间差别较大。大量研究表明,衰老过程中可溶性蛋白质含量下降是许多鲜花衰老的重要标志,由此可以看出玫瑰花蕾在贮藏期间衰老与细胞膜受伤害的程度密切相关。MDA和细胞质膜透性变化趋势基本一致,呈极显著正相关关系,4个品种相关系数分别高达0.988、0.980、0.970、0.971,说明当MDA含量积累到一定的程度时,就会损害细胞膜,膜透性的增大引起细胞内代谢紊乱,酶系统遭到破坏,自由基清除功能降低,膜脂过氧化作用加强,最终导致细胞膜完整性破坏,细胞死亡(Fridovic,1995)。从表 1中可以看出,
综上所述,平阴玫瑰花蕾在贮藏过程中的衰老是一个非常复杂的过程,水分丧失,蛋白质大量降解,活性氧代谢失调与积累,酶系统活性下降,MDA含量增加,细胞膜相对透性增大,膜质过氧化作用加强,这一系列相关变化是导致平阴玫瑰花蕾迅速衰老的主要生理原因。不同平阴玫瑰品种由于蛋白质降解、活性氧代谢和酶系统活性水平差异,从而造成了膜系统稳定性不同,最终表现为衰老进程不同。因此,通过有效措施增强平阴玫瑰花蕾中酶系统活性、维持活性氧产生与清除之间的平衡是贮藏保鲜的重要途径。
高勇, 吴绍锦. 1990. 月季切花瓶插期生理变化与衰老关系的研究. 园艺学报, 17(1): 71-75. |
金敬宏. 2000. 玫瑰的综合开发. 中国野生植物资源, 19(6): 21-25. |
乔爱民, 谢黎飞, 盛爱武. 2000. ZnCl2对瓶插月季切花保鲜作用的初步研究. 仲凯农业技术学院学报, 13(1): 10-14. |
宋纯鹏编.植物衰老生物学.北京: 北京大学出版社, 1998: 41-44
|
唐舜庆. 1994. 玫瑰新品种的选育. 北京林业大学学报, 16(4): 60-63. |
王爱国, 罗广华. 1990. 植物的超氧物自由基与羟胺反应的定量关系. 植物生理学通讯, 26(6): 55-57. |
熊运海. 2000. 贮藏过程中月季切花衰老的生理机制初探. 西南师范大学学报(自然科学版), 25(2): 164-168. DOI:10.3969/j.issn.1000-5471.2000.02.012 |
杨明, 赵兰勇. 2003. 山东平阴玫瑰种质资源调查研究及类型划分. 中国园林, (7): 61-63. DOI:10.3969/j.issn.1000-6664.2003.07.016 |
张海云, 孟宪水. 1997. 影响玫瑰花出油率的因素. 香料香精化妆品, (4): 42-43. |
邹琦. 2000. 植物生理学实验指导. 北京: 农业出版社.
|
莱谢姆Y Y, 哈勒维A H, 法伦克尔C著.胡文玉, 谢甫娣, 李晓萍等译.植物衰老过程和调控.沈阳: 辽宁科学技术出版社, 1990
|
Chris B, Marc V H, Dirk I. 1992. Superoxide dismutase and stress tolerance. Annu Rev Plant Pysiol Plant Mol Biol, 43: 83. DOI:10.1146/annurev.pp.43.060192.000503 |
Fridovic I. 1995. Superoxide readical and superoxide dismutase. Annu Rev biochem, 64: 97. DOI:10.1146/annurev.bi.64.070195.000525 |
Halevy A H, Mayak S. 1981. Senescence and postharvest physiology of cut flowers: Part 2. Horticulture Review, 3: 59-143. |
Zhang J X, Kirkham M B. 1994. Drought-stress-induced changes in activities of superoxide dismutase, catalase, and peroxidase in wheat species. Plant Cell Physio, 135(5): 785-791. |
 2004, Vol. 40
2004, Vol. 40


