文章信息
- 殷幼平, 王中康, 曹月青, 何正波.
- Yin Youping, Wang Zhongkang, Cao Yueqing, He Zhengbo.
- 桑粒肩天牛幼虫内切-β-1, 4-葡聚糖酶的纯化及性质
- Purification and Properties of Endo-β-1, 4-glucanase from Larvae of Apriona germari
- 林业科学, 2004, 40(2): 103-106.
- Scientia Silvae Sinicae, 2004, 40(2): 103-106.
-
文章历史
- 收稿日期:2002-08-12
-
作者相关文章
纤维素是地球上含量最丰富的碳水化合物,它是由β-1, 4-葡萄糖苷键连接而成的葡聚糖链。纤维素的降解一般是通过微生物的作用进行的,一些昆虫也能消化食物中的纤维素成分(蒋书楠等,1996;殷幼平等,2000;Breznak,1994;Inoue et al., 1997; Itakura, 1998; Matin, 1983; Williams, 1978)。桑粒肩天牛(Apriona germari)是一种重要的林木害虫,其幼虫钻蛀于树干中以木质纤维素为食,导致树势衰弱,严重影响林木生长和产品质量。本文通过对桑粒肩天牛幼虫肠道主要纤维素酶的分离纯化及其性质测定,为从其消化生理方面探讨新的防治策略提供理论基础。同时,纤维素酶的纯化为测定桑天牛主要纤维素酶的氨基酸序列,推断纤维素酶的基因序列,进而为开发新的纤维素酶资源奠定基础。
1 材料与方法 1.1 实验昆虫天牛幼虫采于西南农业大学校园内,寄主为桑树或构树。解剖前使其饥饿1天,排除体内食物残渣。
1.2 方法 1.2.1 粗酶液的制备75%酒精消毒天牛体表,冰浴下解剖天牛,取其肠道,置于0.01 mol pH 5.5乙酸-乙酸钠缓冲液中(1 mL·g-1虫体重),研磨后以12 000 r·min-1离心,取上清液即为粗酶液。
1.2.2 酶的纯化粗酶液中加入预冷丙酮,使其终体积分数为80%,0℃放置4h,15 000 r·min-1冷冻离心取沉淀备用。凝胶过滤:将丙酮沉淀的蛋白质溶于0.01 mol pH 5.5 HAc-NaAc缓冲液中,上样于Ultrogel AcA54凝胶柱(2.6 cm×90 cm),用平衡缓冲液进行洗脱,收集与其他纤维素酶活性峰交叉较少的内切-β-1, 4-葡聚糖酶(endo-β-1, 4-glucanase,EG)活性峰洗脱液, 真空浓缩。离子交换柱层析:将上步浓缩液用0.01 mol pH 5.8 HAc-NaAc缓冲液透析平衡,加到Q-Sepharose柱上(1.0 cm×15 cm)。用50 mL 0.01 mol pH 5.8 HAc-NaAc加50 mL 1 mol NaCl(乙酸缓冲液配制)进行连续梯度洗脱,测定各管收集液的A280及EG酶活性。收集EG酶活性较高的部分,用于PAGE制备电泳。聚丙烯酰胺凝胶制备电泳(PAGE):除未加SDS外, 其余参照莽克强等(1975)法进行。分离胶浓度为12.5%,浓缩胶浓度为4%,电泳结束后, 切下边缘1 cm宽的胶条与含CMC-Na的琼脂底物平板进行印迹,活性带显色采用刚果红作染色剂,参照Bartley等(1984)方法进行。从剩余胶板上切下活性带相应位置处的胶条,放置于装有0.01 mol pH 5.5 HAc-NaAc缓冲液的透析袋内,进行电洗脱后用于分子量和等电点测定。
1.2.3 纤维素酶活性测定内切-β-1, 4-葡聚糖酶(EG)、β-1, 4-葡萄糖苷酶活性测定分别以1%的羧甲基纤维素钠(CMC-Na)、1%的水杨苷为底物(均用0.01 mol pH 5.5 HAc-NaAc缓冲液配制)。取0.5 mL底物溶液,加入100 μL酶液,37℃水浴反应1 h,水解产生的还原糖用Somogyi-Nelson微量法测定(Williams et al., 1978)。对照以缓冲液代替酶液,其余步骤相同。以测定条件下产生1 μmol·h-1还原糖的酶量定义为一个酶活力单位。比活为每mg蛋白质所含有的酶活力单位。纤维二糖水解酶(CBH)活性测定参照Inoue等(1997)的方法进行。以本实验条件下产生0.1 μmol·h-1对-硝基苯的酶量定义为一个酶活力单位。
1.2.4 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)参照何忠效等方法(1990),采用Tris-Tricin缓冲液系统进行。分离胶浓度为12.5%,浓缩胶浓度为5%,银染染色。
1.2.5 等电聚焦电泳(IEF)按何忠效等(1990)薄层凝胶等电聚焦法。凝胶薄层为900 mm×120 mm×0.5 mm,凝胶浓度为7.5%,内含2.5%两性电解质(pH 3.5~5),聚焦在40℃下进行。电源电压、电流最高值限定为1 200 V、30 mA,恒功率5 W聚焦。聚焦完毕,从凝胶两边切下1 cm宽的胶条,切成0.5 cm小段, 依顺序放于0.5 mL离心管中,分别加入100 μL蒸馏水浸泡过夜, 用精密试纸测定pH,绘制pH-距离图,测定等电点,其余凝胶做酶活和蛋白质染色。
1.2.6 蛋白质浓度的测定柱层析洗脱液蛋白质浓度以吸光度A280表示, 采用Bradford方法(1976)。
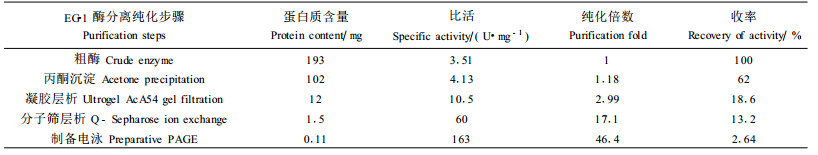
2 结果与讨论 2.1 酶的纯化图 1所示,粗酶液经Ultrogel AcA54凝胶过滤层析后,洗脱出2个蛋白质峰,CBH、EG和β-1, 4-葡萄糖苷酶3种酶活性成分都位于第2个蛋白质峰内。CBH与葡萄糖苷酶活性峰基本重合,而EG酶活性峰与这两种酶重合较少。收集EG酶活性较高且另外两种酶含量较低的部分,透析后冷冻浓缩。再将此浓缩液上Q-Sepharose离子交换柱进一步纯化。从层洗脱曲线可见,部分杂蛋白被除去,EG酶仅一个洗脱峰(图 2)。

|
图 1 肠道纤维素酶凝胶过滤纯化 Fig. 1 Purification of cellulases on Ultrogel AcA54 gel filtration —■—蛋白质浓度A280 Protein concentration A280 —○—内切-β-1, 4-葡聚糖酶Endo-β-1, 4-glucanase —△—纤维二糖水解酶β-1, 4-glucosidase —*—纤维二糖酶Cellobiohydrolases |
|
图 2 EG-1酶Q-Sepharose离子交换柱层析纯化 Fig. 2 Purification EG enzyme on Q-Sepharose ——蛋白质浓度Protein concentration (A280) —□—EG-1酶活性EG-1 Enzyme activity |
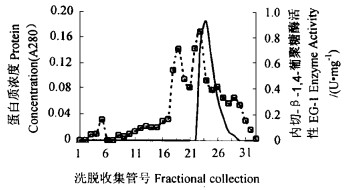
将离子交换所得样品进行PAGE制备,电泳结束后,用底物平板印迹。红色底物平板上的透明带即为EG酶活性带(图 3)。在聚丙烯酰胺凝胶上与此透明带相对应的蛋白带即为EG酶。从染色结果可见,粗酶液经分子筛和离子交换柱层析后所的活性峰仍然为一混合物,PAGE染色后可见多条蛋白质带。电泳后切下与底物平板上的最大活性带相对应的凝胶,电洗脱浓缩后测定其纯度得到单一酶带,命名为EG-1(见表 1)。
|
图 3 EG-1酶PAGE银染及印记染色 Fig. 3 Native PAGE and print chromatography of EG-1 a:蛋白质银染Bands of protein;b:酶活性染色Band of enzyme activity. |
|
|
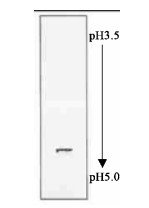
经SDS-PAGE及IEF检测制备PAGE分离纯化所得EG-1酶,均呈现一条单带,说明此EG-1酶已达到电泳纯,如图 4、5,测其分子量及等电点分别为26 ku、pI 4.0。

|
图 4 EG-1 SDS-PAGE银染蛋白质谱带 Fig. 4 Purified EG-1 of SDS-PAGE a:纯化的EG-1酶Purified EG-1;b:蛋白质标准Protein markers. |
|
图 5 EG-1酶IEF银染 Fig. 5 IEF of purified EG-1 |
收集桑粒肩天牛肠道酶液凝胶过滤EG酶活性峰处的洗脱液,用于酶的性质测定。
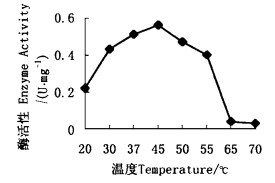
2.2.1 EG酶最适反应温度及热稳定性以0.1 mol pH 5.6 Na2HPO4-0.05 mol柠檬酸缓冲液配制的1% CMC-Na溶液为底物,分别在不同孵育温度下测定EG酶的活性。图 6显示,EG最适反应温度为45℃。
|
图 6 温度对EG酶的影响 Fig. 6 Effect of temperature on EG |
将酶液在20、37、50、70℃下分别水浴预处理30、60、120 min后,在37℃测定EG酶的酶活力,以未经预处理酶液活力为100,计算不同处理后剩余酶活力。20℃、37℃处理2 h,酶活损失不大;50℃处理30 min,酶活急剧下降;70℃处理2 h,酶已几乎全部失活(图 7)。

|
图 7 EG酶的热稳定性 Fig. 7 Effect of temperature on stability of EG —◆—20℃ —■—37℃—▲—50℃ —●—70℃ |
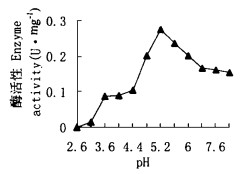
以柠檬酸缓冲液(pH 2.6~8.0)按每0.6 pH梯度间隔配制的1% CMC-Na溶液为底物,测定酶的活性,测得桑粒肩天牛EG酶最适作用pH为5.2,如图 8。
|
图 8 pH对EG酶的影响 Fig. 8 Effect of pH on EG |
关于昆虫纤维酶的种类,至今仍有很大争议。有人认为纤维素的消化需要EG酶、CBH、β-1, 4-葡萄糖苷酶3种酶的协同作用,缺一不可(Itakura et al., 1998; Martin, 1983);也有的认为CBH并非必需,EG酶具有CBH的作用,仅依靠EG酶和β-1, 4-葡萄糖苷酶便可将纤维素水解为单糖(Itakura,1998;Scrivener et al., 1989)。桑粒肩天牛肠道中可以检测到3种纤维素酶活性,但CBH酶活性很弱,其在天牛对纤维素的消化中究竟起多大作用,还有待于进一步研究。凝胶过滤EG酶和CBH的活性峰重合很少,而β-1, 4-葡萄糖苷酶与CBH活性峰几乎完全重合。离子交换柱层析还显示,几种纤维素酶都有不同数目的同工酶。
天牛消化纤维素酶的来源一直有争议。本研究说明桑粒肩天牛的EG-1酶的热稳定性、最适作用温度、最适反应pH等等均无极端要求,与真菌等微生物的纤维素酶有很大区别(崔福锦等,1984;蒋书楠等,1996);曹月青等(2001)从桑粒肩天牛前中肠肠液分离到一株兼性厌氧纤维素分解菌,其分解纤维素的能力较强,但数量较少(约每条虫体含3×103个),且仅在部分天牛个体中分离到,没有纤维素分解菌的天牛,并不影响其消化纤维素的能力和生长发育。以该菌培养产生的纤维素酶热稳定性大大高于天牛纤维素酶,70℃处理2 h,仍可保持60%以上的残存酶活1),显示本研究纯化出的EG酶适合动物肠道反应环境,是内源性酶。
1) 曹月青.桑粒肩天牛幼虫纤维素酶的分布、来源及分离纯化.重庆:西南农业大学植保系,2000
在EG-1酶凝胶制备电泳纯化过程中,酶在凝胶上的准确定位是重要的一步。前人的研究中通常采用等电聚焦电泳,将CMC-Na加入凝胶,电泳后染色,确定目标蛋白质在凝胶上的准确位置。尽管CMC-Na是水溶性纤维素,但因其分子量较大,在聚丙烯酰胺凝胶中分散较差,染色效果常常不好;同时由于两性电解质pH范围的限制,等电点偏酸、偏碱的蛋白质分离效果都不好,本研究中采用了非变性聚丙烯酰胺凝胶电泳,电泳结束后将凝胶紧贴在含CMC-Na的底物平板上反应显色,既消除了pH的限制,保持了EG酶的活性,又能在底物平板上显示EG酶的原始谱带位置,是EG酶纯化及在凝胶上定位的一种较为理想的方法。
天牛是少数能自身分泌纤维素酶消化食物中纤维素成分的动物类群之一。天牛能蛀入树木内取食木质纤维,其纤维素酶在天牛肠道中能稳定有效地作用于食物中的纤维素成分,对天牛的正常生理代谢起着重要作用,有望成为天牛防治新的分子靶标。对天牛纤维素酶的研究,将为从消化机理入手的新型害虫防治策略提供理论基础。同时天牛纤维素酶有可能成为一种新的酶资源和基因资源,为提高动物的食物利用率服务。
曹月青, 殷幼平, 董亚敏, 等. 2001. 桑粒肩天牛肠道纤维素分解细菌的分离和鉴定. 微生物通报, 28(1): 8-11. |
崔福锦, 那安, 马建华. 1984. 不同真菌纤维素酶一些生物化学性质的比较. 真菌学报, 3(1): 59-64. |
何忠效, 张树政. 1990. 电泳. 北京: 科学出版社.
|
蒋书楠, 殷幼平, 王中康. 1996. 几种天牛纤维素酶的来源. 林业科学, 32(5): 442-446. |
莽克强, 徐乃正. 1975. 聚丙烯酰胺凝胶电泳. 北京: 中国科学出版社.
|
殷幼平, 曹月青, 何正波, 等. 2000. 桑粒肩天牛三种纤维素酶的分布与来源. 林业科学, 36(6): 82-85. DOI:10.3321/j.issn:1001-7488.2000.06.013 |
Bartley T D, Kathleen M, Douglas E E. 1984. A method for the detection and differentiation of cellulase components in polyacrylamide gel. Analytical Biochemistry, 140: 157-161. DOI:10.1016/0003-2697(84)90147-7 |
Braford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding Aral. Biochem, 72: 248-254. |
Breznak J A. 1994. Role of microorganisms in the digestion of lignocellulose by termites. Annu Rev Entomol, 39: 453-487. DOI:10.1146/annurev.en.39.010194.002321 |
Inoue T, Murashima K, Azuma J I, et al. 1997. Cellulose and xylan utilisation in the lower termite rericulitermes speratusa. J Insect Physiol, 43: 235-242. DOI:10.1016/S0022-1910(96)00097-2 |
Itakura S, Akio E, Tanaka H. 1998. Partial purification of cellulase from Coptotermes formosanus Shiraki and characterization of hydrolysis products from crystalline cellulose by the cellulases. Jpn J Environ Entomol Zool, 9: 148-157. |
Martin M M. 1983. Cellulose digestion in insects. Comp Biochem Physiol, 75A(3): 313-324. |
Scrivener A M, Slaytor M, Rose H A. 1989. Symbiont-independent digestion of cellulose and starch in Panesthia cribrata saussure, an australian wood-eating cockroach. J Insect Physiol, 35(12): 935-941. DOI:10.1016/0022-1910(89)90016-4 |
Williams J, Villaroya H, Petek F. 1978. α-glucosidase Ⅱ, Ⅲ and Ⅳ from seeds of Trifolium repens. Biochem J, 175: 1069-1077. DOI:10.1042/bj1751069 |
 2004, Vol. 40
2004, Vol. 40