文章信息
- 贺伟, 尹伟伦, 沈瑞祥, 王晓军.
- He Wei, Yin Weilun, Shen Ruixiang, Wang Xiaojun.
- 板栗实腐病潜伏侵染和发病机理的研究
- Latent Infection of Fungal Pathogens and Pathogenesis of Chinese Chestnut Seed Rot
- 林业科学, 2004, 40(2): 96-102.
- Scientia Silvae Sinicae, 2004, 40(2): 96-102.
-
文章历史
- 收稿日期:2003-04-09
-
作者相关文章
2. 北京市怀柔区渤海镇林业站 北京 101405
2. Forestry Station of Bohai Town, Huairou District Beijing 101405
板栗(Castanea mollissima)实腐病是在栗树生长季节侵染、贮运期发病的一种潜伏侵染病害(陈延熙等,1991)。在较好的常规贮藏条件下, 栗实腐病的损失约为10%左右, 而贮藏不当时,损失率可达50%(梅汝鸿等, 1991)。在北京地区, 板栗实腐病的病原菌有胶孢炭疽菌(Colletotrichum gloeosporioides), 聚生小穴壳菌(Dothiorella gregaria),腐皮镰孢菌(Fusarium solani), 拟茎点菌(Phomopsis sp.)和匐枝根霉(Rhizopus stolonifer)(贺伟等,2001)。病菌在板栗雌花受粉期以后开始侵入花柱和栗苞外壳,侵入后处于潜伏状态,采后贮藏中陆续发病,但引起板栗实腐病菌潜伏侵染的机理不清楚。对于潜伏侵染的研究大多以热带、亚热带果树的炭疽病和灰霉病为对象,很少有对种子病害潜伏侵染的研究。Sindair (1991)提到病原真菌Colletotrichum truncatum和Phomopsis spp.在大豆植株和种子上潜伏侵染的情况。病菌侵入大豆植株和种子后不表现症状,直到植株受到环境胁迫或植株成熟时才发病。
以往对板栗实腐病发生的机理也很少研究。一般认为板栗采收时含水量高,种子代谢活跃,气温较高,有利于病菌的活动,而病菌的侵染导致病害的发生(赵学平等,2000)。梅汝鸿等(1991)认为,由于板栗实腐病的病菌于生长期已侵入栗果组织,呈潜伏状态,采后随着栗果失水引起病害发生。上述研究都注意到水分对病害发生的影响,但对其原因却缺少深入的分析。
研究栗实腐病菌潜伏侵染和病害发生的机理,可以对病原物与寄主相互作用的实质加深理解,也可根据病原菌潜伏侵染和发病的性质在病害防治中加以利用。潜伏侵染的机理可能涉及到多个方面,本文仅从果实采收前不同发育阶段酚类物质和某些营养成分的变化以及离体条件下酚类物质对病原菌菌丝体生长的影响等,探讨酚类物质在栗实腐病菌潜伏侵染中的作用。在病害发生机理的研究中,着重分析了种子失水过程中的生理变化和对病害发生的影响,试图说明失水诱发病害的原因。
1 材料和方法 1.1 试验材料测试样品取自北京怀柔沙峪试验地,板栗品种为“怀黄”。在同一林地选取树龄为15 a,长势一致的10株树为样树。
1.2 测定方法 1.2.1 栗果不同部位带病菌率和发病率的测定从果实发育期开始到栗果成熟,每隔20 d左右,摘取栗果,每次采栗果35个以上,重复3次, 带回试验室,用常规组织分离法分离栗果不同部位组织,统计带病菌率。同时用刀剖开栗果观察,组织出现明显变色的,记为发病;板栗采收后,按生产常规方法进行沙藏,从沙藏开始到结束,每隔30 d~50 d取样, 每次取100粒以上的种子, 重复3次, 进行组织分离和发病率测定。
1.2.2 栗果子叶中可溶性糖、淀粉和单宁含量的测定在采集栗果进行组织分离的同时,从栗果中取子叶用于几种物质的测定。将材料称重,装入封口小塑料袋,液氮冷冻,然后在-20℃下保存待测。可溶性糖的测定用蒽酮比色法(袁晓华等,1983);淀粉的测定用碘量法,单宁的测定用滴定法(韩雅珊,1992)。
1.2.3 栗果组织中酚类物质含量和酚类物质对病原菌菌丝体生长影响的测定参考李焕秀等(1994)的方法,取栗果组织进行研磨浸提, 计算酚类物质的含量。
在PDA培养基中加入酚类物质,使培养基含有不同浓度的酚类物质。用直径0.5 cm的打孔器从培养一周的4种病原菌菌落上切取菌碟,置于含酚培养基上,对照是将菌碟置于不加酚类物质的PDA上。在25℃下培养,每种处理重复3次,测量平均菌落直径。
1.2.4 栗果采收后失水对栗实腐病和种子生活力的影响种子采收后即进行组织分离,测定潜伏侵染带菌率。潜伏侵染带菌率为出现病菌菌落的粒数与分离粒数之比。板栗种子在2℃下冷藏,解除休眠后,在下述的温湿度条件下, 使种子失水, 诱使潜伏在种子内的病菌恢复活动导致病害(即诱发试验)。取10 kg种子, 从中随机取150 g测定种子含水量, 作为未失水种子的含水量, 其余种子用100倍的氯胺T溶液浸泡5 min,用清水冲洗干净,晾干表面水分,置于13~18℃、相对湿度为60%~78%的培养箱中单层摆放使种子失水,每隔3 d随机取150 g种子, 测定种子的含水量、失水率(WLR),并从经干燥失水的种子中随机抽取100粒种子剖果检查发病率, 重复2次。
WLR=[(MCBWL-MCAWL)/MCBWL]×100%, 其中MCBWL:失水前含水量;MCAWL:失水后含水量。
种子生活力以种子发芽指数和发芽率表示,其测定按颜启传(1992)的方法进行。
1.2.5 种子失水过程中有关生理指标变化的测定种子浸泡液的相对电导率按Zheng(1988)的方法,用DDS-11A型电导率仪测定。超氧物岐化酶(SOD)活性的检测,按朱广廉(1990)的方法。过氧化物酶(POD)活性、淀粉酶活性、过氧化氢酶(CAT)活性的测定,均用韩雅珊(1992)的方法。丙二醛(Malondialdehyde MDA)含量的测定,按照赵世杰等(1991)的方法进行。
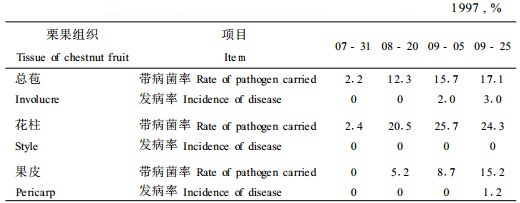
2 结果与分析 2.1 栗果发育过程中不同组织带病菌率和发病率从表 1可看出,各组织的带病菌率(组织中含前述5种病原菌中的1种或几种的比率)随栗果发育而增加,其中总苞和花柱的带病菌率在9月5日接近或达到高峰,果皮中的带病菌率则在9月25日达到高峰值。同期以花柱和总苞带病菌率较高,果皮较低。而在分离时这些组织的表面在早期都无症状出现,只是在近成熟期,总苞表面出现2%的发病率,采收时(9月25日)总苞和果皮均出现低发病率, 这说明在生长期栗果组织带菌是普遍的,但只有少数表现症状。表现为明显的潜伏侵染现象。
|
|
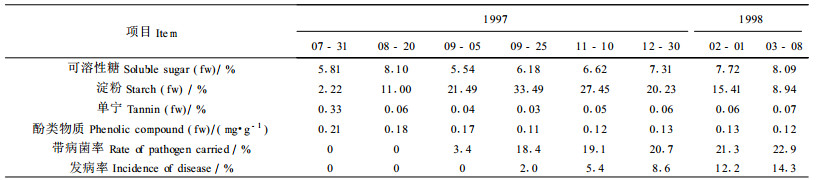
从表 2可以看出,栗果发育过程中,子叶中的可溶性糖含量先升高,然后下降,到9月25日成熟时又有所上升,呈现波动的情况。采收后随贮藏时间延长, 可溶性糖含量不断上升,冷藏到翌年3月8日,可溶性糖的含量较9月25日采收时增高30.91%。淀粉在7月底子叶发育前期含量很低,仅为子叶鲜重的2.22%,8月下旬以后淀粉积累迅速增加,到采收时达33.49%。高浓度的淀粉有利于胶孢炭疽菌孢子萌发和附着胞的形成,而不利于菌丝体的生长(刘秀娟等, 1995)。采收后在贮藏过程中,由于呼吸作用及淀粉水解加强,淀粉含量不断下降,到3月8日,淀粉含量仅为采收时的26.69%。单宁的含量在7月底为0.33%, 以后则明显下降,但采收以后基本保持在采收时的水平。酚类物质的含量在栗果发育过程中呈下降趋势, 采后维持在采收时的水平。
|
|
板栗子叶发育初期未分离到病原菌,直到成熟前20 d才有3.4%的带病菌率,至成熟期子叶带病菌率明显增加。虽然采收时子叶中带病菌率已达18.4%,但发病率仅为2.0%,经贮藏后子叶带菌率略有增加,而发病率则明显上升。发病率的增加与栗果采收后可溶性糖含量的增加呈正相关,而与淀粉含量呈负相关。从上述测定的结果可以看出,病原菌首先侵入总苞、花柱等外围组织,在近成熟期进入子叶(表 1和表 2)。此时子叶中淀粉含量较高,不利于病菌菌丝体的生长。采收前,子叶处于种皮、果皮和总苞组织的包裹之中。这些部位抑菌物质的存在可能对子叶中的病菌产生影响。
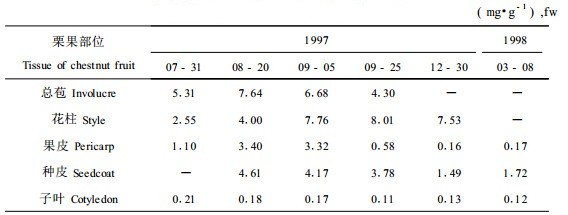
2.3 栗果组织酚类物质的含量变化和酚类物质对病菌菌丝生长的影响 2.3.1 栗果发育及贮藏过程中不同组织酚类物质的含量变化表 3显示, 果实发育初期,总苞中就含有较多的酚类物质,8月下旬含量增加,以后则逐渐减少。在花柱中,栗果发育初期,酚类物质含量较低,以后逐渐升高,近成熟时稳定在较高水平。果皮的情况与花柱类似,但在种子成熟时,含量迅速下降,由9月5日的3.32 mg·g-1(鲜重), 下降到9月25日的0.58 mg·g-1(鲜重)。种皮和种仁中酚类物质的含量也随种子发育成熟呈下降趋势。其中果皮和种皮中酚类物质的含量从采收后经3个月贮藏进一步下降。从栗果各部位的含量来看,同一测定时间,总苞和花柱中的含量最高,种皮和果皮次之,种仁含量最低。
|
|
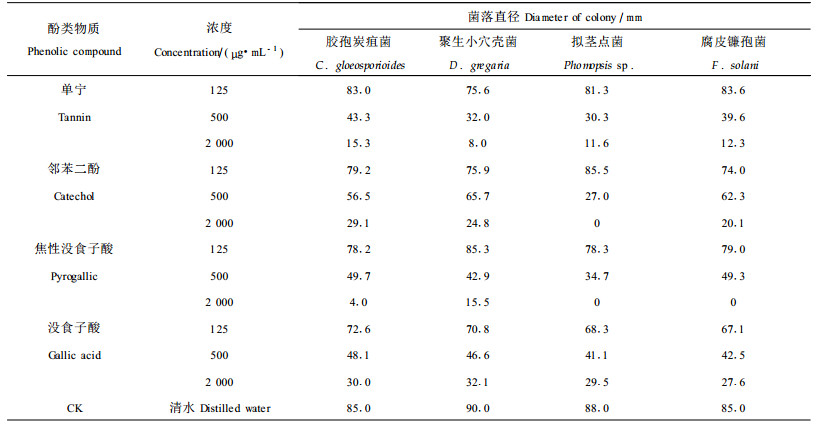
表 4说明了酚类物质对4种病菌的菌丝体生长的抑制作用。在试验浓度范围内,有随浓度的提高而增强的趋势,一般在500 μg·mL-1即产生明显抑制作用。其中以焦性没食子酸的抑制作用最强,在2 000 μg·mL-1的浓度下,便可完全抑制Phomopsis sp.和F. solani菌丝体的生长。邻苯二酚在2 000 μg·mL-1的浓度下,也可完全抑制Phomopsis sp.菌丝体的生长。单宁在2 000 μg·mL-1的浓度下,对4种病菌菌丝体生长的抑制作用也较强。没食子酸对菌丝体的抑制作用相对较弱。
|
|
综合上述几项测定的结果,以及栗实腐病在采收前后的带菌和发病情况,可以认为板栗实腐病菌的潜伏侵染与栗果组织中酚类物质的含量有关。根据定期分离栗果组织中病原菌的材料,病原菌在雌花受粉后侵入花柱和幼嫩栗苞组织,此后侵入的数量虽有所增加,但都局限在花柱、栗苞和果皮中,在近成熟期才进入子叶(表 2)。分析表明,生长期在花柱、种皮、果皮和总苞中酚类物质的含量已超过离体条件下抑制菌丝生长的浓度(表 3)。因此,栗果采收前受组织中较高浓度的酚类物质的影响,病原菌菌丝的扩展受到抑制, 病菌处于潜伏状态。
2.4 栗果采收后失水对种子生活力和病害发生的影响 2.4.1 失水对种子生活力的影响从表 5中可以看出, 种子失水过程中,种子发芽率和发芽指数随种子含水量的下降而逐渐降低。当含水量由51.5%减少到46.1%,发芽率仍为100%,但发芽指数由14.37下降到8.82,降低了38.8%;含水量从46.1%减少到42.5%,仅丧失了3.6%的水分,但发芽率和发芽指数却分别下降了22%和41.2%。说明板栗种子对水分丧失高度敏感,同时也说明,在种子含水量较高的情况下,发芽指数的变化比发芽率灵敏得多。在含水量为31.4%时,种子发芽率仅2%,生活力基本丧失。
|
|
正常型种子在成熟后经过失水干燥在含水量降到5%~6%才适于贮藏,种子含水量如超过10%~13%,往往出现产热,真菌感染从而降低或损害种子的发芽力。板栗属于顽拗型种子,采收时代谢活跃,呼吸速率高,胚轴的细胞器和膜系统完整,类似萌发状态(郑郁善,1998)。此时失水,将使种子因得不到足以维持萌发所需的水分而对干燥敏感。种子的生活力与水分含量呈正相关,失水会降低种子的生活力,从而减弱了种子的抗病力。
2.4.2 种子失水程度与病害发生的关系从表 6可看出,随着种子失水干燥,含水量下降到45.8%时,出现了5%的发病粒,含水量进一步下降,使发病率也不断增加,当含水量为39.0%时,发病率为26%;继续失水, 发病率则不再增加。由分离试验得知供试种子的带病菌率为25%(表中未列出),种子含水量为39.0%时诱发试验所得发病率与带病菌率相近,表明在此含水量时,为种子内所有病菌的发病创造了条件。若将种子含水量对种子发芽率和发芽指数的影响的关系(表 5),与种子含水量和发病率的关系(表 6)加以比较,可以看出,当种子失水10%左右时,生活力开始下降,潜伏在种子内的病菌恢复侵染活动,引起病害。由此证明,成熟板栗品种“怀黄"种子失水10%左右时的含水量是诱导病害发生的临界含水量。
|
|
从表 7可以看出,随种子含水量的减少,其浸泡液的相对电导率增加,种子含水量与相对电导率两者之间呈负相关。电导率的增加表明细胞膜受到损伤。这也是种子生活力下降的原因之一。
|
|
随着种子含水量的下降,种仁中可溶性糖含量明显增加,而淀粉含量则逐渐减少。当含水量从51.2%下降到31.2%时,可溶性糖含量由11.2%增加到23.52%,增加了1.1倍;淀粉含量则由64.30%减少到48.43%,下降了24.7%。当种子含水量由51.2%下降到47.7%时,淀粉酶活性有所上升,这可能是组织少量失水后,使酶浓度加大,引起酶活性增高。以后随含水量减少淀粉酶活性下降。淀粉含量的减少和可溶性糖含量的增加,表明板栗种子在失水的过程中,在淀粉酶的作用下发生淀粉向可溶性糖的转化,这种情况为潜伏在种子内的病原菌提供了养分,促使病害发生。
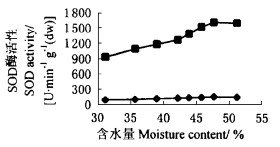
2.5.2 种子失水过程中几种酶活性的变化从图 1可以看出,板栗种子子叶和胚轴中SOD活性基本上均随种子含水量的减少而降低,规律是先略有上升,然后下降。当种子生活力基本丧失时,即种子含水量为31.2%时,子叶和胚轴中SOD的活性与种子未失水时相比,分别下降了38.3%和40.7%。胚轴中SOD酶活性大大高于同期子叶中的酶活性。
|
图 1 种子失水过程中子叶和胚轴SOD活性的变化 Fig. 1 Variation of SOD activity in cotyledon and embryonic axes in seed dehydration process —◆—子叶Cotyledon —■—胚轴Embryonic axes |
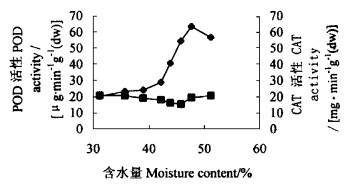
图 2显示,在种子含水量由51.2%下降到47.7%时,子叶中POD活性有所上升,而含水量进一步下降时,POD的活性则不断下降。含水量从51.2%下降至31.2%时,POD活性下降了1.8倍。在含水量较高时,SOD、POD的活性保持在较高的水平,对于保护细胞膜不受自由基的伤害起重要作用。但随着含水量的减少,SOD、POD的活性下降, 膜受到自由基的伤害, 种子生活力降低。表明这2种酶的活性与种子生活力密切相关。CAT活性随含水量减少,先出现下降,当含水量减少到43.9%以后,则随含水量下降而呈上升趋势。
|
图 2 种子失水过程中子叶POD和CAT活性的变化 Fig. 2 Variation of POD and CAT activity in cotyledon in seed dehydration process —◆—POD活性POD activity —■—CAT活性CAT activity |
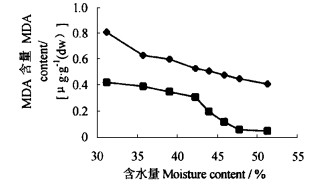
图 3显示了板栗种子失水过程中子叶和胚轴中MDA的变化情况。在同一含水量条件下,子叶中的MDA含量较胚轴为高。随含水量下降,子叶和胚轴中的MDA的含量逐渐上升。未失水时子叶中的MDA含量为0.41 μg·g-1,含水量下降至31.2%时,MDA含量达到0.81 μg·g-1,增加了近1倍。胚轴中MDA含量变化幅度更大,从种子含水量51.2%到31.2%,其含量增加了7.4倍。从上面的分析中可以看出,板栗种子在脱水过程中,伴随着细胞膜上脂肪酸的强烈氧化作用,损伤了膜的功能,所以膜脂过氧化作用是种子生活力下降的重要原因。
|
图 3 种子失水过程中子叶和胚轴MDA含量的变化 Fig. 3 Variation of MDA content in cotyledon and embryonic axes in seed dehydration process —◆—子叶Cotyledon —■—胚轴Embryonic axes |
在离体条件下,几种酚类物质在低于栗果组织中酚类物质的含量时,对病菌菌丝体生长有明显抑制作用。发育期栗果花柱、总苞、果皮和种皮中酚类物质含量均超过抑制病原菌菌丝扩展的水平,因此,板栗采收前栗实腐病菌的侵染被抑与栗果组织中酚类物质的含量有关。
贮藏过程中,板栗种子随含水量降低,种子发芽指数下降,脂质过氧化物含量增加,细胞膜透性增大;种子失水超过10%时,发芽率开始下降,超氧物歧化酶(SOD)和过氧化物酶(POD)活性明显下降。含水量下降到大约30%时,种子生活力基本丧失。板栗种子对脱水敏感,与失水过程中种子膜脂过氧化作用加强,细胞膜透性增大有关。成熟种子失水10%左右时的含水量,是病害发生的临界值。病害发生的临界含水量与种子生活力开始下降时的含水量相近,表明种子失水降低了种子的抗病力。随着淀粉水解,可溶性糖含量增加,病原菌解除潜伏,导致发病。
潜伏侵染可能涉及多种机制,本文仅从栗果某些营养物质及酚类物质的变化探讨了栗实腐病病原菌潜伏侵染问题。酚类物质可能通过抑制病原菌致病因子的活性在病原菌的潜伏侵染中起作用。存在于鳄儿梨果皮上的表儿茶酸的含量与对由胶孢炭疽菌产生的果胶酶的抑制有着密切联系(Wattad et al., 1994)。抑制它们的活性,可使病原菌处在被抑状态。酚类物质对板栗实腐病菌与致病有关的酶类的影响,有待研究。
据报道,引起栗实腐病的病原菌中,Dothiorella ribis能分泌淀粉酶和纤维素酶(易润华等, 2000);C. gloeosporioides可分泌多聚半乳糖醛酸酶(PG)和果胶酸盐裂解酶(PL)(Prusky et al., 1989); R. stolonifer侵染甜瓜时菌丝分泌大量果胶甲酯酶(PME)、PG和果胶甲基半乳糖醛酸酶(PMG);与Fusarium solani同属的F. semitectum则分泌PME、纤维素酶(Cellulase)(陈尚武等, 1998)。这些酶在上述病原物致病过程中都起着重要作用。由于在高相对湿度下真菌分泌的酶的产生受到抑制并被钝化,失水可能引发或加强了致病因素的作用。研究这些酶产生的条件及其在致病过程中的作用机制,将为进一步揭示栗实腐病发病机理提供资料。由于栗实腐病病菌种类多,进一步研究种子含水量对各种类致病性的影响,以及这些种类在发病中的相互作用,对于揭示水分在栗实腐病发病过程中的作用有重要意义。
陈尚武, 张大鹏, 张维一. 1998. 匍枝根霉和半裸镰刀菌侵染甜瓜果实产生的胞壁降解酶与侵染方式. 植物病理学报, 28(1): 55-60. DOI:10.3321/j.issn:0412-0914.1998.01.014 |
陈延熙, 梅汝鸿, 鲁素芸, 等. 1991. 板栗干腐病研究: Ⅰ.树体及果实中真菌区系分析. 中国微生态学杂志, 3(1): 69-74. |
韩雅珊主编.食品化学实验指导.北京: 中国农业大学出版社, 1992
|
贺伟, 沈瑞祥, 王晓军. 2001. 北京地区板栗实腐病病原菌的致病性及侵染过程. 北京林业大学学报, 23(2): 36-39. DOI:10.3321/j.issn:1000-1522.2001.02.009 |
李焕秀, 王乔春, 李春秀. 1994. 梨芽和茎尖多酚氧化酶活性和总酚含量的初步研究. 四川农业大学学报, 2(2): 218-222. |
刘秀娟, 黄圣明, 杨业铜, 等. 1995. 酚类物质对两种潜伏炭疽菌生长和繁殖的影响. 真菌学报, 14(4): 277-282. |
梅汝鸿, 曹玉信, 李亚男. 1991. 板栗干腐病诱病因素的研究之四. 中国微生态学杂志, 3(3): 42-45. |
颜启传. 1992. 种子检验的原理和技术. 北京: 农业出版社.
|
易润华, 吴光金. 2000. 板栗腐烂机理及防腐保鲜技术的研究. 中南林学院学报, 20(2): 44-50. DOI:10.3969/j.issn.1673-923X.2000.02.004 |
袁晓华, 杨中汉. 1983. 植物生理生化实验. 北京: 高等教育出版社.
|
赵世杰, 许长城, 邹琦, 等. 1991. 植物组织中丙二醛测定方法的改进. 植物生理学通讯, 30(3): 207-210. |
赵学平, 贝亚维, 王强, 等. 2000. 板栗贮藏期病害发生规律研究. 植物保护, 26(4): 29-31. DOI:10.3969/j.issn.0529-1542.2000.04.012 |
郑郁善. 1998. 板栗和锥栗种子发育过程中ABA生理效应的研究. 林业科学, 34(4): 1-7. DOI:10.3321/j.issn:1001-7488.1998.04.001 |
朱广廉. 1990. 植物生理学实验. 北京: 北京大学出版社.
|
Prusky D, Gold S, Keen N T. 1989. Purification and characterization of an endopolygalacturonase produced by Colletotrichum gloeosporioides. Physiol Mol Plant Pathol, 35: 121-133. DOI:10.1016/0885-5765(89)90082-9 |
Sindair J B. 1991. Latent infection of soybean plants and seeds by fungi. Plant Disease, 75(3): 220-224. DOI:10.1094/PD-75-0220 |
Wattad C, Dinoor A, Prusky D. 1994. Purification of pectate lyase produced by Colletotrichum gloeosporioides and its inhibition by epicatechin: a possible factor involved in the resistance of unripe avocado fruits to anthracnose. Mol Plant Microbe Interact, 7: 293-297. DOI:10.1094/MPMI-7-0293 |
Zheng G H. 1988. Studies on the imbibitional chilling injury and the reparation of damaged membrane systems in soybean seed. Scientia Sinica (series B), 31(8): 936-943. |
 2004, Vol. 40
2004, Vol. 40