文章信息
- 陶月良, 朱诚.
- Tao Yueliang, Zhu Cheng.
- 板栗种子成熟前后脱水敏感性与蛋白质、可溶性糖的关系
- Relationship among Desiccation-tolerance, Proteins and Soluble Sugars before and after Maturation of Castanea mollissima Seeds
- 林业科学, 2004, 40(2): 45-50.
- Scientia Silvae Sinicae, 2004, 40(2): 45-50.
-
文章历史
- 收稿日期:2002-07-19
-
作者相关文章
2. 浙江大学生命科学学院 杭州 310029
2. College of Life Sciences, Zhejiang University Hangzhou 310029
Roberts (1973)根据种子的贮藏行为把种子分为正常性种子(orthodox seeds)和顽拗性种子(recalcitrant seeds)。顽拗性种子在整个发育过程中一直保持较高的含水量和较旺盛的代谢活性,不经过成熟脱水期,在整个发育期间及脱落后对脱水敏感(Farrant et al., 1986)。这类种子大多具有较高的经济价值,对它们的研究也越来越受到重视。近年来,已开始从胚或胚轴脱水保护物质如热稳定蛋白、胚胎发生后期富集蛋白(LEA)和可溶性糖类等方面探讨顽拗性种子脱水敏感性的机制(Blackman et al., 1991; Obendorf, 1997)。非还原性糖对种子的耐脱水力具重要作用(Blackman et al., 1992; Pammenter et al., 1999)。起源于热带的黄皮(Clausena lansium)种子发育后期没有类似正常性种子LEA的合成(姜孝成等, 1997),姜孝成等(1998)认为可溶性糖含量可能与黄皮种子脱水敏感性的大小有一定联系。板栗(Castanea mollissima)是起源于温带的果树,为我国所特有,在采收时开始有萌发力(郑郁善, 1998),为典型的顽拗性种子(傅家瑞, 1991)。本文研究了板栗种子成熟前后含水量、耐脱水力、子叶α-淀粉酶和异柠檬酸裂解酶活性、子叶和胚轴的可溶性糖及其组分以及可溶性蛋白和热稳定蛋白的变化,探讨板栗种子脱水敏感性与蛋白质、可溶性糖的关系。
1 材料与方法 1.1 材料试验板栗为“永荆5号”早熟品种,取自温州永嘉县,自花后75d开始,在75d、90d、105d分别采样。花后90d时总苞开裂、种子脱落,脱落后沙藏至105d,沙的湿度以能捏成团为准。挑选发育良好、大小均一的种子立即做试验或投入液氮速冻后贮于-20℃冰柜中备用。
1.2 含水量测定和种子萌发试验含水量按照Chin等(1989)的方法,将胚轴和切成1mm厚的子叶薄片放在101~105℃烘箱中烘至恒重,以鲜重为基础计算含水量。对剥除果皮和种皮的种子进行消毒,置于WPM(woody plant medium,木本植物培养基)培养基上于25℃的培养箱中萌发,10d后统计发芽率,以发芽率×胚根长度作为简易活力指数。
1.3 α-淀粉酶和异柠檬酸裂解酶活性的测定α-淀粉酶与异柠檬酸裂解酶活性的测定均按黄学林等(1990)方法,用降解淀粉的mg·min-1g-1FW表示α-淀粉酶活性,用ΔOD·mg-1protein h-1表示异柠檬酸裂解酶活性。
1.4 可溶性糖含量测定及组分的鉴定可溶性糖含量的测定按黄学林等(1990)的方法。组分的鉴定用薄板层析法(宁正祥,1998)。展开剂为正丁醇:乙醇:水=10:1:2(体积比),显色剂为酚-硫酸,吸附剂为薄层层析硅胶G60型(中国青岛海洋化工集团公司)。
1.5 可溶性蛋白和热稳定蛋白的提取板栗胚轴和子叶冰冻后按1:8 (w:v)比例加入-20℃冷丙酮研磨成匀浆,在-20℃下过夜沉淀,1 000×g离心。倾去丙酮,再用4倍于沉淀体积的冷丙酮洗涤4次,真空干燥成干粉备用。参照杨晓泉等(1998a)方法,取400mg脱脂粉,加入5.6mL预冷的提取缓冲液:Tris-HCl 50mmol·L-1(pH 8.0)、NaCl 500 mmol·L-1、β-巯基乙醇10 mmol·L-1、苯甲基磺酰氟1 mmol·L-1, 4℃提取2h,20 000×g离心20min(4℃),上清液即为可溶性蛋白;上清液分装后,100℃水浴中煮20min,冰浴中冷却15min,于1 000×g离心10min,上清液即为热稳定蛋白。
1.6 蛋白质含量测定和SDS-PAGE电泳按Bradford (1976)的方法测定蛋白质含量,用牛血清蛋白(上海东风生化试剂厂)作标准曲线。SDS-PAGE按汤章成(1999)的方法。浓缩胶浓度4%,分离胶12%。取一定体积的蛋白质提取液,并按1:1 (v:v)加入样品缓冲液[0.125 mol·L-1 Tris-HCl (pH 6.8), 2% SDS, 20%蔗糖,5% β-巯基乙醇, 0.01%溴酚蓝]。每泳道上样120μg左右。
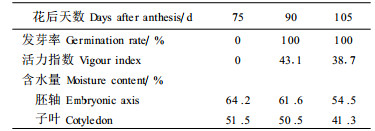
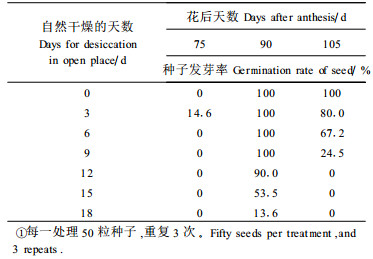
2 结果与分析 2.1 含水量、生活力和脱水敏感性变化板栗种子在成熟前后一直保持较高含水量,且胚轴高于子叶,花后75d子叶和胚轴的含水量分别为51.5%和64.3%。随着种子成熟及沙藏过程中,含水量缓慢下降(表 1),但不经历成熟脱水阶段。其发芽率在种子脱落时达到100%,种子活力也达到最大,随后稍有下降。花后75~90d,轻度脱水可提高种子萌发率,继续脱水则萌发率下降,90d种子脱落时的脱水敏感性较弱,干燥9d(含水量为37.72%)的种子仍保持100%的发芽率。脱落后沙藏期间种子对脱水的敏感性又升高(表 2),期间部分种子已开始发芽。种子的干重于花后90d达最大值,此时应为种子生理成熟期。
|
|
|
|
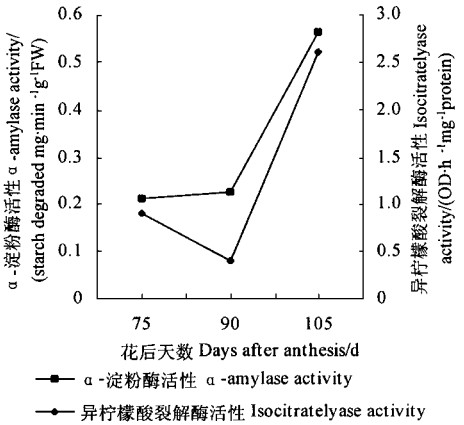
花后75d,板栗种子子叶中就存在一定的α-淀粉酶,其活性在75~90d变化不大,随后急剧上升。异柠檬酸裂解酶在花后75d也已经存在,75~90d酶活性有所下降,成熟后也急剧上升(图 1)。
|
图 1 板栗种子成熟前后α-淀粉酶和异柠檬酸裂解酶活性的变化 Fig. 1 Changes of activities of α-amylase and isocitratelyase before and after maturation of C.mollissima seeds |
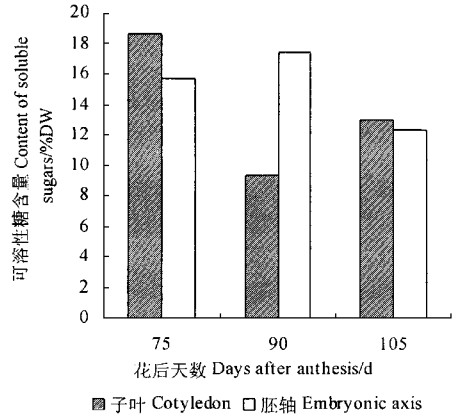
板栗花后75~90d正是种子干重急剧上升的时期(干物质净增加了34%),此期间子叶中可溶性糖含量降低,而胚轴中可溶性糖含量略有上升,这是由于由营养器官转运来的糖类物质在子叶合成大量的淀粉,并向胚轴转运部分可溶性糖的结果;脱落后子叶可溶性糖含量上升,胚轴则下降(图 2),这与种子萌发需消耗大量糖有关。
|
图 2 板栗种子成熟前后可溶性糖含量的变化 Fig. 2 Changes of soluble sugar contents before and after maturation of C.mollissima seeds |
板栗种子成熟前后蔗糖含量最丰富,随成熟推进子叶中逐渐下降,而胚轴中一直保持较高水平;花后75d,子叶中有较高的麦芽糖,至90d降为0,但沙藏期间又明显上升,这一变化与子叶中淀粉的积累和降解有关,而胚轴中则检测不到麦芽糖的存在;子叶和胚轴均含有棉籽糖和水苏糖2种非还原性糖,其含量远低于蔗糖。子叶中棉籽糖和水苏糖的变化与麦芽糖的变化趋势大体相反,成熟期含量逐渐增加,至90d达到高峰,沙藏期逐渐下降,到105d含量为0(图 3)。胚轴中的棉籽糖和水苏糖含量高于子叶,其变化与子叶中相似,90d为最高,随后下降,其中棉籽糖的下降更明显。
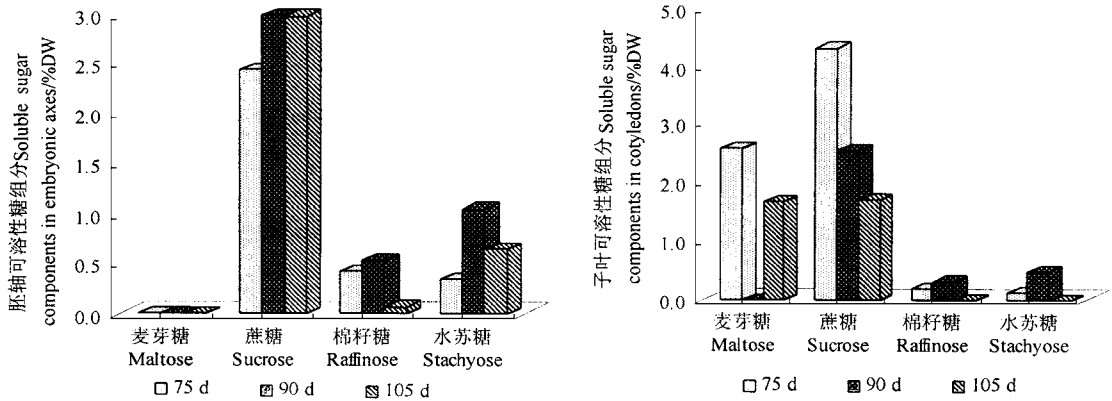
|
图 3 板栗种子成熟前后子叶和胚轴可溶性糖组分的变化 Fig. 3 Changes of soluble sugar components in cotyledons and embryonic axes before and after maturation of C.mollissima seeds |
板栗为淀粉类种子,其蛋白质含量较低,成熟前后子叶的可溶性蛋白仅占干重的0.17%~0.3%。在75~90d种子成熟期间,子叶可溶性蛋白含量上升,沙藏期间下降;胚轴的可溶性蛋白比子叶高,但也只占干重的0.35%~0.5%,75~90d含量下降,90d后又明显上升(图 4),其变化规律与子叶相反。这与种子成熟时蛋白质在子叶中积累和萌发时蛋白质被利用有关。
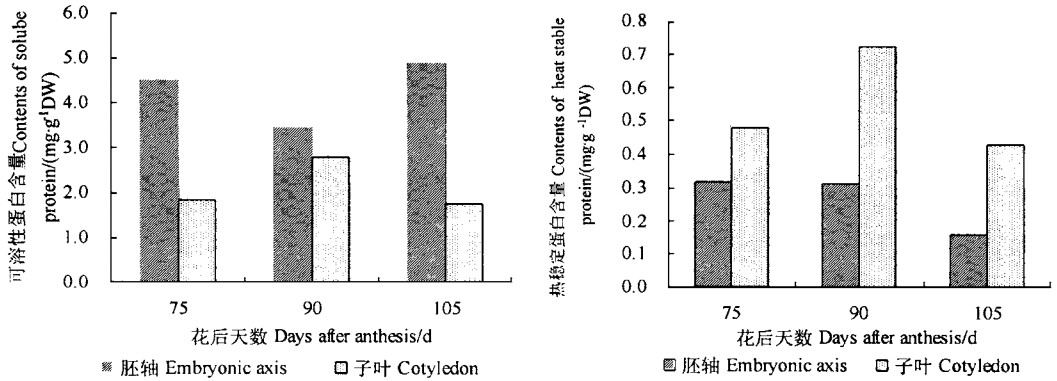
|
图 4 板栗种子成熟前后可溶性蛋白和热稳定蛋白含量的变化 Fig. 4 Changes of soluble protein and heat-stable protein contents in embryonic axes and cotyledons before and after maturation of C.mollissima seeds |
胚轴热稳定蛋白含量在75~90d变化不大,但它占可溶性蛋白的比值由75d的7.2%增至90d的9.0%,沙藏期间含量和比值下降;子叶中热稳定蛋白含量在75~90d上升,沙藏期间又下降(图 4),但占可溶性蛋白的比值基本不变(25%~27%),其比值远高于胚轴。
2.5 板栗种子成熟前后可溶性蛋白和热稳定蛋白的SDS-PAGE胚轴的可溶性蛋白谱带和热稳定蛋白谱带与子叶存在较大差异,胚轴的可溶性蛋白种类比子叶多,分子质量最大的蛋白约65kD,最小的约12kD (图 5),但胚轴和子叶的可溶性蛋白种类在花后75~105d内均无明显变化。热稳定蛋白种类子叶比胚轴多,子叶在75~105d谱带基本相同;胚轴花后75~90d热稳定蛋白谱带基本相同,主要为12、20kD,到105 d仅剩12kD蛋白。
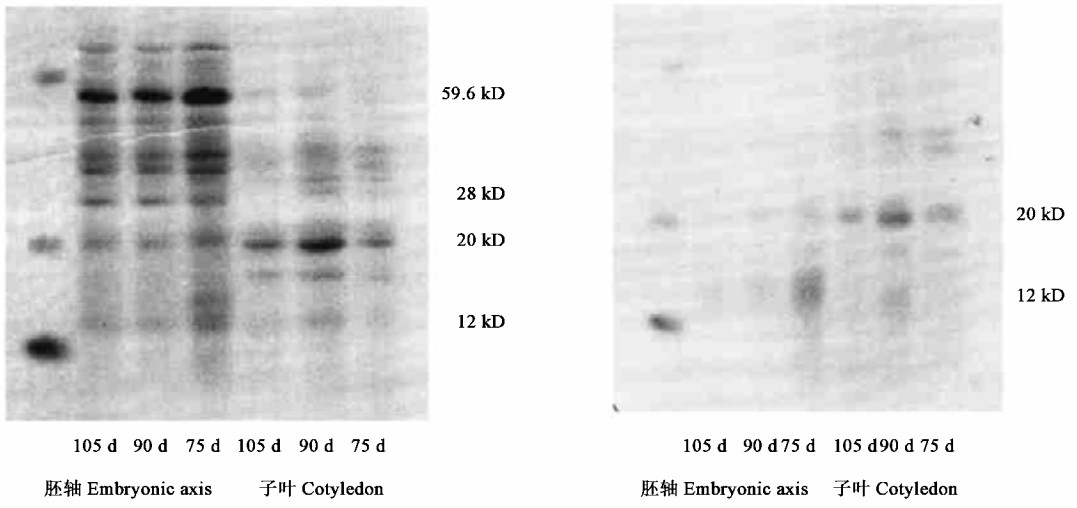
|
图 5 板栗种子成熟前后子叶和胚轴可溶性蛋白和热稳定蛋白的SDS-PAGE Fig. 5 SDS-PAGE of soluble proteins and heat stable proteins in cotyledon and embryonic axis before and after maturation of C.mollissima seeds |
目前认为,顽拗性种子在脱落时或脱落后不久开始萌发(Farrant et al., 1986; Berjack et al., 1984)。刚收获的黄皮种子具有一定的α-淀粉酶和异柠檬酸裂解酶活性,在采收时已开始萌发(宋松泉等,1992)。板栗种子在花后75d就具有一定的α-淀粉酶和异柠檬酸裂解酶活性,90d后活性急剧上升。说明种子在脱落后就开始萌发。
板栗种子在花后75~90d,含水量一直保持在50%~60%之间,发育后期不存在明显的成熟脱水期,表现出典型的顽拗性种子特征(傅家瑞,1991)。未成熟的板栗种子经轻度脱水可提高种子生活力,继续脱水则生活力下降,与荔枝(Litchi chinensis)和龙眼(Dimocarpus longan)种子的表现相似(夏清华等,1992)。生理成熟期的板栗种子(90d)最耐脱水,干燥9d的种子仍保持100%的发芽率,105d时脱水敏感性又上升,这与板栗种子已启动其萌发进程有关。
热稳定蛋白的积累与种子耐脱水性呈正相关(Fu et al., 1997),板栗种子成熟前后具有低分子量热稳定蛋白,其占可溶性蛋白的比值在90d达最高值(9.0%),这与种子脱水敏感性的变化具有相似的发育模式,这种低分子量蛋白(20kD)在黄皮种子发育后期也存在(姜孝成等,1997),但种类比黄皮种子多,它们很可能与板栗种子在脱落时脱水敏感性较弱有关。
此外,非还原性糖和脱水耐性有密切关系(Koster et al., 1988)。糖中的羟基替代膜、蛋白质分子中的水分,在脱水时可稳定膜、蛋白质的结构(Leprince et al., 1993; Crowe et al., 1992),增加蛋白质的热稳定性(杨晓泉等, 1998b)。而还原性糖如麦芽糖能促进Mailland反应产物形成,导致蛋白质的变性(Sun et al., 1994)。板栗种子发育过程中积累大量可溶性糖,其中包括与正常性种子耐脱水性有关的蔗糖、棉籽糖和水苏糖等非还原性糖(Blackman et al., 1992),但该种子成熟后不耐脱水,因此可溶性糖并不是决定种子是否具有耐脱水性的唯一因子,但可溶性糖的组分及含量可能与板栗种子脱水敏感性大小有关。板栗种子成熟前淀粉的大量积累以及脱落后随即开始的萌发过程,造成作为碳源物质的蔗糖在子叶内下降和在胚轴内上升。而非还原性糖棉籽糖和水苏糖的含量上升以及脱落后的下降与种子脱水敏感性的变化极其一致,麦芽糖含量的变化与种子脱水敏感性的变化趋势相反。研究还发现,板栗种子成熟过程中相对电导率和紫外吸收值下降,而成熟后(90~105d)上升。因此,棉籽糖和水苏糖可能通过增加蛋白质的热稳定性来提高热稳定蛋白的积累,并(或)通过增加膜的稳定性使板栗种子在成熟时具有较弱的脱水敏感性。
板栗种子的子叶和胚轴在成熟前后其热稳定蛋白的含量和种类均比黄皮等热带顽拗性种子多,且子叶和胚轴的热稳定蛋白占可溶性蛋白的比值也明显高于黄皮等热带顽拗性种子(姜孝成等,1997)。Lin等(1990)认为热稳定蛋白对植物耐低温有重要作用。热带顽拗性种子对低温敏感,板栗种子作为温带顽拗性种子,对低温不敏感(傅家瑞, 1991),因此板栗种子具有较多低分子量热稳定蛋白和较高热稳定蛋白水平可能与它对低温不敏感有关。
傅家瑞. 1991. 顽拗性种子. 植物生理学通讯, 27(6): 402-406. |
黄学林, 陈润政编. 种子生理实验手册. 北京: 农业出版社, 1990: 110-122
|
姜孝成, 杨晓泉, 傅家瑞. 1997. 脱水敏感的黄皮种子在发育过程中可溶性蛋白的变化. 植物生理学报, 23(4): 324-330. DOI:10.3321/j.issn:1671-3877.1997.04.003 |
姜孝成, 杨晓泉, 傅家瑞. 1998. 脱水敏感的黄皮种子在发育过程中的碳水化合物变化研究. 种子, 95(3): 1-4. |
宁正祥. 1998. 食品成分分析手册. 北京: 中国轻工业出版社, 9-12.
|
宋松泉, 傅家瑞. 1992. 黄皮种子脱水敏感性与萌发事件的研究. 华南植物学报, 试刊Ⅰ: 48-52. |
汤章城. 1999. 现代植物生理学实验指南. 北京: 科学出版社, 394-396.
|
夏清华, 陈润政, 傅家瑞. 1992. 荔枝和龙眼种子胚轴的脱水及贮存. 华南植物学报, 试刊Ⅰ: 40-47. |
杨晓泉, 姜孝成, 傅家瑞. 1998a. 花生种子耐脱水力的获得与热稳定蛋白的关系. 植物学报, 40(4): 337-342. |
杨晓泉, 姜孝成, 傅家瑞. 1998b. 花生种子耐脱水力的形成与可溶性糖累积的关系. 植物生理学报, 24(2): 165-170. |
郑郁善. 1998. 板栗和锥栗种子发育过程中ABA生理效应的研究. 林业科学, 34(4): 1-6. DOI:10.3321/j.issn:1001-7488.1998.04.001 |
Berjack P, Dini M, Pammenter N W. 1984. Possible mechanisms underlying the differing dehydration responses in recalcitrant and orthodox seeds: desiccation-associated subcellular changes in propagules of Avicennia marina. Seed Sci and technol, 12: 365-371. |
Blackman S A, Wettlaufer S H, Obendorf R F, et al. 1991. Maturation proteins associated with desiccation tolerance in soybean. Plant Physiol, 96: 868-874. DOI:10.1104/pp.96.3.868 |
Blackman S A, Obendorf R L, Leopold A C. 1992. Maturation proteins and sugars in desiccation tolerance of developing soybean seeds. Plant Physiol, 100: 225-230. DOI:10.1104/pp.100.1.225 |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Chin H F, Kirshnapillay B, Stanwood P C. Seed moisture: recalcitrant vs orthodox seed. In: Stanwood P C, McDonald M B(eds). Seed Moisture. CSSA special publication NO. 14, USA, 1989: 15-22
|
Crowe J H, Hoekstra F A, Crowe L M. 1992. Anhydrobiosis. Annual Review of Physiology, 54: 579-599. DOI:10.1146/annurev.ph.54.030192.003051 |
Farrant J M, Pammenter N W, Berjak P. 1986. Germination-associated events and the desiccation sensitivity of recalcitrant seed—a study on three unrelated species. Planta, 178: 189-198. |
Fu J R, Jiang X C, Yang X Q et al. Heat-stable proteins and desiccation tolerance in recalcitrant and orthodox seeds. In: Ellis R H, Black M, Murdoch A J et al(eds). Current plant science and biotechnology in agriculture, basic and applied aspect of seed biology. Dordrecht: Kluwer Academic Publishers, 1997: 705-712
|
Koster K L, Leopold A C. 1988. Sugars and desiccation tolerance in seeds. Plant Physiology, 88: 829-832. DOI:10.1104/pp.88.3.829 |
Leprince O, Hendry G A F, Makersie B D. 1993. The mechanisms of desiccation-tolerance in developing seeds. Seed Science Research, 3: 231-246. DOI:10.1017/S0960258500001859 |
Lin C, Guo W W, Everson E. 1990. Cold acclimation in arabidopsis and wheat, a response associated with expression of related gene encoding "boiling-stable" polypeptides. Plant Physiol, 94: 1078-1083. DOI:10.1104/pp.94.3.1078 |
Obendorf R L. 1997. Oligosaccharides and galactosyl cyclitols in seed desiccation tolerance. Seed Sci Res, 7: 63-74. DOI:10.1017/S096025850000341X |
Pammenter N W, Berjak P. 1999. A review of recalcitrant seed physiology in relation to desiccation-tolerance mechanism. Seed Sci Res, 9: 13-37. DOI:10.1017/S0960258599000033 |
Roberts E H. 1973. Predicting the storage life of seeds. Seed Sci Technol, 1: 499-514. |
Sun W Q, Irving T C, Leopold A C. 1994. The role of sugar, vitrification and membrane transition in seed desiccation-tolerance. Physiologia Plantarum, 90: 621-628. DOI:10.1111/j.1399-3054.1994.tb02516.x |
 2004, Vol. 40
2004, Vol. 40