文章信息
- 王峥峰, 王伯荪, 张军丽, 李鸣光.
- Wang Zhengfeng, Wang Bosun, Zhang Junli, Li Mingguang.
- 广东鼎湖山3个树种在不同群落演替过程中的遗传多样性
- Genetic Diversity in Community Succession for Three Tree species in Dinghu Mountain of Guangdong Province
- 林业科学, 2004, 40(2): 32-37.
- Scientia Silvae Sinicae, 2004, 40(2): 32-37.
-
文章历史
- 收稿日期:2001-10-09
-
作者相关文章
2. 中山大学生命科学院 广州 510275
2. School of Life Sciences, Zhongshan University Guangzhou 510275
植被演替是一个群落为另一个群落所取代的动态过程(王伯荪等,1997)。它以优势种群的逐次消长为标志(王伯荪等,1987;彭少麟,1996),同时包括了种群分布格局(彭少麟等,1995a)、种间联结(王伯荪等,1983)、生产力(彭少麟等,1995b)、种群生理生态(梁春等,1987)、微生物(Yi et al., 1995)、土壤(夏汉平等,1997)和群落小气候(王伯荪等,1965)等在内的一系列变化,但并未见优势种群在不同演替阶段群落中的遗传多样性研究,因此本文拟对地处南亚热带鼎湖山演替系列群落中的木荷(Schima superba)、锥栗(Castanopsis chinensis)和厚壳桂(Cryptocarya chinensis)种群的遗传多样性进行初步探讨。
北回归线附近的南亚热带地区多为沙漠覆盖,但在我国,由于受太平洋季风控制,雨量充沛,终年湿度很大,发育出世界上独一无二的南亚热带常绿阔叶林(陈章和等,1996)。鼎湖山是这一地区最具特色的典型代表,植被资源丰富,拥有从针叶林先锋群落直至常绿阔叶林顶极群落的完整演替系列类型,是研究群落演替的理想地区。木荷和锥栗分别是南亚热带常绿阔叶林的演替先锋种,阳性植物,厚壳桂是南亚热带常绿阔叶林的演替顶极种,中生性植物,都是鼎湖山的优势种。这3个物种是南亚热带不同演替阶段群落重要建群种,通过对它们的遗传多样性研究可以更深刻理解演替和演替与种群遗传行为之间的紧密关系,无论在理论还是在实践上都有重大意义。同时我们采用AFLP(Amplified fragment length polymorphism)方法直接分析3个物种的DNA多态性,结果更为丰富,可靠(尹佟明等,1997;Paul et al., 1997)。
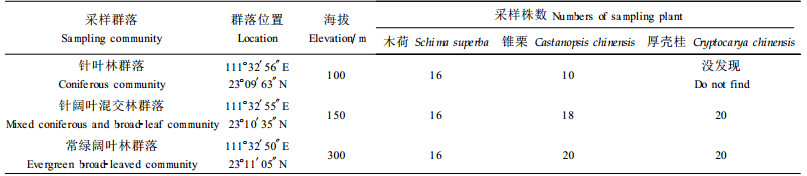
1 材料与方法 1.1 取样鼎湖山位于东经112°30′39″~112°33′41″,北纬23°09′21″~23°11′30″,年降雨量1 956mm,年均温20.9℃,最冷月和最热月的平均温度分别为12℃和28℃。土壤由泥盆纪厚层变质砂岩、砂页岩发育形成,主要土壤类型有赤红壤、红壤等(Kong et al., 1997)。
本研究中的针叶林、针阔叶混交林和常绿阔叶林是鼎湖山现有基本森林植被类型。其中针叶林为马尾松(Pinus massoniana)群落,其特点是乔木层由马尾松组成,林下较开阔,灌木、草本植物较茂盛,木荷、锥栗等阳性树种已开始侵入,多为幼苗。它是南亚热带森林演替的先锋阶段。针阔叶混交林是马尾松和阔叶树种的混合林。马尾松林在无大的人为干扰情况下,阳性常绿阔叶林树种木荷、锥栗等入侵群落后生长至一定阶段,和马尾松共同构成乔木层优势树种,使得群落向混交林演替,因而混交林是南亚热带森林植被演替的中间阶段。常绿阔叶林是南亚热带地带性植被类型。中生性树种,如厚壳桂、黄果厚壳桂等在混交林形成一定阶段后,郁闭度较大时入侵群落,取代了阳性树种,发育出以中生性植物为主体的群落类型,这是南亚热带森林植被演替的顶极阶段。其群落层次结构复杂,乔木层分为2~3层,上层乔木一般高达20m,最高可达30m。组成种类以华南植物区系成分为主,并有较多的热带区系成分。乔木层主要种类除了有木荷、锥栗外,还有厚壳桂、黄果厚壳桂(Crytocarya concinna)、红车(Syzygium rehderianum)、云南银柴(Aporosa yunnanensis)等。
这3个群落类型共存于鼎湖山,代表南亚热带森林演替的各阶段。在上述3个群落类型中进行了木荷、锥栗和厚壳桂幼苗的叶样采集,采集数目见表 1。其中常绿阔叶林群落与针阔叶混交林群落相距600m,针阔叶混交林群落与针叶林群落相距350m,常绿阔叶林群落与针叶林群落相距800m。
|
|
新鲜树叶1g采用CTAB法提取DNA(Doyle et al., 1987),用电泳法测其含量。AFLP方法参照Vos et al.(1995),2个EcoR引物和2个Mse引物分别是:
EcoR1:5′-GACTGCGTACCAATTC-AGG-3′
EcoR2:5′-GACTGCGTACCAATTC-ACT-3′
Mse1:5′-GATGAGTCCTGAGTAA-CAG-3′
Mse2:5′-GATGAGTCCTGAGTAA-CTC-3′
PCR反应:94℃变性5min,之后94℃变性30?s,65℃复性30?s,72℃延伸60s。每次降低复性温度1℃,反应10个循环,固定于56℃反应24个循环。72℃延伸5min。PCR产物用5%变性聚丙稀酰胺进行电泳,电泳结束后使用银染显色(Mitchell et al., 1996)。
1.3 数据处理把变性聚丙稀酰胺电泳产物所得的各带进行1/0标记,采用Nei(1987)方法计算平均遗传多样性(h),方法如下:
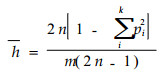
|
式中,pi是第i条带的基因频率;n是个体数;k为等位基因数;m为所有扩增多态带数。我们用它计算3物种总平均遗传多样性和各物种亚种群的平均遗传多样性。
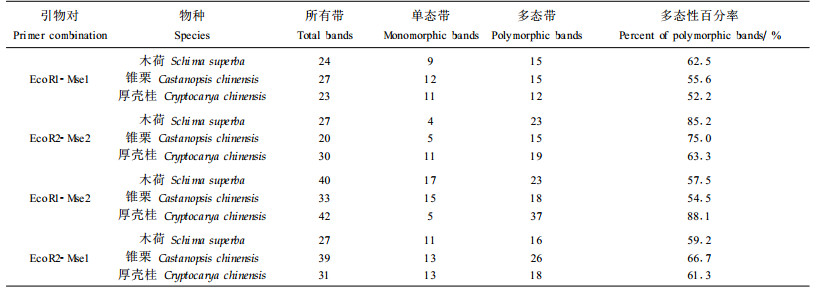
2 结果与分析 2.1 扩增结果表 2是4个引物对扩增结果,它们在木荷、锥栗和厚壳桂中分别扩增出24、27、40和27,27、20、33和39,23、30、40和31条带,其中多态带分别为15、23、23和16,15、15、18和26,12、19、37和18(表 2),多态性百分率最低为52.2%,最高为88.1%。
|
|
图 1是3个物种总平均遗传多样性,从中可以看出木荷和锥栗的结果相近,大于厚壳桂。

|
图 1 3个物种总平均遗传多样性 Fig. 1 Total mean genetic diversity of three species |
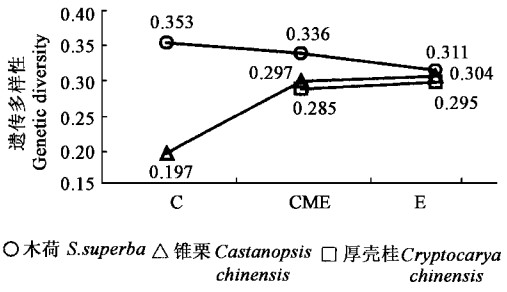
从图 2可以看出木荷在针叶林群落中的亚种群平均遗传多样性最大,随不同演替群落有下降趋势;锥栗的结果和木荷相反,有上升趋势,并且其针叶林亚种群平均遗传多样性最小,而另两个群落中亚种群平均遗传多样性相差很小;厚壳桂两个亚种群的平均遗传多样性相近。
|
图 2 3个物种分别在3个群落中的平均遗传多样性 Fig. 2 Mean genetic diversity for each species in each community C—针叶林亚种群Subpopulation in coniferous community; CME—针阔混交林亚种群Subpopulation in mixed coniferous and broad-leaf community; E—常绿阔叶林亚种群Subpopulation in evergreen broad-leaved community. |
从图 1和图 2可以看出木荷总平均遗传多样性(0.348)介于其亚种群平均遗传多样性(0.353,0.336,0.311)之间;而锥栗总平均遗传多样性(0.347)远大于其亚种群平均遗传多样性(0.197,0.297,0.304);厚壳桂总平均遗传多样性(0.308)略大于其亚种群平均遗传多样性(0.285,0.295)。
3 结论与讨论AFLP方法是近年来发展起来检测物种遗传多样性的新方法(Vos et al., 1995),它所需的样品少,无需知道DNA的序列信息,检测的位点丰富,实验结果稳定可靠(尹佟明等,1997),已被广泛应用在种群遗传学的研究中(张军丽等,2000)。
AFLP方法的每次反应可大致检测出50~100个位点,这是同类方法如RAPD方法所不能比拟的。从已有的文献看,RAPD的每个引物对的扩增产物在5~10之间(汪小全等,1996;恽锐等,1998;孔令让等,1998;陈毓亨等,1999;Rossetto et al., 1997; Morden et al., 1999; Wong et al., 1999; Martín et al., 2000),检测到相对较多扩增产物的是王洪新等(1997)用银染法对野大豆群体的RAPD分析,每个引物对平均检测到19个位点。
本研究中,3个物种4个引物对分别扩增出118、119和126个位点,平均每个引物对扩增出约30个位点,虽比理论上的50~100个位点以及其它研究(Pakniyat et al., 1997;Winfield et al., 1998; Morden et al., 1999; Schmidt et al., 2000)所检测的位点少,但却是RAPD方法所无法做到的,而且只需增加几个引物对就可以检测到RAPD方法中需20多个引物对才能检测到的位点数。同时AFLP方法因物种的不同,其扩增产物也有较大的区别,如Mackill等(1996)对水稻(Oryza sativa)的研究中,18个引物对扩增出529个位点;Gaudeul等(2000)使用3个AFLP引物对对法国Eryngium alpinum种群的研究中,共扩增出110个位点。
虽然有人同时用多态性(polymorphic)和单态性(monomorphic)位点进行物种遗传分析(Pakniyat et al., 1997),但多数研究人员只计算多态性位点,本研究中也只用多态性位点进行了3个物种的遗传多样性分析。从表 2可以看出本研究中的3个物种用4个引物对分别扩增出77、74和86个多态性位点,虽以往的研究人员进行种群遗传分析时采用的多态性位点较少,23~68个位点(指RAPD和AFLP方法)(汪小全等,1996;王洪新等,1997;Fischer et al., 1998; Allnutt et al., 1998),但多数研究人员采用较多的多态性位点,82~224个位点(指RAPD和AFLP方法)(恽锐等,1998;孔令让等,1998;陈毓亨等,1999;Winfield et al., 1998; Wong et al., 1999; Morden et al., 1999, Gaudeul et al., 2000; Martín et al., 2000; Schmid et al., 2000),本研究用于分析检测的位点较少,为获得更多的物种遗传信息,如是否有群落依赖(community dependent)性扩增位点,今后将增加AFLP引物对以进行检测和分析。
本研究中,木荷、锥栗和厚壳桂3个物种在南亚热带广泛分布,是广布种。那么,在鼎湖山局限范围,各物种广布特性是否使它们在不同群落的亚种群之间表现出较为一致的遗传多样性呢?从研究结果看,各物种亚种群的遗传多样性并非象形态上所表现出的简单一致,而有着极大差异,这意味着由种群消亡、成长所代表的群落演替,同时也是种群遗传多样性逐渐变化的过程。
木荷作为演替先锋种,阳性植物。从野外采集来看,在演替早期群落(针叶林)、演替中期群落(针阔叶混交林)和演替顶极群落(常绿阔叶林)中都有分布,且种源多,分布广。它是虫媒花,种子较轻,可以随风传播(李明佳等,1989)。而所选择的3个群落虽然有不同的群落类型,但相距较近(最大距离只有800m),亚种群之间的基因交流频繁,抵消了群落不同所造成的分化,故而木荷各亚种群遗传多样性差异不大(图 2)。同时从图 1和图 2的比较可以看出,木荷总平均遗传多样性(0.348)介于3个亚种群平均遗传多样性(0.353,0.336,0.304)之间,表明木荷不同亚种群遗传变异形式大致相同,即这种多样性形式散落在木荷不同亚种群中,也说明木荷基因流较大。但从图 2可以看出,木荷各亚种群的遗传多样性随群落演替阶段的不同表现出有规律的变化,即在针叶林群落其亚种群的遗传多样性最大,之后在针阔叶混交林群落减小,在常绿阔叶林群落中最小。由于我们研究的对象是木荷的幼苗,而针叶林群落郁闭度小,木荷生长的光照条件优越,不同来源的种源都可以生长,故此表现出较大的遗传多样性;而随着演替的进展,群落郁闭度逐渐增大,木荷更新受到限制,只在群落林隙有幼苗生长,它们更多来源于同一群落母树,而群落外的种源只有较小的几率占领这些林隙,因此表现出遗传多样性在针叶林亚种群和常绿阔叶林亚种群中逐渐降低,但是否由此造成遗传漂变还需今后进一步的研究。
锥栗也是演替先锋种,阳性植物,壳斗科。从野外采集来看,在演替早期群落(针叶林)、演替中期群落(针阔叶混交林)和演替顶极群落(常绿阔叶林)中都有分布,但是在演替早期群落(针叶林)中却不多,在此群落中只能采集到10株,并且只发现一株是大树,说明锥栗并不能很好的适应演替早期针叶林群落(可能是土壤的原因),因此其遗传多样性最低(图 2)。随着演替的进展,锥栗在针阔叶混交林和常绿阔叶林群落中逐渐成为优势种,种源丰富,因此这两个群落的亚种群表现出比针叶林亚种群更大的遗传多样性。但锥栗作为壳斗科植物,种子成熟后落在母树旁,不象木荷种子较易散布,因此在一定程度上限制了基因交流。这种限制了的基因流也反映在其总平均遗传多样性和3个亚种群平均遗传多样性关系上,即总平均遗传多样性(0.347)远大于3个亚种群平均遗传多样性(0.197,0.297,0.311),表明锥栗不同亚种群拥有各自独特的遗传变异形式,不同亚种群间分化大,但总平均遗传多样性并不降低,结果和木荷结果相似。
厚壳桂是演替顶极种,从野外采集来看,在演替中期群落(针阔叶混交林)和演替顶极群落(常绿阔叶林)中都有很大的分布,但在演替早期群落(针叶林)没有分布。厚壳桂是中生性植物,只有群落发育到一定阶段后,群落郁闭度较大时才有可能生长,因此演替早期群落(针叶林)不适合其生长,这种局限分布可能是其总遗传多样性低于木荷和锥栗的原因。从图 2可以看出厚壳桂2个亚种群的平均遗传多样性变化程度比木荷小,但造成这一结果的原因并不是大的基因流(象木荷一样),而是针阔叶混交林向常绿阔叶林演替发展中小环境更趋一致,使得厚壳桂在这两个群落中的亚种群遗传多样性相差不多,这也可以从锥栗在针阔叶混交林亚种群和常绿阔叶林亚种群的平均遗传多样性相差较小看出。显然这在木荷上表现不明显,这和木荷大的基因流有关,因为我们看到厚壳桂总平均遗传多样性(0.308)略大于2个亚种群平均遗传多样性(0.285,0.295),表明其遗传变异形式是介于木荷和锥栗之间的,即基因流介于两者之间,不同群落亚种群的分化中等,这种基因流可能也和厚壳桂种子成熟后多落于母树旁有关。
虽然种群大小和其遗传变异有着密切的关系,即大的种群一般拥有较多的遗传变异(Fischer et al., 1998; 2000;Morden et al., 1999),但并非总是如此(Schmidt et al., 2000)。本研究在野外采样过程中虽然发现3个物种各自不同的亚种群在不同的群落中多度不同,但并未进行这方面的调查,因此无法进行种群大小和其遗传多样性相关性的研究,也无法判断3个物种的亚种群中是否存在遗传漂变等遗传效应。同时本研究作为初步的尝试,取样较少,也限制了进行更深入的种群遗传研究,为此今后将在增大采样数目和增多AFLP检测引物对的基础上进行更多更深的演替过程中物种遗传变异的研究。
陈毓亨, 白守梅, 程克棣. 1999. 南方红豆紫杉烷高含量植株系RAPD初步研究. 植物学报, 41(8): 829-832. DOI:10.3321/j.issn:1672-9072.1999.08.008 |
陈章和, 王伯荪, 张宏达. 1996. 南亚热带常绿阔叶林的生产力. 广州: 广东高等教育出版社.
|
孔令让, 董玉琛, 贾继增. 1998. 粗山羊草随机扩增多态性DNA研究. 植物学报, 40(3): 223-227. |
李明佳, 莫江明, 王铸豪. 1989. 鼎湖山木荷若干生态学和生物学特性研究. 热带亚热带森林生态系统研究, 5: 55-62. |
梁春, 林植芳, 孔国辉. 1997. 不同光强下生长的亚热带树苗的光合—光响应特性. 应用生态学报, 8(1): 7-11. DOI:10.3321/j.issn:1001-9332.1997.01.002 |
彭少麟. 1996. 南亚热带森林群落动态学. 北京: 科学出版社.
|
彭少麟, 方炜. 1995a. 鼎湖山植被演替过程中锥栗和木荷种群的动态. 植物生态学报, 19(4): 311-318. |
彭少麟, 方炜. 1995b. 南亚热带森林演替过程生物量和生产力动态特征. 生态科学, 4: 1-8. |
汪小全, 邹喻苹, 张大明, 等. 1996. 银杉遗传多样性的RAPD分析. 中国科学(C辑), 26(5): 436-441. |
王伯荪, 黄庆昌. 1965. 广东鼎湖山森林小气候的生态效应. 中山大学学报(自然科学版), 4: 517-524. |
王伯荪, 彭少麟. 1983. 鼎湖山森林群落分析—Ⅱ.物种联结性. 中山大学学报(自然科学版), 4: 27-35. |
王伯荪, 彭少麟. 1987. 鼎湖山森林优势种群数量动态. 生态学报, 7(3): 214-221. |
王伯荪, 彭少麟. 1997. 植物生态学—群落与生态系统. 北京: 中国环境科学出版社.
|
王洪新, 胡志昂, 钟敏, 等. 1997. 盐渍条件下野大豆群体的遗传分化和生理适应:同工酶和随机扩增多态DNA研究. 植物学报, 39(1): 34-42. DOI:10.3321/j.issn:1000-4025.1997.01.006 |
夏汉平, 余清发, 张德强. 1997. 鼎湖山三种不同林型的土壤酸度和养分含量差异及其季节动态变化特征. 生态学报, 17(6): 645-653. |
尹佟明, 黄敏仁. 1997. AFLP分子标记及其在植物育种上的应用. 生物工程进展, 17(1): 6-11. |
恽锐, 钟敏, 王洪新, 等. 1998. 北京东灵山辽东栎种群DNA多样性的研究. 植物学报, 40(2): 169-175. DOI:10.3321/j.issn:1672-9072.1998.02.013 |
张军丽, 王峥峰, 王伯荪, 等. 2001. 植物种群研究中的分子标记及其应用. 应用生态学报, 11(4): 631-636. |
Allnutt T R, Newton A C, Lara A, et al. 1999. Genetic variation in Fitzroya cupressoides(alerce), a threatened South American confier. Mol Ecol, 8: 975-987. DOI:10.1046/j.1365-294x.1999.00650.x |
Doyle J J, Doyle J L. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf material. Phytochem Bull, 19: 11-15. |
Fischer M, Matthies D. 1998. RAPD variation in relation to population size and plant fitness in the rare Gentianella germanica(Gentianaceae). Amer J of Bot, 85: 811-819. DOI:10.2307/2446416 |
Fischer M, Husi R, Prati D, et al. 2000. RAPD variation among and within small and large populations of the rate clonal plant Ranunculus reptans(Ranunculaceae). Amer J of Bot, 87: 1128-1137. DOI:10.2307/2656649 |
Gaudeul M, Taberlet P, Till-Bottraud. 2000. Till-Bottraud. Genetic diversity in an endengered alpine plant, Eryngium allpinum L. (Apiaceae), inferred from amplified fragment length polymorphism markers. Mol Ecol, 9: 1625-1637. DOI:10.1046/j.1365-294x.2000.01063.x |
Kong G H, Huang Z L, Zhang Q M. 1997. Type, structure, dynamics and management of the lower subtropical evergreen broad-leaved forest in the Dinghushan Biosphere Reserve of China. Tropics, 6(4): 335-350. |
Mackill D J, Zhang Z, Redona E D, et al. 1996. Level of polymorphism and genetic mapping of AFLP markers in rice. Genome, 39: 969-977. DOI:10.1139/g96-121 |
Martín J P, Bermejo J E H. 2000. Genetic variation in the endemic and endangered Rosmarinus tomentosus Huber-Morath & Maire(Labiatae) using RAPD markers. Heredity, 85: 434-443. DOI:10.1046/j.1365-2540.2000.00774.x |
Mitchell L G, Bodenteich A, Merril C R. Use of silver staining to detect nucleic acids. In: Harwood A J ed. Basic DNA and RNA protocols, Totowa, New Jersey: Human Press, 1996: 97-103
|
Morden C W, Loeffler W. 1999. Fragmentation and genetic differentiation among subpopulations of the endangered Hawaiian mint Haplostachys haplostachya(Lamiaceae). Mol Ecol, 8: 617-625. DOI:10.1046/j.1365-294x.1999.00601.x |
Nei M. 1987. Molecular evolutionary genetics. New York: Columbia University Press.
|
Pakniyat H, Powell W, Baird E, et al. 1997. AFLP variation in wild barley(Hordeum spontaneum C. Koch)with reference to salt tolerance and associated ecogeography. Genome, 40: 332-341. |
Paul S, Wachira F N, Powell W, et al. 1997. Diversity and genetic differentiation among populations of India and Kenyan tea(Camellia sinensis(L.) O. Kuntze)reveals by AFLP markers. Theo Appl Genet, 94: 255-263. DOI:10.1007/s001220050408 |
Rossetto M, Lucarotti F, Hopper S, et al. 1997. DNA fingerpringting of Eucalyptus graniticola a critically endangered relict species or a rare hybrid?. Heredity, 79: 310-318. DOI:10.1038/hdy.1997.159 |
Schmidt K, Jensen K. 2000. Genetic structure and AFLP variation of remnant populations in the rare plant Pedicular palustris (Scrophulariaceae)and its relation to population size and reproductive compnents. Amer J of Bot, 87: 678-689. DOI:10.2307/2656854 |
Vos P, Hoger R, Bleeker M, et al. 1995. AFLP: a new technique for DNA fingerprinting. Nucl Acid Res, 23: 4407-4414. DOI:10.1093/nar/23.21.4407 |
Winfield M O, Arnold G M, Cooper F, et al. 1998. A study of genetic diversity in Populus nigra subsp. betulifolia in the Upper Severn area of the UK using AFLP markers. Mol Ecol, 7: 3-10. DOI:10.1046/j.1365-294x.1998.00299.x |
Wong K C, Sun M. 1999. Reproductive biology and conservation genetic of Goodyera procera (Orchidaceae). Amer J of Bot, 86: 1406-1413. DOI:10.2307/2656923 |
Yi W M, Fu S L, Cao H L, et al. 1995. Vesicular-arbuscular mycorrhizal associations in three forest types in the Dinghushan Biosphere Reserve, subtropical China. Proceedings of Australian Center for international Agricultural Research, 62: 41-46. |
 2004, Vol. 40
2004, Vol. 40