文章信息
- 王克荣, 周而勋, 姜爱萍, 成桂英.
- Wang Kerong, Zhou Erxun, Jiang Aiping, Cheng Guiying.
- 栗疫菌弱毒力特征的传递及其影响因素
- Transmission of dsRNA in Cryphonectria parasitica and it's Affecting Factors
- 林业科学, 2004, 40(1): 185-188.
- Scientia Silvae Sinicae, 2004, 40(1): 185-188.
-
文章历史
- 收稿日期:2002-05-13
-
作者相关文章
栗疫菌(Cryphonectria parasitica)弱毒力(hypovirulence)的本质是菌体中含有一种弱毒性病毒(cryphonectria hypovirulence viruses, CHV)dsRNA(Choi et al, 1992; Morris et al, 1979)。栗疫菌的弱毒力菌株(H菌株)一般都具有将强毒力(virulent)菌株(V菌株)转化为弱毒力菌株的能力,因而具有用来防治栗疫病的潜力(Van Alfen, 1982)。由于栗疫病菌弱毒力菌系在意大利的自然传播和在法国的人工辅助扩散,栗疫病早已不再被认为是该地区的重要林木病害(Grente et al, 1969; MacDonald et al, 1991)。真菌病毒或CHV病毒dsRNA不能离开寄主的细胞质而存活和进行侵染,因此,栗疫菌菌体中dsRNA的传递效率以及影响传播的内外因素就成为弱毒力能否应用到田间进行生物防治的制约因素。
我国是栗疫菌的原发地(Clapper, 1952)。近年来,国内对栗疫病菌及其弱毒力现象进行了一些研究(王克荣等,1991;1993;周而勋等,1995),但对于栗疫病菌中dsRNA的传递规律及其影响因素还不清楚,国际上对于栗疫菌中具体的营养体亲和性基因对菌株间dsRNA传递的影响也不清楚。本研究试图了解通过分生孢子、继代培养和菌丝融合等方式,菌株间传递ds RNA的效率及其影响因素,为我国利用由弱毒性病毒侵染产生的弱毒力菌株防治栗疫病奠定基础。
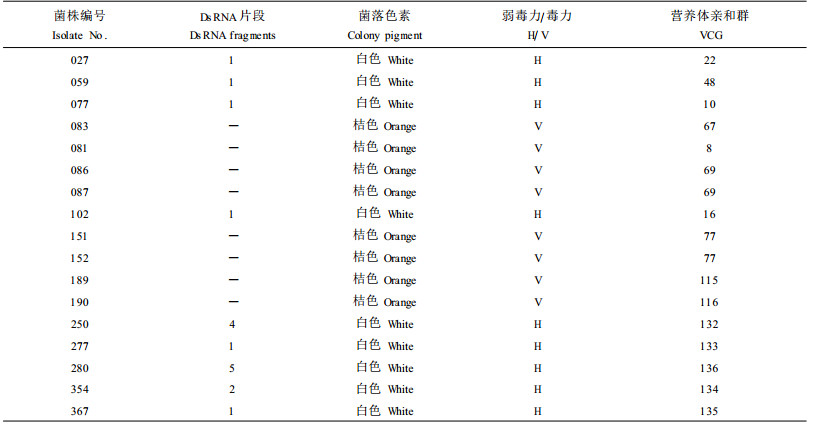
1 材料与方法 1.1 供试菌株供试菌株为1987—1991年间采自江苏、安徽、江西、辽宁等省林区,栗树种类除了辽宁省为日本栗(Castanea crenata)外,其他均为板栗(C.mollissima)。选择供试的弱毒力菌株主要考虑培养性状和dsRNA电泳条带的数量,毒力菌株的选择主要考虑营养体亲和群(VCG)间的基因差异,以便比较不同类型的弱毒力菌株对不同VCG菌株的转化率。详细情况见表 1(表中部分菌株的毒力和营养体亲和群测定结果见文献(王克荣等,1991;1993)。
|
|
将菌株移植至PDA平板上(每皿培养基的量依培养时间而定:培养15、30 d的15 mL·皿-1,培养45和60 d的25 mL·皿-1,培养75和90 d的35 mL·皿-1),置下列条件下培养:①25℃+16 h·d-1光照;②25℃+黑暗。分别培养15、30、45、60、75和90 d后,每皿加入10 mL灭菌水,配成孢子悬浮液,稀释为每毫升含200~300个孢子后,将其涂布在PDA平板上,25℃黑暗条件下培养5 d,观察并记载各单孢菌落的形态、颜色和生长速率,确定培养性状是否发生分化,计算分化比率。每菌株至少涂布6个PDA平板。
1.3 继代培养培养条件同1.2。每7 d转管培养一次(代),连续转管30次(代)。观察各代菌株的培养性状是否发生改变,并对第10代、20代和30代的菌株进行dsRNA检测(Morris et al, 1979)。
1.4 弱毒力转化将培养的H菌株和V菌株的菌丝块移至PDA平板中间配对培养(25℃、16 h·d-1光照),菌丝块相距0.5 cm,每处理重复20次。7 d后检查结果,计算转化率。
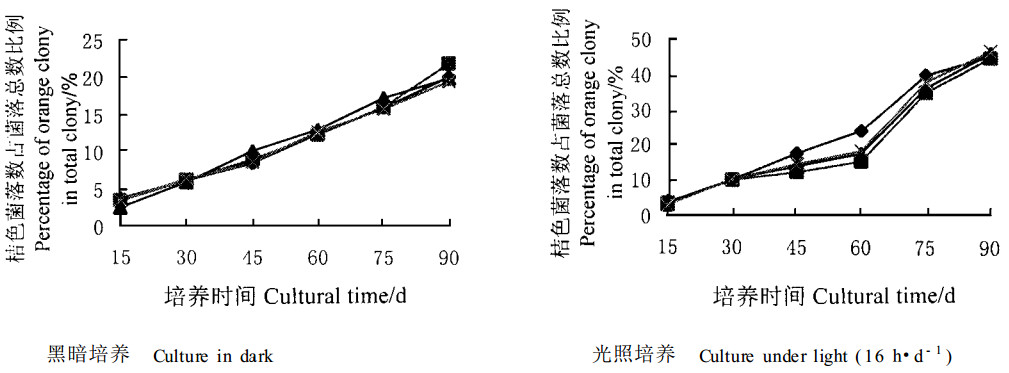
2 结果与分析 2.1 光照和培养时间对H菌株分生孢子后代带毒率的影响本实验选择生长速度和产孢量均相近的027、077和102号菌株作为分生孢子后代带毒率测定的研究对象,试验结果见图 1。从图 1可看出,随着培养时间的延长,桔黄色单孢后代的比例呈上升趋势,这种趋势在有光照条件下特别明显,经检测,这种桔黄色菌落的菌株不含dsRNA,毒力较强,表明光照对H菌株分生孢子传递CHV病毒产生不利的影响。
|
图 1 光照和培养时间对H菌株分生孢子后代菌落特征分化的影响 Fig. 1 Effect of light and cultural time on the segregation ratio for conidial progeny of H isolates 菌株编号Isolate No. 
|
试验对250和354号菌株进行了研究,选择的两菌株均含有多条dsRNA组分,有利于对各组分的dsRNA在传递中的监测。结果表明,无论是在光照条件下,还是在黑暗条件下转管培养,移植30代后,菌株的培养性状均未发生改变;经dsRNA检测,两个菌株的dsRNA片段数也都没有减少,各片段的分子量与继代培养前的相同,说明dsRNA可通过菌丝体的继代培养稳定传递。
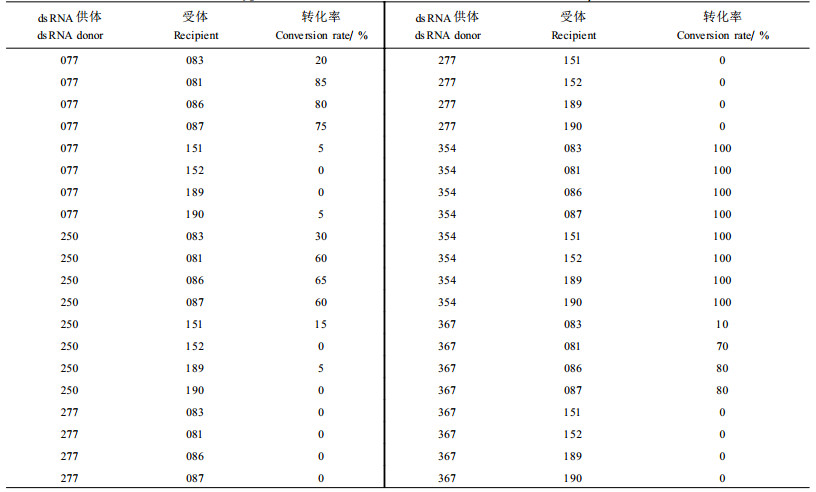
2.3 营养体亲和性对通过菌丝融合传递dsRNA的影响天然H菌株转化V菌株5个H菌株对8个V菌株进行弱毒力转化的结果(见表 2)表明,H菌株对V菌株的转化率从0~100%不等,说明H菌株尽管与V菌株的VCG不同,但大多可获得一定的转化率。表 2还显示,H菌株对同一VCG的V菌株的转化率基本相同,如077号菌株对085、086和087号菌株的转化率均在75%~80%之间。
|
|
H菌株对不同VCG的V菌株的转化能力和转化率很不相同,如H菌株077、250和367号能全部转化081、086和087号3个菌株,且转化率都较高(可达100%),但对151、152、189和190号菌株的转化率很低,都不能完全转化这4个菌株。H菌株354号的转化能力最强,能转化供试的8个V菌株,转化率均为100%。
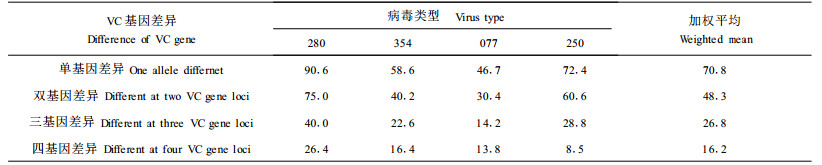
VC基因的差异对菌株间传递dsRNA效率的影响将不同类型的弱毒性dsRNA病毒(280,354和077)分别转入086和189菌株中,再将后者分别与相差不同VC基因数量的野生型毒力菌株进行配对培养,两周后检测弱毒性特征的转化率,结果见表 3。
|
|
在不同营养体亲和群(VCG)的菌株间,各种类型的dsRNA仍可获得一定的转化率,本研究只进行四个VC基因差异以内的菌株间的转化试验,同一VCG的菌株间的dsRNA转化率一般为100%,在两个VC基因差异的水平上,平均转化率可达48.3%。从表 3可以看出,病毒在单个VC基因差异的菌株间的平均转化率明显高于两个VC基因差异的菌株间的转化率,而在四个VC基因差异的菌株间,弱毒性特征的转化率平均只有16.2%,因此,VC基因对菌株间菌丝有效融合的影响似乎具有累加效应;同时还可看出,dsRNA片段的数量似乎也影响菌株间的转化率。
3 讨论光照和培养时间对H菌株分生孢子后代的分化率均有影响。延长培养时间和提供光照条件,可提高桔黄色菌落单孢后代的百分率,其中又以光照作用更明显。光暗交替培养90 d后,桔黄色菌落单孢后代的比例上升达40%以上,表明dsRNA可通过分生孢子传递给后代的效率不稳定,会因受到外界环境条件的影响而发生波动。Van Alfen等(1978)曾报道,新移植的弱毒力菌株产生的分生孢子中,99%会形成弱毒力菌株,而培养了2~9个月的弱毒力菌株的分生孢子中,仅有不足40%能形成弱毒力菌株,本研究的结果大致与此相似。光照和延长培养时间会降低弱毒力菌株的传递效率,这从理论上说,对利用H菌株防治栗疫病的效果很有影响,但实际上的影响可能并不大,因为只要H菌株侵染进栗树树皮组织,菌丝一般是在形成层扩展,不存在表生问题,因而可避免光照的影响。
对含dsRNA的两个菌株连续移植了30代,均未发现培养性状发生改变,表明这两个菌株的培养性状是相当稳定的。对这两个菌株经移植不同代数的后代进行dsRNA检测,两个菌株均未发生病毒片段丢失现象。
在光照下培养和延长培养时间,虽可提高其产生野生型分生孢子比率,但在同样条件下进行菌丝块移植培养,都仍保持其弱毒力菌株的特征。二者似乎矛盾,出现此种现象的原因可能是:光照影响菌丝中dsRNA进入分生孢子这一过程,但并不影响菌丝中dsRNA的增殖和扩散。
菌株间的营养体不亲和性是弱毒力转化的主要障碍(见表 2),但这种营养体不亲和性只在VC基因差异较多的情况下才体现出来,菌株间的VC基因差异在4个以下时,一般都有不同程度的转化率。表 3的数据表明,病毒类型不同,其在菌株间的转化率也有明显差异,280病毒的转化率显著高于354和077病毒。
王克荣, 邵见阳, 陆家云. 1991. 苏皖地区栗疫病菌营养体亲和性研究. 南京农业大学学报, 14(4): 44-48. |
王克荣, 邵见阳, 陆家云. 1993. 栗疫病菌的致病力分化. 果树科学, 10(1): 25-28. |
周而勋, 王克荣, 刘凤权, 等. 1995. 单克隆抗体检测栗疫病菌dsRNA的研究初报. 植物病理学报, 25(1): 91-92. |
Choi G H, Nuss D L. 1992. Hypovirulence of chestnut blight fungus conferred by an infectious viral cDNA. Science, 257: 800-803. DOI:10.1126/science.1496400 |
Clapper R B. 1952. Relative blight resistance of some chestnut species and hybrids. J Forest, 50: 453-455. |
MacDonald W L, Fulbright D W. 1991. Biological control of chestnut blight: use and limitation of transmissible hypovirulence. Plant Disease, 75: 656-661. |
Morris T J, Dodds J A. 1979. Isolation and analysis of double-stranded RNA from virus-infected plant and fungal tissue. Phytopathology, 69: 854-858. DOI:10.1094/Phyto-69-854 |
Van Alfen N K. 1982. Biology and potential for disease control of hypovirulence of Endothia parasitica. Ann Rev Phytopathol, 20: 349-362. DOI:10.1146/annurev.py.20.090182.002025 |
Van Alfen N K, Jaynes R A, Bowman J T. 1978. Stability of Endothia parasitica hypovirulence in culture. Phytopathology, 68: 1075-1079. DOI:10.1094/Phyto-68-1075 |
Grente J, Sauret S. 1969. L'hypovirulence exclusive, est-elle controlée par des déterminants cytoplasmiques?. Comptes rendus hebdomadaires des séances de I' Académie des séances, séne D, 268: 3173-3176. |
 2004, Vol. 40
2004, Vol. 40