文章信息
- 史胜青, 袁玉欣, 杨敏生, 梁海永, 张金香.
- Shi Shengqing, Yuan Yuxin, Yang Minsheng, Liang Haiyong, Zhang Jinxiang.
- 水分胁迫对4种苗木叶绿素荧光的光化学淬灭和非光化学淬灭的影响
- Effects of Water Stress on Photochemical Quenching and Non-photochemical Quenching of Chlorophyll a Fluorescence in Four Tree Seedlings
- 林业科学, 2004, 40(1): 168-173.
- Scientia Silvae Sinicae, 2004, 40(1): 168-173.
-
文章历史
- 收稿日期:2002-01-21
-
作者相关文章
2. 河北省林业科学研究院 石家庄 050013
2. Hebei Academy of Forestry Shijiazhuang 050013
植物生长在极端环境下,能够导致光合器官的损伤,抑制植物的光合作用,如强光(Johnson et al., 1993)、低温(张木清等,1999)和水分胁迫(kate et al., 2000;Lu et al., 1999;罗俊等,2000;王可盼等,1997;韦振泉等,2000)等。许多研究表明,光合作用受到伤害的最原初部位是与PSⅡ紧密联系的(Weis et al., 1988;Havan et al., 1996)。水分胁迫是抑制植物光合作用的最主要环境因子之一。研究表明,水分胁迫导致叶绿体光合机构的破坏(罗俊, 2000),PSⅡ放氧复合物的损伤(Lu et al., 1999),PSⅡ捕光色素蛋白复合物(LHCⅡa、LHCⅡb、LHCⅡc)各组成成分的变化,引起光合CO2同化效率的降低(韦振泉,2000)。对叶绿素荧光特性的研究是探讨光系统受损状况的途径之一,其中叶绿素荧光光化学淬灭系数(qP)和非光化学淬灭系数(qN)是其主要的指标;迄今对上述2个指标的探讨较多,但结果并不完全一致。王可盼等(1997)报告表明,通过对小麦叶片离体干旱处理后,快速胁迫使叶绿素荧光qP和qN降低,而Lu等(1999)及Chakir等(1999)的研究表明,qP变化不明显,qN升高。但在离体胁迫和盆栽胁迫2种测定条件下,植物叶片叶绿素荧光的qP和qN变化趋势是否一致,能否作为植物抗旱性的指标,以及能否通过快速荧光参数测定来鉴定植物的抗旱性,这方面的研究报道较少,特别在林木方面尚未见报道。
针对河北省低山丘陵退耕还林项目的主要造林树种皂荚(Gleditsia sinensis)、核桃(Juglans regia)、柿子(Diospyros kaki)和黑枣(Diospyros lotus)的抗旱性进行研究,旨在探讨它们的抗旱能力和抗旱避旱的途径,为科学种植这些树种提供理论依据。本文通过叶绿素荧光技术对不同种属的苗木在盆栽及离体2种不同水分胁迫处理中qP和qN的变化趋势的研究,重点探讨不同水分胁迫条件下4种苗木的叶绿素荧光特性,试图通过叶绿素荧光技术为不同水分胁迫处理方法时植物响应和适应性差别的研究提供证据。
1 材料与方法 1.1 材料来源4种参试苗木皂荚、核桃、柿子、黑枣均为河北农业大学林学院苗圃提供的1 a生苗,于2000年3月中旬移栽到塑料盆中,盆高30 cm,口径为25 cm,每盆土重约12 kg,培养土为苗圃熟土(2份)、沙(1份)和腐质土(1份)混合而成,为砂壤土。将盆下部2/3埋入土中,正常供水管理,6月下旬进入旺盛生长期时试验开始。
1.2 盆栽苗木干旱处理6月26日开始进行试验,处理前使各盆的土壤相对含水量基本达到饱和,停止浇水,自然干旱,通过称盆重监测各盆失水情况,使土壤相对含水量分别达到80%、60%、40%,7月2日3个水分梯度形成。每种苗木3个处理,每个处理重复8盆。为防止雨水淋湿,设置塑料遮雨棚。每天傍晚通过称重补充水分,连续控水30 d。
1.3 离体叶片干旱处理离体叶片于8月上旬上午9:00取自田间正常管理的4种苗木,用冰壶立即带回实验室,在室温33℃、相对湿度为13.5%的条件下,每隔2 h测定一次,处理方法参照王可盼等(1997)。
1.4 叶水势测定凌晨5:00,取各处理的相同部位的功能叶片,湿纱布包好,用冰壶立即带回实验室内,应用压力室技术测定盆栽苗叶水势,每个处理重复3次。
1.5 荧光参数的测定每个处理测定5~6个相同部位的功能叶片,仪器为OS5-FL调制式荧光仪,方法同王可盼等(1997)。测定苗木叶片PSⅡ的原初转换效率Fv/Fm,光化学淬灭系数qP和非光化学淬灭系数qN。qP和qN值是荧光动力学稳态时的平均值。
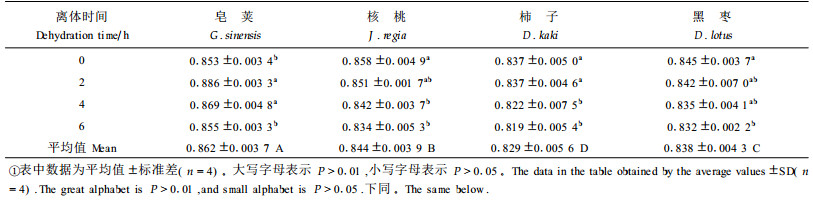
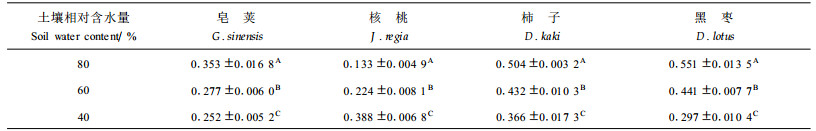
2 结果与分析 2.1 水分胁迫对叶片水分状况的影响(1) 离体时间对叶片相对含水量的影响 植物叶片相对含水量和叶水势可以作为植物抗旱性鉴定的指标(Patakas et al., 1997)。植物发生水分胁迫时,如果叶片含水量降低的幅度较小, 则说明叶片的保水能力较强;如果叶水势下降的幅度较大,则可增大土壤和叶水势之间的梯度,有利于植物从土壤中吸收水分,提高植物适应干旱的能力。
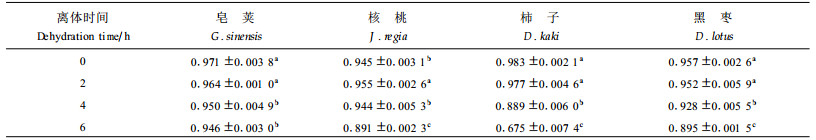
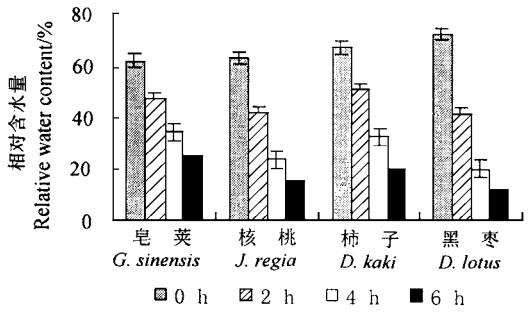
图 1表明,随着水分胁迫的加剧,4种参试苗木叶片的相对含水量降低。叶片离体6 h时,皂荚、核桃、柿子和黑枣的叶片极度失水,相对含水量从对照(CK)的63.0%~72.8%下降到12.9%~26.6%,下降幅度为59.95%~82.70%,4个树种分别比对照下降了59.5%、65.4%、69.6%和82.7%,降低幅度顺序为皂荚<核桃<柿子<黑枣。从以上结果可以看出,不同树种叶片的保水能力差别较大,以皂荚表现最好。
|
图 1 不同离体时间叶片相对含水量变化 Fig. 1 The variation of relative water content of leaves in different time |
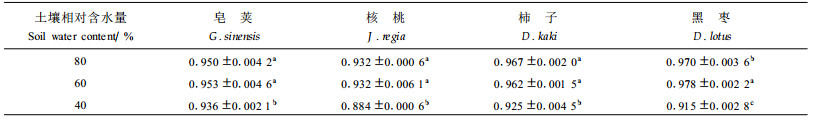
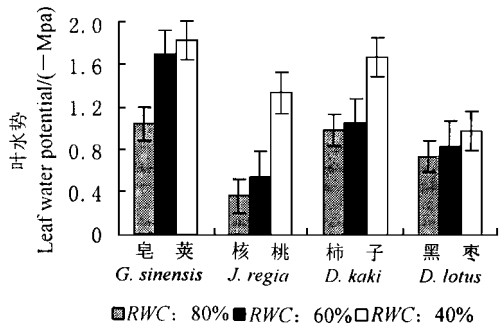
(2) 水分胁迫对盆栽叶片水势的影响 从图 2可知,随着土壤相对含水量(RWC)的降低,4树种的叶水势值逐渐降低。土壤RWC长时间保持60%时,皂荚、柿子、核桃和黑枣的叶水势从80%时的-0.37~-1.08 Mpa降低到-0.55~-1.75 Mpa,下降幅度为8.1%~61.5%,下降顺序为柿子<黑枣<核桃<皂荚。当土壤RWC长时间保持40%时,上述树种的叶水势下降到-1.03~-1.88 Mpa,与对照(80%RWC)相比,降低幅度为37.9%~279.1%,下降顺序为黑枣<柿子<皂荚<核桃。
|
图 2 不同土壤相对含水量时叶水势的变化 Fig. 2 The variation of leaf water potential of potted seedlings under water stress |
综上分析,4种苗木叶片在离体6 h时会发生极度失水(12.9%~26.6%)现象;而在盆栽条件下,土壤RWC为40%时,苗木就会发生严重的干旱胁迫。从叶保水能力以及盆栽观察看来,4树种的保水能力为皂荚>核桃>柿子>黑枣。
2.2 水分胁迫对叶片Fv/Fm的影响Fv/Fm值常用于度量植物叶片PSⅡ原初光能转换效率,表明PSⅡ利用光能的能力。方差分析(表 1)表明,品种间Fv/Fm值达极显著差异,表明各种苗木的光能转换效率不同。在整个离体脱水过程中,皂荚的Fv/Fm值没有降低,反而略有上升,说明皂荚PSⅡ的原初光能转换效率没有受到影响。离体6 h时,另3种苗木的Fv/Fm值与对照相比达显著差异,但降低的幅度不大,核桃、柿子、黑枣分别下降2.8%、2.2%和1.6%,下降幅度品种间差异不显著(P>0.05)。
|
|
方差分析(表 2)表明,各苗木品种间Fv/Fm值达极显著差异,在土壤RWC为40%的长期严重胁迫下,各苗木处理间Fv/Fm值降低不明显,无显著差异(P>0.05)。
|
|
综合表 1和表 2的分析结果,说明经快速离体干旱和长期土壤干旱2种胁迫处理,4种苗木叶片PSⅡ原初光能转换效率和潜在活性只受到轻微的影响或影响不大(Kate et al., 2000)。但受到长期干旱胁迫的苗木叶片的Fv/Fm值比离体快速胁迫的Fv/Fm值低。
2.3 水分胁迫对叶片qP的影响光化学淬灭系数qP值的大小反映的是PSⅡ原初电子受体QA的氧化还原状态和PSⅡ开放中心的数目,其值越大,说明PSⅡ具有高的电子传递活性(张守仁,1999)。
从表 3可知,随着离体时间的延长,4种苗木叶片的qP值都呈下降趋势。叶片离体2 h,qP值几乎没有下降,核桃反而明显上升。4 h时,皂荚、核桃、柿子和黑枣的qP值分别比对照下降了2.16%、0.14%、9.50%和3.00%。方差分析(P>0.05)表明,仅核桃下降幅度不明显,其余3种出现明显变化,但只有柿子的下降幅度最大(9.50%)。离体6 h时,分别比对照下降了2.5%、5.7%、31.3%和6.4%,各苗木的qP值与对照相比均达显著差异(P>0.05),皂荚和柿子在品种间达极显著差异(P>0.01),核桃和黑枣2种苗木差异不显著, 与皂荚和柿子分别达显著差异(P>0.05)。结果表明,皂荚、核桃和黑枣3种苗木叶片的含水量降到极低(RWC为12.9%~25.6%)时(图 1),qP值才出现明显的降低(王可盼等,1997),但降低幅度不大。说明不同苗木叶片的PSⅡ反应中心电子传递活性受到了不同程度的影响,柿子受到的影响最大,皂荚最小。
|
|
从表 4可以看出,在长期土壤RWC为60%的中度胁迫下,4种苗木叶片qP几乎没有发生变化。只有在长期土壤RWC为40%的严重胁迫下,qP值才出现明显下降(P>0.05),降低幅度为皂荚1.5%、核桃4.4%、柿子5.2%和黑枣5.7%。方差分析(P>0.05)表明,黑枣和皂荚在品种间差异达显著水平,核桃和柿子间差异不显著,与其它2种达显著差异。结果表明,盆栽60%的干旱处理时,苗木叶片的光化学淬灭没有受到明显影响,在40%的严重胁迫条件下,叶片的光化学淬灭受到一定程度的影响,但降低幅度不大,说明PSⅡ仍能维持较高的光合电子传递活性。
|
|
非光化学淬灭系数qN值大小反映的是PSⅡ反应中心对天线色素吸收过量光能后的热耗散能力及光合机构的损伤程度,是一种保护机制(Johnson et al., 1993;Bader et al., 2000;张守仁,1999)。PSⅡ通过提高非辐射性热耗散,可以消耗PSⅡ吸收的过剩的光能,从而保护PSⅡ反应中心免受因吸收过多光能而引起的光氧化伤害,当植物处于胁迫条件时,qN值增大。
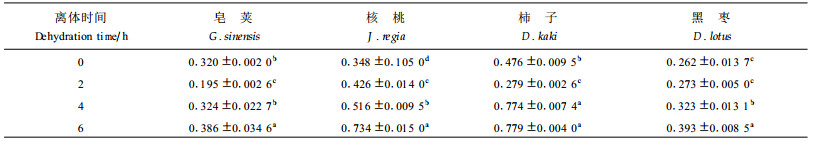
从表 5可知,苗木叶片qN值随叶片离体时间的延长而上升,这与Chakir等(1999)对肺衣(Lobariapulmonaria)和Lu等(1999)对小麦的研究结果相似,表明水分胁迫使PSⅡ非辐射能量的耗散增加。表 5表明,4种苗木叶片的qN值变化程度不同。离体4 h时,核桃、柿子和黑枣的qN值明显上升;离体6 h时,核桃qN值比对照提高了110%,柿子63.6%,黑枣50.1%,皂荚20.6%。核桃与其余3种差异极显著(P>0.01)。这说明在发生离体脱水胁迫时,核桃耗散PSⅡ过量光能的能力最强,其次为柿子、黑枣,最低的是皂荚。但皂荚是4种苗木中最抗旱的,保水能力也最强(见2.1),其qN值最低的原因可能与树种特性有关。因为皂荚的叶片在强光下合拢以防止吸收过多的光能及减少水分的散失。这与Cistus spp.通过叶片角度的改变避免过剩光辐射伤害的途径相似(Werner et al., 1999)。
|
|
表 6表明,在盆栽干旱处理过程中,4种苗木叶片qN值变化趋势不同,处理间qN值变化达极显著水平(P>0.01), 但仅核桃qN值的变化趋势与离体干旱处理一致。随着土壤胁迫程度的加剧,核桃的qN值迅速增加;在长期土壤RWC为40%的严重胁迫时,qN值比土壤RWC为80%时提高了191%。表明核桃在干旱胁迫中,PSⅡ非辐射耗散能力增强,从而避免过剩光能伤害光合器官。其余3种苗木却相反,qN值呈下降趋势。在土壤RWC为40%的严重胁迫时,柿子qN值下降了27.4%,皂荚28.5%,黑枣最为严重,达46.1%,品种间差异达极显著水平(P>0.01),与王可盼等(1997)对小麦离体叶片的研究结论一致。
|
|
本实验研究结果表明(表 3、4),随着水分胁迫的加剧,离体4 h时,仅核桃的qP值没有明显变化,而盆栽土壤RWC为60%处理时,4种苗木都没有发生明显的变化,这一结论与实验中测得PSⅡ原初转换效率(Fv/Fm)没有明显降低的结果是一致的(见2.2),与其它研究结果相似(Lu et al., 1999;Chakir et al., 1999)。离体6 h和盆栽土壤RWC为40%时,qP值下降达显著水平(P>0.05)。但只有柿子在离体条件下qP值降低幅度最大,比对照降低了31.3%,而盆栽干旱胁迫时仅降低了5.2%。造成这种现象的原因可能是,某些植物在长期的干旱胁迫过程中,形成了一种适应机制,从而提高了光能的利用效率(杨胜铭等,2001)。
所有的高等植物都有较为完善的非光化学淬灭机制,在逆境条件下,通过非辐射性热耗散消耗光捕获蛋白复合物(LHCⅡ和LHCⅠ),吸收过剩光能而避免对光合器官的损伤(Bader et al., 2000)。热耗散可以防御过剩光能的破坏,热耗散的程度可用荧光的非光化学淬灭qN来检测(冯志立等,2002)。本实验研究结果表明离体快速胁迫和盆栽缓慢干旱胁迫2种处理方法对4种苗木叶片的非光化学淬灭qN的影响不同。离体处理时,qN都呈上升趋势(表 5)。qN增大表明PSⅡ的潜在热耗散能力增强,有效地避免或减轻因PSⅡ吸收过多光能对光合机构的破坏(朱新广等,1999)。Casper等(1993)和Eickmeier等(1993)的研究表明,植物在离体条件下,通过启动叶黄素循环来消耗过剩的光能。热耗散的增加依赖于叶黄素循环的启动,可能是防御光破坏的主要途径(冯志立等,2002)。而在盆栽干旱处理时,除核桃外,其余3种qN值都呈降低趋势(表 6)。qN的降低, 表明PSⅡ的潜在热耗散能力降低(朱新广等,1999)。当植物叶片吸收过多的光能时,叶黄素循环中含双环氧的紫黄质V(violaxantin)便会在去环氧化酶的作用下,经单环氧的环氧玉米黄质A(antheraxantin)转化为去环氧的玉米黄素(zeaxanthin)(郭连旺等,1996)。A+Z的含量与非光化学淬灭有很好的线性关系(吴长艾等,2001)。但在长期的胁迫条件下,去环氧化酶的活性降低,叶黄素循环的作用受到限制,从而引起非光化学淬灭qN的降低(郭连旺等,1996)。研究也表明,整体植物的热耗散可能主要发生于PSⅡ捕光天线部位,这个部位的热耗散与叶黄素循环有关,LHCⅡ是与叶黄素循环相联系的(Horton et al., 1994)。在长期中度和严重的水分胁迫下,LHCⅡ b的含量逐渐减少,使非辐射能的耗散能力降低(韦振泉等,2000)。同时植物在进化的过程中,光合机构形成多种保护机制,如热耗散、光呼吸和Mehler反应和活性氧清除系统等(郭连旺等,1996)。
综上所述,植物对不同水分胁迫处理的响应和适应性不同,特别是植物叶片荧光的qN值。本文研究表明,皂荚、柿子、黑枣叶片qN值在2种水分胁迫过程中截然相反(表 5、6),其原因可能是过剩光能的耗散机制发生了变化,其机理有待于进一步研究。植物叶片荧光的qN值可以作为核桃、柿子和黑枣的苗木的抗旱性指标,特别是同一属种间,如柿子和黑枣;由于树种生物学特性的原因,当皂荚与上述3种苗木比较时,qN不适合作为抗旱指标。光化学淬灭系数qP只能作为参考指标。
冯志立, 冯玉龙, 曹坤芳. 2002. 光强对砂仁叶片光合作用光抑制及热耗散的影响. 植物生态学报, 26(1): 77-82. DOI:10.3321/j.issn:1005-264X.2002.01.013 |
郭连旺, 沈允钢. 1996. 高等植物光合机构避免强光破坏的保护机制. 植物生理学通讯, 32(1): 1-8. |
罗俊, 张木清, 吕建林, 等. 2000. 水分胁迫对不同甘蔗品种叶绿素a荧光动力学的影响. 福建农业大学学报, 29(1): 18-22. |
王可盼, 许春晖, 赵福洪, 等. 1997. 水分胁迫对小麦旗叶某些体内叶绿素a荧光参数的影响. 生物物理学报, 13(2): 273-278. |
韦振泉, 林宏辉, 何军贤, 等. 2000. 水分胁迫对小麦捕光色素蛋白复合物的影响. 西北植物学报, 20(4): 555-560. DOI:10.3321/j.issn:1000-4025.2000.04.011 |
吴长艾, 孟庆伟, 邹琦. 2001. 叶黄素循环及其调控. 植物生理学通讯, (1): 1-5. |
杨胜铭, 高辉远, 邹琦. 2001. 状态转换对光合作用中激发能分配的调节及其与光破坏防御的关系. 植物生理学通讯, 37(2): 89-94. |
张木清, 陈如凯, 吕建林, 等. 1999. 甘蔗叶绿体荧光参数、MDA含量及膜透性与耐旱性的影响. 福建农业大学学报, 28(1): 1-7. |
张守仁. 1999. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 16(4): 444-448. DOI:10.3969/j.issn.1674-3466.1999.04.021 |
朱新广, 张其德, 匡廷云. 1999. NaCl胁迫对PSⅡ光能利用和耗散的影响. 生物物理学报, 15(4): 787-790. |
Bader M R, Ruuska S, Nakano H. 2000. Electron flow to oxygen in higher plants and algae: rates and control of direct photoreduction (Mehler reaction) and rubisco oxygenase. Biological Sciences, 1402: 1433-1445. |
Casper C, Eickmeier W G, Osmond C B. 1993. Changes of fluorescence and xanthophylls pigments during dehydration in the resurrection plant Selaginessa lepidophylla in low and medium light intensities. Oecolgia, 94: 528-533. DOI:10.1007/BF00566968 |
Chakir S, Jensen M. 1999. How does Lobaria pulmonaria regulate photosystem Ⅱ during progressive desiccation and somotic water stress?A chlorophyll fluorescence study at room temperature and at 77k. Physiologia plantarum, 2: 257-265. |
Eickmeier W G, Casper C, Osmond C B. 1993. Chlorophyll fluorescence in the resurrection plants Selaginessa lepidophylla (Hook & Grev) spring during high-light and desiccation stress, and evidence for zeaxanthin-associated photoprotection. Planta, 189: 30-38. |
Garcia P J I, Faria T, Abadia J. 1997. Seasonal changes in xanthophyll composition and photosynthesis of cork oak (Quercus suber L.) leaves under mediterranean climate. J of Exp Bot, 48(308): 687-691. |
Havan X M, Tardy F. 1996. Temperature-dependent adjustment of the thermal stability of photosystem Ⅱ in vivo: possible involvement of xanthophyll-cycle pigments. Planta, 198: 324-333. DOI:10.1007/BF00620047 |
Horton P, Ruban A, Walters R G. 1994. Regulation of light havesting in green plants: indication by nonphotochemical quenching of chlorophyll fluorescence. Plant physiol, 106: 415-419. DOI:10.1104/pp.106.2.415 |
Johnson G N, Young A J, Scholes J D. 1993. The dissipation of excess excitation energy in British plant species. Plant Cell and Enviroment, 16: 673-679. DOI:10.1111/j.1365-3040.1993.tb00485.x |
Kate M, Johnson G N. 2000. Chlorophyll fluorescence-a pratical guide. J Exp of Bot, 51(345): 659-668. DOI:10.1093/jexbot/51.345.659 |
Lu C M, Zhang J H. 1999. Effects of water stress on photosystem Ⅱ photochemistry and its thermostability in wheat plants. J Exp of Bot, 50(336): 1199-1206. DOI:10.1093/jxb/50.336.1199 |
Patakas A, Noitsakis B. 1997. Cell wall elasticity as a mechanism to maintain avorable water relations during leaf ontogeny in grapevines. American Journal of Enology & Viticulture, 48(3): 352-356. |
Weis E, Berry J A. 1988. Plants and high temperatrue stress. Symp Soc Exp Biol, 42: 329-346. |
Werner C, Beyschlag W, Correia O. 1999. Two different strategies of Mediterranean macchia plants to avoid photoinhibitory damage by excessive radiation levels during summer drought. Acta Oecologica-International Journal of Ecology, 20(1): 15-23. DOI:10.1016/S1146-609X(99)80011-3 |
 2004, Vol. 40
2004, Vol. 40