文章信息
- 王磊, 李红双, 蔺娜, 崔德才.
- Wang Lei, Li Hongshuang, Lin Na, Cui Decai.
- 悬铃木叶片再生体系的建立*
- Establishment of Leaf Regeneration System in Platanus acerifolia
- 林业科学, 2004, 40(1): 58-63.
- Scientia Silvae Sinicae, 2004, 40(1): 58-63.
-
文章历史
- 收稿日期:2002-07-12
-
作者相关文章
悬铃木(Platanus acerifolia)又名二球悬铃木、英国梧桐,是三球悬铃木(又名法国梧桐)(P.orientalis)和一球悬铃木(又名美国梧桐)(P.occidentalis)的杂交种。它树干高大,枝叶茂盛,遮荫面积大,绿化效果好;同时耐修剪,抗烟尘,是世界著名的行道树和庭荫树。悬铃木在中国分布十分广泛,已成为许多大中城市重要的行道树及园林绿化树种(郑万钧,1985)。但每年4—6月间,老果脱落产生的果毛和新生雄花序散落的花粉都从树上飘落下来,不仅污染环境,而且会引发呼吸系统疾病。对控制悬铃木季节性果毛和花粉污染已做了不少探索,应用的方法主要有:人工诱变、树冠嫁接、修剪控果、化学药剂处理(周业恒等,1993;曹岸平,2000;章利民,2000;沈国华等,1995)。这些措施已取得了一定的效果,但尚未从根本上解决问题。近几年来,随着生物技术的发展,人们可以将外源基因导入到植物体内,以改善植物的某些性状,而植物转基因的前提条件是建立高效的植株再生系统。目前涉及悬铃木组织培养的研究很少,仅卫志明等(1991)曾对悬铃木原生质体培养再生植株做过相关报道,而对悬铃木叶片再生系统的研究未见报道。为此本实验探讨了各种因子对悬铃木组织培养和叶片再生芽诱导的影响,建立了稳定、高频的悬铃木再生系统。
1 材料与方法 1.1 实验材料所用材料为多年生悬铃木大树上的幼嫩枝条,采自山东农业大学校园。
1.2 实验方法 1.2.1 无菌苗的获得在3—4月份从成年大树的幼嫩枝条上摘取开始萌发的悬铃木叶芽,经常规消毒后接种到原始培养基(MS+0.2 mg·L-1 6-BA+0.1 mg·L-1 NAA)上,作为供试材料备用。
1.2.2 最适培养条件的筛选取生理条件相近的组培苗、叶片外植体置于附加不同种类、浓度植物激素的培养基上培养,观察各种因子对悬铃木扩繁、分化、壮苗及生根的影响。
1.3 培养条件无菌苗外植体培养于150 mL的三角瓶中,光照培养。叶片外植体在接种前需要在远轴面上划3刀,远轴面向下与培养基接触,培养于90 mm的培养皿和100 mL的三角瓶中。叶片外植体接种在不定芽分化培养基上,如无特殊说明,所有培养均为暗处理7 d后,转入光下培养。暗培养在25℃黑暗条件下进行,光照培养在光照强度1 500 lx,光周期16 h,温度25℃下进行。
1.4 数据统计无菌苗外植体培养1个月后,统计褐变率(褐变率=褐变外植体数/总外植体数×100%),每种处理至少调查20个外植体,重复2次以上。叶片在再生培养基上培养40 d后,调查叶片不定芽分化率(叶片不定芽分化率=出芽叶片数/接种总叶片数×100%)和叶片平均再生芽位点数(叶片平均再生芽位点数=叶片再生芽位点数/再生芽叶片总数),每种处理至少调查30个外植体,重复2次以上。
2 结果与分析 2.1 悬铃木组培苗的获得 2.1.1 褐化问题的解决在培养初期,经过消毒后而存活的悬铃木幼芽外植体长势差,多有褐化现象,影响了组培苗的继代扩繁,成为系统研究悬铃木再生体系的重大障碍。本研究中主要采取了选择最佳的培养基、在培养基中加入抗氧化剂或吸附剂、增加培养基的琼脂浓度及采用透气性好的封口材料(如羊皮纸)等措施防止外植体褐化,这些措施都对防止褐化产生了不同的效果,尤以在培养基中加入抗氧化剂或吸附剂的效果最为明显。参照相关资料(李浚明,1998),本实验中选用不同的抗氧化剂或吸附剂加入到X4培养基(MS+ 0.5 mg·L-1 6-BA+0.05 mg·L-1 NAA+30 mg·L-1Ad)中进行对比实验,结果表明多数添加剂能减轻悬铃木褐化的程度,但不同的添加剂改善褐化的效果不同(表 1),以加入活性碳的培养基的效果最好。悬铃木在加入活性碳的培养基中生长良好,叶色正常,解决了外植体的褐化现象,成功地通过了驯化期。
|
|
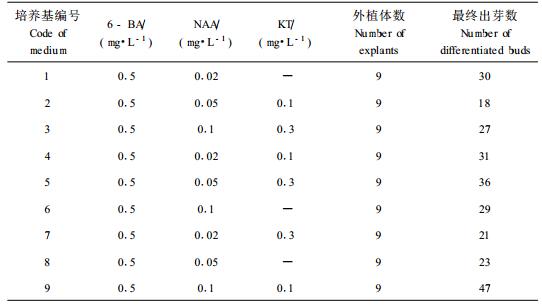
以MS为基本培养基,附加3种常用的激素:6-BA、NAA、KT,其中NAA、KT各设3个浓度梯度,设计正交实验,共产生9种培养基配方。将大小相近的悬铃木组培苗分别转到上述9种培养基上,在7 d、14 d、21 d后观察生长、分化情况,统计分化芽数。
不同激素组合表明(表 2),无菌苗的分化是由生长素、细胞分裂素共同协调作用的结果。其中2号培养基分化效果最差,外植体生长停滞,叶片褐化萎缩;1、3、6号培养基上的外植体虽然能产生一定数目的分化芽,但分化芽小,外植体枯黄;7、8号培养基分化产生的分化芽比较高大,但是数目少;4、5、9号培养基产生的分化芽较多,分化芽发育正常,叶色好,尤以在含0.5 mg·L-1 6-BA、0.1 mg·L-1 NAA和0.1 mg·L-1 KT的9号培养基上生长的外植体最终分化好,产生出丛生芽群,长势旺盛,9号培养基可选做扩繁培养基。
|
|
取悬铃木叶片为材料,背部划3刀,置于分化培养基上培养,5 d后叶片体积开始增大,在培养过程中边缘向远轴面卷曲。15 d左右露出芽点,不定芽出现的高峰期在接种后的20~30 d(图版Ⅰ-1~3)。多数不定芽的形成并不经历愈伤组织阶段, 直接从培养的叶片外植体上分化产生,通常不定芽成簇密集生长,不定芽再生位点散布在叶片的各个部位,以切口部位较多。再生的不定芽较小,经过壮苗培养可以长成小植株。在本实验中,芽分化率可达98%以上。

|
图版Ⅰ Plate Ⅰ 1.刚接种于分化培养基上的叶片外植体;2.培养的叶片外植体开始分化;3.许多不定芽在培养的叶片表面形成;4.三角瓶中产生的分化芽;5.由分化芽长成的植株;6.生根的再生植株。 1. Leaf explants just placed on differentiation medium; 2. Cultured leaves initiated to differentiation; 3. Many adventitious buds formed on the surface of cultrued leaves; 4. Differentiated buds in flask; 5. Differentiated buds grew up to normal plantlets; 6. Rooted plantlets. |
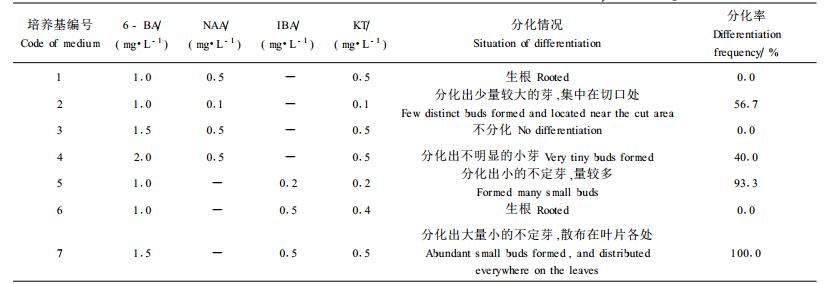
在MS基本培养基中加入不同的激素,配制成多种培养基,以生长良好的叶片为外植体,筛选分化效果好的培养基。由表 3看出,培养基中的激素成分及配比对不定芽的分化至关重要,细胞分裂素对生长素的含量比值高利于生芽(2、5、7号培养基),比值低则利于生根(1、6号培养基)。另外,实验表明以NAA为生长素的培养基叶片分化效果明显低于以IBA为生长素的培养基,由3号与7号培养基比较看出,在相同激素浓度下NAA使叶片生根,IBA使叶片长芽,故NAA对悬铃木不定芽的诱导效果差。本实验最终以附加1.5 mg·L-1 6-BA, 0.5 mg·L-1IBA和0.5 mg·L-1 KT的培养基作为分化培养基。
|
|
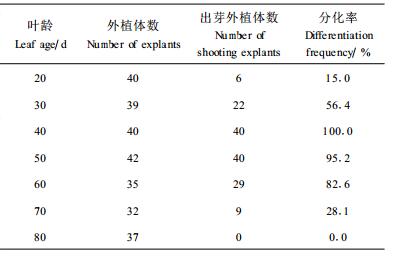
无菌苗的叶龄、叶片大小及生长位置都对不定芽分化率有影响。叶龄对外植体再分化的影响已有多人进行了研究(曹冬孙等,1993;王玉文,1991;De Bondt et al., 1996;Raviv et al., 1987),都认为较低叶龄的外植体容易脱分化、再分化形成芽,可获得较高的出芽率。表 4表明:叶龄为35~60 d的悬铃木试管苗叶片适于再生,40 d叶龄的叶片分化率最高。生长初期的试管苗叶片少且未充分展开,出芽率低;而无菌苗叶龄增大到一定程度,柔嫩度降低,叶片中纤维含量会增大,叶片逐渐木质化,芽的分化率迅速下降。
|
|
在实验中还同时发现,考虑叶龄的同时还要考虑叶片大小,因为相同叶龄不同大小的叶片芽分化率差异显著。太小的叶片很难形成不定芽,这可能是因为小叶片发育不好,生理状况不合适,而且叶片面积小,不能吸收到足够的养分和激素,从而达不到成芽的要求,难以激发芽的形成。最适于分化的叶片的长度一般为3 cm以上,以离顶端分生组织较近的第3~4片展开嫩叶为好。
获得较大的嫩叶是提高悬铃木芽分化率的关键之一。本实验通过大量比较发现MS基本培养基能起到快速增大叶片的作用,将高3 cm以上的无菌苗转到该培养基上培养,2周后就能得到符合要求的分化用叶片。
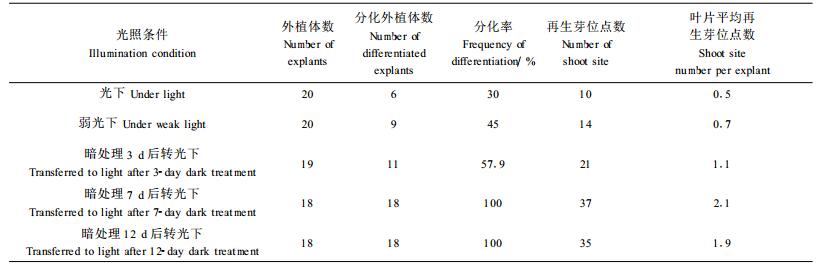
2.2.4 光照对芽分化的影响在许多植物中都发现经历暗培养可以促进不定芽的形成(Jemes et al., 1988), George(1993)认为暗处理可减少外植体酚类物质的溢出,利于不定芽的分化。本实验对光照与分化的关系进行了研究,将生理状况相似的叶片置于同一种分化培养基上,分别做如下处理: ①在正常光下; ②在弱光下; ③暗处理3 d后转正常光下;④暗处理7 d后转正常光下;⑤暗处理12 d后转正常光下。连续观察,比较结果。
实验结果表明(表 5),光照条件对悬铃木叶片分化很重要,暗处理能显著提高叶片的分化率,每个叶片外植体上的再生芽位点数也多。暗处理的时间以7 d为宜。虽然暗处理12 d与暗处理7 d差别不大,但暗处理12 d的叶片长出不定芽所需的时间长,故延长暗处理的时间是没有意义的。
|
|
试验中分别以培养皿和用聚氯乙烯膜封口的三角瓶为培养容器,比较对悬铃木叶片分化的影响。结果表明,2种容器对叶片分化的影响差别不大。但以后者为培养容器可得到较大的芽(图版Ⅰ-4),许多不需经过芽伸长培养即可成苗。而培养皿的表面积大,以其为容器可植入较多的叶片,能节省培养基,利于对大量外植体进行系统研究。
2.2.6 外植体密度对芽分化的影响研究过程中发现培养基上的外植体密度不宜过大。在直径为90 mm的培养皿中以放入8~10片叶为宜,在100 mL三角瓶中可接种4~5片叶,太多的叶片会相互竞争空间和养分,导致叶片分化率降低。
2.3 影响悬铃木分化芽生长的因素使悬铃木从分化芽长成健壮植株受许多因素的控制。
2.3.1 激素浓度将诱导出的丛生芽转移到4种培养基上培养,一个月后观察结果(表 6)。从中可以发现低激素浓度利于芽伸长,其上生长的植株较高、叶片也大(培养基1、2);而高激素浓度利于芽的分化,可使不定芽基部分化出丛生的小芽(培养基3、4)。附加0.3 mg·L-1 6-BA, 0.05 mg·L-1 NAA, 30 mg·L-1Ad的2号培养基芽伸长效果好,可作为芽伸长培养基(图版Ⅰ-5)。
|
|
经实验证明在琼脂浓度较高的偏硬的培养基上组培苗叶片小,生长缓慢。当琼脂浓度为5.5 g·L-1时,培养基偏软,培养容器内湿度大,利于苗成长,植株生长快,长势好,故该琼脂浓度适于悬铃木壮苗。当琼脂浓度在5 g以下时,培养基呈半固体或流体状,难以支持植株在其上生长,并且外植体基部会产生大量愈伤组织团块,植株矮小。
2.3.3 封口材料分别以聚氯乙烯薄膜与羊皮纸做封口材料密封用于组培的三角瓶瓶口,经比较发现聚氯乙烯薄膜能保持瓶内湿度,植株拔高好,叶色翠绿,并能延长培养基的更换周期(可维持近2个月);而以羊皮纸封口的外植体长势差,叶色发黄,枯死的叶片较多,培养基1个月就干了,需及时更换。由此表明,要获得较理想的组培苗应使培养容器内保持较高的相对湿度。
2.3.4 外植体的密度以150 mL的三角瓶为培养容器,对比实验表明:每瓶接种的外植体数应为5棵左右,过于稀疏的密度会浪费培养基,而且这些外植体往往生长不好,主要表现为植株矮小、分化差、生长缓慢。这也许是组培悬铃木的生长有群体效应,彼此能相互促进,更好地适应所处的环境。但外植体又不宜太密,尤其是用聚氯乙烯膜封口时外植体会出现大量突然玻璃化坏死的现象,这可能是因为封口膜透气性差,而数量较多的组培苗代谢、呼吸旺盛,导致养分大量消耗,氧气供应不足,积累有害气体,使悬铃木集体死亡。
2.4 悬铃木组培苗根的诱导 2.4.1 培养基的筛选由表 7可以看出:以1/2MS为基本培养基利于悬铃木分化生根,R5、R6、R7的生根效果明显好于以MS为基本培养基的R1、R2、R3、R4。细胞分裂素的存在不利于生根,比较R5、R6、R7这3种同样以1/2MS为基本培养基的培养基可以看出,在R6、R7中虽然细胞分裂素所占的比例很低,但生根效果不理想,而完全没有分裂素的R5培养基对根的诱导效果好,可作为生根培养基。
|
|
实验结果表明较低的琼脂浓度利于悬铃木生根。悬铃木组培苗在琼脂浓度较低的生根培养基上生根速度快,悬铃木在含5 g·L-1琼脂的生根培养基上只需要14 d便可生出根(图版Ⅰ-6)。但琼脂浓度不能过低,应以能固定住材料使其直立生长为限,否则,外植体无法正常生长。
3 讨论悬铃木幼苗在组培初期极易发生褐化现象,难以扩繁继代,是研究悬铃木再生体系的早期障碍。褐化是由于植物受伤后体内多酚氧化酶被激活,使酚类物质氧化产生醌类物质造成的,它们会逐渐扩散到培养基中,抑制其它酶的活性,毒害整个外植体组织。在植物组织培养中,过高的无机盐、蔗糖浓度会引起外植体的褐变;激素使用不当时,材料也容易褐变;另外,培养条件不适宜,如温度过高或光照过强,均可使多酚氧化酶的活性提高,从而加速被培养的组织发生褐化(曹孜义等,1996;宋平等,1988)。本项研究表明在培养基中加入抗氧化剂或吸附剂可以明显改善悬铃木的褐化,以在培养基中加入0.3%的活性碳效果最好。活性碳作为吸附剂可以吸附悬铃木因被氧化而产生的醌类物质,减轻对外植体的毒害作用。
影响悬铃木叶片植株再生的因素很多,如植物激素、叶片因素、光照条件、外植体密度等。悬铃木的再生对叶片外植体的要求非常高,只有生理状态适宜的叶片才能得到理想的分化效果。处于植株顶端叶色嫩绿、生长旺盛、并且充分展开的叶片最宜于再生不定芽。研究表明,长度在3 cm以上的40 d叶龄的叶片分化率最高,以同时距离顶端分生组织较近的第3~4片展开嫩叶为最佳。另外,激素浓度也很重要。实验表明,在分化过程中,细胞分裂素与生长素的浓度比尤为重要,它决定分化的方向。当比值低于5时,悬铃木叶片不分化或分化产生根;当比值为6~10时,可以分化产生芽。实验证明IBA诱导不定芽分化的效果好于NAA。
曹岸平. 2000. 少果球悬铃木良种在城市绿化中的运用. 中国园林, (4): 76. DOI:10.3969/j.issn.1000-6664.2000.04.028 |
曹冬孙, 贾士荣. 1993. 青椒子叶培养及植株再生. 园艺学报, 20(2): 171-175. DOI:10.3321/j.issn:0513-353X.1993.02.014 |
曹孜义, 刘国民. 1996. 实用植物组织培养技术教程. 兰州: 甘肃科学技术出版社, 43-44.
|
李浚明. 1998. 植物组织培养教程. 北京: 中国农业大学出版社, 345-346.
|
沈国华, 汪企明, 蒋慎法, 等. 1995. 应用化学药剂控制悬铃木飞毛污染的研究. 江苏林业科技, 22(4): 1-5. |
宋平, 沈丙辉. 1988. 活性碳培养基对棉花愈伤组织诱导的效果. 植物生理学通讯, (5): 47-48. |
王玉文, 杨美珠, 陈章良, 等. 1991. 甜椒的离体培养再生及基因转化. 植物学报, 33(10): 780-786. |
卫志明, 许智宏, 许农, 等. 1991. 悬铃木叶肉原生质体培养再生植株. 植物学报, 33(11): 813-818. |
章利民. 2000. 悬铃木修剪控果技术. 江苏林业科技, 27(3): 37-38. |
郑万钧. 1985. 中国树木志. 北京: 中国林业出版社, 1923-1926.
|
周业恒, 江守和, 鲁润龙, 等. 1993. 悬铃木无球果育种的研究. 园艺学报, 20(3): 295-298. DOI:10.3321/j.issn:0513-353X.1993.03.023 |
De Bondt A, Eggermont K, Penninckx I, et al. 1996. Agrobacterium-mediated transformation of apple: an assessment of factors affecting regeneration of transgenic plants. Plant Cell Rep, 15: 549-554. DOI:10.1007/BF00232992 |
George E F. Plant propagation by tissue culture Part I: The technology. Basingstoke, UK: Exegetics Ltd., 1993
|
Jemes D J, Passey A J. 1988. Factors affecting high frequency plant regeneration from apple tissues cultured in vitro. Plant Physiol, 132: 148-154. DOI:10.1016/S0176-1617(88)80152-4 |
Raviv M, Reuveni O, Goldschmidt E. 1987. The physiological basis for loss of root ability with age in avocado seedlings. Tree Physiol, 3: 115-122. DOI:10.1093/treephys/3.2.115 |
 2004, Vol. 40
2004, Vol. 40