文章信息
- 齐力旺, 韩一凡, 韩素英, 王建华, Dietrich Ewald.
- Qi Liwang, Han Yifan, Han Suying, Wang Jianhua, Dietrich Ewald.
- 麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响
- Effects of Maltose, NAA and ABA on Somatic Maturation and Radicle Rooting of Larix principis-rupprechtii
- 林业科学, 2004, 40(1): 52-57.
- Scientia Silvae Sinicae, 2004, 40(1): 52-57.
-
文章历史
- 收稿日期:2003-06-30
-
作者相关文章
2. 德国联邦林业研究中心,林木育种与生物技术研究所 Eberswalder Chaussee 6, 15377
2. Federal Research Centre for Forestry, Institute for Forestry Tree Breeding and Biotechnology Eberswalder Chaussee 6, 15377 Waldsieversdorf, Germany
植物体细胞胚胎发生是细胞工程中植株再生及体外快速繁殖的重要途径,研究植物无性系的细胞起源调控和发育,有利于阐明植物有性胚及无性胚的发生机理,是研究植物细胞全能性、分化及其形态建成的理想实验体系,也是进行遗传转化(Ellis, 1995;Levee et al., 1997)获得全能性原生质体再生植株和快速繁殖的重要手段,且在今后树木的大量繁殖、品种改良、林木更新、沙漠改造等方面均有很大现实意义和经济效益。针叶树的体细胞胚胎发生研究始于20世纪70年代后期,80年代后期得到迅速发展,获得很大进展;但作为针叶树中最大的松属(Pinus)(Becwar et al., 1990;Gupta et al., 1987;Jain et al., 1989)和落叶松属(Larix) (Ewald et al., 1995;齐力旺等,2001)等主要造林、用材树种的体细胞胚胎发生仍有很大困难。众所周知,植物细胞胚胎发生的首要环节是获得胚性愈伤组织,这与外植体的胚性感受态密切相关(黄路等,1999);然而,不同类型的胚性愈伤组织发生体细胞胚的能力差异很大,ABA被认为是体细胞胚成熟的关键因子(Ammirato, 1974;Kamada et al., 1981;Rajasekaran et al., 1987;黄学林等,1995),其作用主要是促进体细胞胚成熟,防止裂生多胚现象,并与畸形胚的发生相关。此外,Li等(1998)还进行了麦芽糖与PEG对火炬松(Pinus taeda)体细胞胚成熟的研究,取得较大进展,对控制畸形胚的发生和体细胞胚正常生根均有显著影响。相对而言,落叶松的体细胞胚胎发生相对较难,再生更属不易,其中除了胚性愈伤组织的诱导、筛选体细胞胚成熟培养基外,究其主要根源是胚状体根系发育不良,这也是众多针叶树体细胞胚发生及微体快繁中极为棘手的问题。随着基因工程育种研究工作的日臻完善,通过体细胞胚胎发生途径进行目的基因的遗传转化,已经成为介导针叶树种基因转化可行的主导体系。为此,调控体细胞胚成熟、完善体细胞胚生根体系,提高针叶树体细胞胚的成苗率,成为很多学者研究的关键技术之一。本文在进行华北落叶松(Larix principis-rupprechtii)胚性愈伤组织诱导、体细胞胚成熟、基因转化研究的同时,针对华北落叶松发生体细胞胚后成苗率不高、难以产生健康完整植株的重要问题,研究了影响华北落叶松体细胞胚成熟及生根的关键因子。
1 材料与方法 1.1 实验材料于6月中、下旬, 采取优良单株华北落叶松未成熟球果子叶前合子胚作为外植体。取出种子,70%酒精浸泡1 min、0.1%升汞溶液消毒6 min,无菌水冲洗5次;取出种仁,将嫩胚连同长长的胚柄一起接种于诱导培养基上,每皿接种25个,3次重复。材料在23~25℃条件下暗培养,15~25 d时根据诱导愈伤组织颜色、形态、结构等特征以及显微观察结果区分出白色半透明的胚性愈伤组织,18~25 d继代一次,继代培养用S+B(H3BO3由S培养基的3.1 mg·L-1增加至7.75 mg·L-1)培养基,附加2, 4-D、BA、KT依次减少为原来的1/2、1/5、1/10。继代时收集组织块表面分化的新鲜愈伤组织,选用一个胚性细胞系作为实验研究材料。
1.2 培养基 1.2.1 诱导培养基基本培养基为S(Ewald et al., 1995);诱导培养基为S基本培养基上附加2, 4-D 0~2.2 mg·L-1,BA、KT各0~0.8 mg·L-1,诱导胚性愈伤组织。
1.2.2 增殖培养基(1) S+B+2, 4-D 0.11 mg·L-1+BA 0.04 mg·L-1+KT 0.02 mg·L-1(简称D);(2) S+B+NAA 0.5 mg·L-1+BA 0.04 mg·L-1+KT 0.04 mg·L-1(简称N);附加肌醇10 g·L-1、酪氨酸500 mg·L-1、水解酪蛋白(CH)500 mg·L-1、谷氨酰胺450 mg·L-1、蔗糖3%、琼脂粉(Sigma公司)0.3%,pH 5.7。
1.2.3 体细胞胚成熟培养基用S+B分别加ABA 10、16、20、27.3、32、40 mg·L-1,均加入PEG4000 7.5%、AgNO3 5 mg·L-1、CH500 mg·L-1、谷氨酰胺450 mg·L-1、肌醇1g·L-1、蔗糖2.5%、琼脂粉0.3%,pH 5.7,温度23~25℃,暗培养。
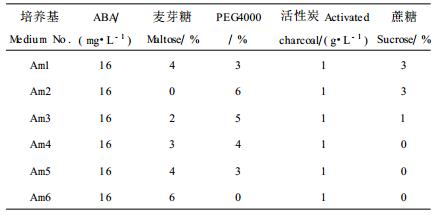
1.2.4 麦芽糖、PEG培养基S+B+表 1设计。
|
|
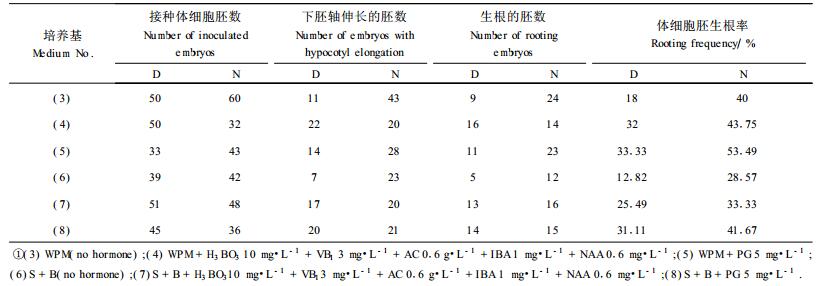
(3) 无激素的WPM培养基;(4)WPM+H3BO3 10 mg·L-1+VB1 3 mg·L-1+活性碳(AC) 0.6 g·L-1+IBA 1 mg·L-1+NAA 0.6 mg·L-1;(5)WPM+间苯三酚(PG) 5 mg·L-1;(6)无激素的S+B培养基;(7)S+B+H3BO3 10 mg·L-1+VB1 3 mg·L-1+AC 0.6 g·L-1+IBA 1 mg·L-1+NAA 0.6 mg·L-1;(8)S+B+PG 5 mg·L-1;附加蔗糖2.5%、琼脂粉0.3%,pH 5.7,光照强度1 600 lx,温度25℃。
1.3 培养方法将诱导培养基上产生的胚性愈伤组织分别转入含0.11 mg·L-1 2, 4-D的D培养基和含0.5 mg·L-1NAA的N培养基上继代增殖,继代2次后进行显微观察、照相,以观察早期原胚发育状况。
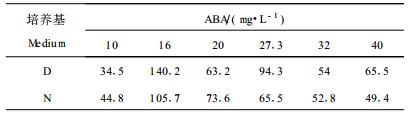
选取D和N培养基上培养40 d左右的华北落叶松胚性愈伤组织,分别转入含不同浓度的ABA的成熟培养基上,每培养皿接种1.0 cm×1.0 cm×1.0 cm的愈伤组织5块,58 d后分别统计并计算体细胞胚的成熟频率:成熟频率=落叶松子叶胚数(个)/新鲜愈伤组织(g)。
将上述成熟培养基上产生的成熟体细胞胚,转入萌发培养基(3)、(4)、(5)、(6)、(7)、(8)上萌发培养,再生完整植株,统计生根率:生根率=生根数/接种体细胞胚数。
另外,选择D、N培养基上增殖40 d的华北落叶松胚性愈伤组织,分别转接于含有不同浓度的麦芽糖和PEG4000的培养基上,58 d后,统计子叶胚成熟频率。
2 实验结果 2.1 华北落叶松胚性愈伤组织的诱导华北落叶松未成熟胚接种在诱导培养基上培养7 d后,外植体膨大,颜色变化明显,10~15 d即有不同类型的愈伤组织产生:一种是顶部先膨大,随后从基部产生白色略黄、透明的丝状愈伤组织,为胚性愈伤组织,细胞质很浓,呈黑色,先横向分裂出胚头,再纵向分裂出胚柄;另一种是顶部膨大产生的浅黄白色、结构稍松、质地软、颗粒状愈伤组织,为非胚性愈伤组织;10~15 d左右,可见从膨大的胚乳处有细丝结构、透明晶亮的愈伤组织产生并不断增殖,在解剖镜下,可观察到细长结构、带有胚柄的细胞团,并明显可见许多早期原胚,称为胚性胚柄复合物,该愈伤组织经显微镜检为二倍体,表明是从胚发育而来(齐力旺等,2001)。
2.2 NAA替代2, 4-D后对华北落叶松胚性愈伤组织的影响将诱导培养基上产生的胚性愈伤组织,分别转入含有2, 4-D的D培养基和含NAA的N培养基上继代、增殖,进行早期原胚的诱导发育培养。研究发现:在D培养基上,胚性愈伤组织生长速度较快,白色、浅棕色愈伤组织均具有粘性,愈伤组织的表面,仍有一些丝状结构,经二次继代后在显微镜下可观察到很多的多细胞早期原胚及一些正在发育中的后期原胚,但有一部分早期原胚发育不太好,胚头小(图版Ⅰ-1);在N培养基上的胚性愈伤组织,生长速度比D培养基上稍慢,白色至浅黄色,粘软结构,40 d后显微镜下可观察到早期原胚,早期原胚的发育比D培养基上稍好,胚头较大(图版Ⅰ-2),且大小较均一,表明0.5 mg·L-1的NAA配合0.04 mg·L-1 BA和0.02 mg·L-1 KT的组合,比0.11 mg·L-1 2, 4-D配合0.04 mg·L-1BA和0.02 mg·L-1KT组合的培养基,更有利于华北落叶松早期原胚的发育。发育良好的早期原胚,在成熟培养基条件合适的情况下,更有可能提高成熟频率和转植株率。

|
图版Ⅰ Plate Ⅰ 1.在2, 4-D培养基上形成的早期原胚;2.在NAA培养基上形成的早期原胚;3.华北落叶松子叶胚;4.体细胞胚发芽、下胚轴正常伸长;5.不正常体细胞胚产生愈伤组织、出现玻璃化:6.正常华北落叶松体细胞胚生根;7.在同一萌发培养基上的正常胚(上)与不正常胚(下)。 1. Early stage proembryos of L. principis-rupprechtii from 2, 4-D medium; 2. Early stage proembryos of L. principis-rupprechtii from NAA medium; 3. The somatic embryos of L. principis-rupprechtii; 4. Embryos germination and elongation of hypocotyl in L. principis-rupprechtii; 5. Callus vitrification from abnormal embryos; 6. Rooting from normal somatic embryos; 7. Normal (up) and non-normal embryos(down) on the same germination medium. |
将2.1中经D和N培养基上培养40 d后,带有早期原胚的愈伤组织分别转入含有不同浓度ABA的成熟培养基上。经20 d培养,愈伤组织逐渐由半透明的白色变为浅黄色,表面变得较为致密、稍颗粒状;30 d后,在愈伤组织的表面出现一些浅黄色、光滑突起(图版Ⅰ-3)。随着进一步发育培养,这些突起纵向伸长、呈圆柱状;45 d左右,这些圆柱状物已明显发育成一顶端有子叶的幼小体细胞胚。58 d后观察体细胞胚发生数量(表 2)。
|
|
由表 2可见,来源于D、N培养基上的愈伤组织,都是在ABA 16 mg·L-1的成熟培养基上体细胞胚产生数量最多,ABA 20 mg·L-1的培养基上次之,在ABA为10 mg·L-1的成熟培养基上产生数量最少;来源于N培养基上的愈伤组织在成熟培养基上,其体细胞胚产生数量,当ABA浓度大于20 mg·L-1时,随着ABA浓度的增加,体细胞胚数量减少。相对而言,来源于D培养基上的体细胞胚发生数量比来源于N培养基上的为多,体细胞胚发生时间较早,少数在培养32 d后就可见体细胞胚发生,子叶很快展开,但不正常体细胞胚较多,大小不匀,下胚轴短、肿大,子叶卷曲、有玻璃化现象(图版Ⅰ-5),多重胚明显较多,有一部分胚停止在圆球状而不再进一步形成子叶;而来源于N培养基上的愈伤组织,虽然在体细胞胚发生数量上少于D培养基,但体细胞胚质量明显好于D培养基上产生的体细胞胚,体细胞胚大小较均一,正常胚明显较多。表明在只含NAA不含2,4-D的培养基上继代,可以明显提高成熟胚的质量,对于成熟胚萌发根、再生完整植株很有利。
挑取上述成熟培养基中产生的子叶胚(图版Ⅰ-3),转入体细胞胚萌发培养基中。约5 d左右,体细胞胚膨大,子叶由黄开始转绿;10 d左右,子叶转为翠绿色,逐渐张开,下胚轴伸长(图版Ⅰ-4),并在基部产生微小的红色根尖;半个月左右,嫩白根伸长,一个月左右根系伸长0.5~1 cm左右。在萌发培养基上生根数量见表 3。
|
|
表 3表明,来源于D培养基和N培养基上的愈伤组织,产生的体细胞胚生根率,二者都是在WPM+间苯三酚5 mg·L-1的培养基上最好,分别为33.33%和53.49%;在WPM+H3BO3 10 mg·L-1+VB1 3 mg·L-1+AC 0.6 mg·L-1+IBA 1 mg·L-1+NAA 0.6 mg·L-1的培养基上次之,最差的为无激素S+B培养基,生根率为28.57%;S+B+间苯三酚5 mg·L-1比S+B培养基上,生根率明显高,说明间苯三酚对华北落叶松成熟胚的下胚轴伸长、根发生及再生完整植株有明显的促进作用。同时,一定浓度的H3BO3、活性碳(AC)、IBA及NAA的综合作用对华北落叶松成熟胚根发生及发育有促进作用。另外,同一萌发培养基上,来源于N培养基上体细胞胚的生根率也明显高于D培养基上产生的体细胞胚,在培养基(5)上,来源于N培养基上的体细胞胚生根率为53.49%,而来源于D培养基上的为33.33%。在培养基(6)上,来源于N培养基上的体细胞胚的生根率为28.57%,而来源于D培养基上的为12.82%。同时,来源于N培养基上的体细胞胚,在再生植株的质量上优于来源于D培养基上的体细胞胚,经D培养基上培养后,产生的一部分植株子叶肥厚、有玻璃化现象,成为限制华北落叶松体细胞胚应用的关键因子,表明2, 4-D诱导时间过久会使体细胞胚顶端分生组织发育不良(黄学林等,1995)。
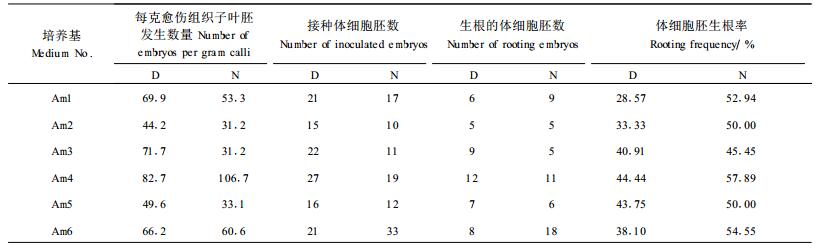
2.4 麦芽糖对华北落叶松体细胞胚成熟及生根的影响将N、D培养基上培养40 d的愈伤组织,转入含有不同浓度的麦芽糖和PEG4000的成熟培养基上,经过4~7周培养,在愈伤组织表面,陆续形成体细胞胚,不同培养基上的体细胞胚成熟频率见表 4。
|
|
由表 4可见,在ABA浓度适宜的情况下,来源于D和N培养基上的愈伤组织,二者都是在3%麦芽糖配合4%PEG4000、蔗糖为0时,体细胞胚成熟频率最高,分别为每克愈伤组织82.7个子叶胚与106.7个子叶胚。体细胞胚成熟培养基中,用麦芽糖代替蔗糖,即麦芽糖和PEG4000组合要比以前常用的蔗糖和PEG4000组合好,不但明显提高了体细胞胚成熟频率,而且使体细胞胚发生时间提前一周;同时体细胞胚质量明显改善,体细胞胚比在蔗糖中体积小,大小均一,多重胚很少,且大多数体细胞胚的下胚轴较长,没有膨大,子叶不提前展开,状似“子弹形”的长型体细胞胚多;比较而言,在蔗糖和PEG4000组合的培养基上产生的体细胞胚,下胚轴较短的短胚较多,这关系到体细胞胚的根发生;另外一些异常胚,下胚轴膨大、基部产生愈伤组织或子叶卷曲的现象明显多。
将上述Aml~Am6培养基上产生的成熟胚,接于无激素的WPM萌发培养基上,其体细胞胚生根数量如表 4,表明来源于D、N培养基上的愈伤组织,二者都是在3%麦芽糖和4%PEG4000的培养基上产生的体细胞胚生根率高,分别为44.44%和57.89%,且下胚轴健壮、根粗壮(图版Ⅰ-6)、子叶舒展;其次为麦芽糖6%、PEG4000和蔗糖均为0的培养基。另外,麦芽糖4%、PEG4000 3%、蔗糖3%的组合,根发生也较好。实验表明,麦芽糖3%配合PEG4000 4%、无蔗糖时,能显著提高华北落叶松体细胞胚的成熟频率和根发生频率,且产生的体细胞胚质量较高。
3 讨论Levee(1997)用杂种落叶松(Larix×leptoeuropaea)未成熟合子胚诱导体细胞胚发生,在早期子叶期观察到55%的体细胞胚发生,在含有ABA和糖的12种培养基上,能够提高体胚成熟的质量,只有20、40和60 μmol ABA, 1 μmol IBA以及0.1或0.2 mol蔗糖的培养基上可以进行其发育,每克鲜重的胚性培养物诱导体细胞胚数量受胚性细胞系、蔗糖浓度和ABA浓度影响。研究表明:华北落叶松体细胞胚成熟频率和根发生频率的高低,受很多因子影响,并不仅仅只与成熟培养基的成分及诱导条件有关。初期胚性愈伤组织的诱导、增殖、继代培养基中,生长素的种类及浓度对体细胞胚成熟频率和根发生频率有重要的影响,胚性愈伤组织在不含2, 4-D只含低浓度NAA(0.5 mg·L-1)、配合低浓度的BA(0.04 mg·L-1)和KT(0.04 mg·L-1)的培养基上继代培养,对于提高体细胞胚发生频率、提高根发生频率是十分有益的。2, 4-D作为华北落叶松胚性愈伤组织初始诱导是必需的,但长期在含有高浓度2, 4-D的培养基上继代,会导致体细胞胚成熟能力的丧失(Tautorus et al., 1991)。导致体细胞胚质量下降的原因,可能是2, 4-D影响了体细胞胚内储藏蛋白质的积累。继代过程中用NAA代替2, 4-D明显提高了成熟胚的质量,提高了生根比率和转植株率,减少了多重胚、畸形胚比例,在以前有关落叶松体细胞胚胎发生的研究中未见报道。
成熟胚转入萌发培养基后,下胚轴能否正常伸长、根系能否发生并健壮伸长生长,不仅与初期诱导、继代、成熟培养基的成分以及培养条件有关,而且与萌发培养基中的基本培养基种类与激素及附加物有关。以往有关体细胞胚萌发的报道,萌发培养基多数用与诱导培养基相同的基本培养基,且不附加任何激素,本次试验表明,华北落叶松体细胞胚萌发培养基用WPM基本培养基比S或S+B好,且培养基中附加低浓度的IBA、NAA、硼酸和间苯三酚明显促进根的发生。由于体细胞胚在发育上的不同步性,导致在萌发培养基上的成熟胚所处的根发生阶段不同,甚至有些体细胞胚无根原基,这样低浓度的生长素和硼酸配合,对体细胞胚根的发生很有利。另外,培养基中加入间苯三酚,明显促进体细胞胚生根,这与本试验中华北落叶松组培无根苗生根的结论是一致的。
蔗糖、PEG作为碳源和渗透调节剂,能促进植物体细胞胚成熟,在云南松(Pinus yunnanensis)、青NFDE1 (Picea wilsonii)、白NFDE1 (Picea meyeri)(杨金玲等,1997)中被应用,本次试验中以6%的PEG4000和3%的蔗糖获得了较好的成熟频率。同时,有一部分成熟的华北落叶松体细胞胚,下胚轴短且膨大,根发生不好(图版Ⅰ-7,下)。
在ABA适宜浓度的情况下,培养基中合适的碳源和渗透压常常是影响体细胞胚成熟频率的重要因素之一,针对以上问题,用麦芽糖代替蔗糖,实验表明,3%麦芽糖和4%的PEG4000的组合,体细胞胚成熟频率高,转植株率最高达57.89%,且更重要的一点是体细胞胚质量大大优于蔗糖和PEG4000组合,用麦芽糖诱导的体细胞胚,下胚轴较长、健壮无膨大、根系粗壮、无玻璃化现象(图版Ⅰ-7,上),体细胞胚大小均一,很少有多重胚发生,子叶舒展,无提前展开现象。在6%的麦芽糖、无蔗糖与PEG的培养基上,胚成熟频率、体细胞胚质量稍次于3%麦芽糖和4%PEG4000组合的培养基;华北落叶松体细胞胚成熟培养基,以4%的PEG4000作为渗透剂、3%的麦芽糖作为碳源代替蔗糖更能有效地提高其体细胞胚成熟频率和生根转植株率,Li等(1998)在火炬松(Pinus taeda)体细胞胚发生的研究中曾有类似的结果。
黄路, 卫志明. 1999. 不同基因型玉米的再生能力和胚性与非胚性愈伤组织DNA的差异. 植物生理学报, 25(4): 332-338. DOI:10.3321/j.issn:1671-3877.1999.04.004 |
黄学林, 李筱菊. 1995. 高等植物组织离体培养的形态建成及其调控. 北京:科学出版社: 150-205. |
齐力旺, 韩一凡, 李玲, 等. 2001. 应用311-A最优回归设计研究ABA、PEG4000及AgNO3对落叶松体细胞胚发生数量的影响. 生物工程学报, 17(1): 84-89. |
杨金玲, 桂耀林, 杨映根, 等. 1997. 白NFDE1体细胞胚胎发生及其植株再生. 植物学报, 39(4): 315-321. |
Ammirato P V. 1974. The effects of abscisic acid on the development of somatic embryos from cells of caraway (Carum carvi). Bot Gaz, 135: 328-337. DOI:10.1086/336769 |
Becwar M R, Nagmani R, Wann S R. 1990. Initiation of embryogenic cultures and somatic embryo development in Loblolly Pine. Can J For Res, 20: 810-817. DOI:10.1139/x90-107 |
Ellis D D. Transformation of Gymnosperms. In: Jain S, Gupta P K, Newton R(ed). Somatic embryogenesis in woody plant, 1995, Vol 1. Kluwer, Dordrecht, 1995: 227-251
|
Ewald D, Weckwerth W, Naujoks G, et al. 1995. Formation of embryo-like structures in tissue culture of different yew species. J Physiol, 147: 139-143. |
Gupta P K, Durzan D J. 1987. Biotechnology of somatic poly-embryogenesis and plantlet regeneration in Loblolly Pine. Biotechnology, 5: 147-151. |
Jain S M. 1989. Somatic embryogenesis in Slash Pine from immature embryos culture in vitro. Plant Sci, 65: 233-241. DOI:10.1016/0168-9452(89)90070-8 |
Kamada H, Harada H. 1981. Changes in the endogenous level and effects of abscisic acid during somatic embryogenesis of Daucus carota L. Plant & Cell Physiol, 22: 1423-1429. |
Levee V, Lelu M A, Jouanin L, et al. 1997. Agrobacterium tumefaciens-mediated transformation of hybrid larch (Larix kaempferi×L.decidua)and transgenic plant regeneration. Plant Cell Report, 16: 680-685. DOI:10.1007/s002990050301 |
Li X Y, Huang F H, Murohy J B et al. Polyethylene glycol and maltose enhance somatic embryo maturation in Loblolly Pine(Pinus taeda L.). In Vitro Cell Dev Biol-Plant, 1998, (Jan-March), 34: 22-26
|
Rajasekaran K, Hein M B, Vasil I K. 1987. Endogenous abscisic acid and indole-3-acetic acid and somatic embryogenesis in cultured leaf explants of Pennisetum purpureum Schum-Effects in vivo and in vitro of glyphosate, fluridone, and paclobutrazol. Plant Physiol, 84: 47-51. DOI:10.1104/pp.84.1.47 |
Tautorus T E, Fowke L C, Dunstan D I. 1991. Somatic embryogenesis in conifers. Can J Bot, 69: 1873-1899. DOI:10.1139/b91-237 |
 2004, Vol. 40
2004, Vol. 40