文章信息
- 肖祥希, 刘星辉, 杨宗武, 肖晖, 谢一青.
- Xiao Xiangxi, Liu Xinghui, Yang Zongwu, Xiao Hui, Xie Yiqing.
- 铝胁迫对龙眼叶片活性氧代谢及膜系统的影响
- EFFECT OF ALUMINUM STRESS ON ACTIVE OXYGEN METABOLISM AND MEMBRANE SYSTEM OF LONGAN (DIMOCARPUS LONGAN)LEAVES
- 林业科学, 2003, 39(专刊1): 52-57.
- Scientia Silvae Sinicae, 2003, 39(专刊1): 52-57.
-
文章历史
- 收稿日期:2003-03-21
-
作者相关文章
2. 福建农林大学园艺学院 福州 350002
 、H2O2等氧自由基的大量累积, 铝胁迫下龙眼叶片
、H2O2等氧自由基的大量累积, 铝胁迫下龙眼叶片 产生的速率提高了44.49%~ 443.48%, H 2O2含量增加了0.62 %~ 58.36%。
产生的速率提高了44.49%~ 443.48%, H 2O2含量增加了0.62 %~ 58.36%。 、H2O2等AOS累积的主要原因是铝胁迫破坏了细胞保护酶和抗氧化物质系统的协调性。SOD、POD、GR活性在低浓度铝胁迫时上升, 至0.370 mmol·L-1铝处理时达最大值, 而铝胁迫浓度>0.370 mmol·L-1则下降; 铝胁迫下, CAT活性不断下降, AsA-POD活性不断增加。铝胁迫导致AsA含量不断下降, GSH含量随铝胁迫浓度的增加而增加, 至0.740 mmol·L-1铝处理时达最大值, 铝浓度>0.740 mmol·L-1, GSH含量下降。
、H2O2等AOS累积的主要原因是铝胁迫破坏了细胞保护酶和抗氧化物质系统的协调性。SOD、POD、GR活性在低浓度铝胁迫时上升, 至0.370 mmol·L-1铝处理时达最大值, 而铝胁迫浓度>0.370 mmol·L-1则下降; 铝胁迫下, CAT活性不断下降, AsA-POD活性不断增加。铝胁迫导致AsA含量不断下降, GSH含量随铝胁迫浓度的增加而增加, 至0.740 mmol·L-1铝处理时达最大值, 铝浓度>0.740 mmol·L-1, GSH含量下降。2. College of Horticulture, Fujian Agriculture and Forestry University Fuzhou 350002
 、H2O2. The producing rate of
、H2O2. The producing rate of  was enhanced 44.49 %~ 443.48%, and the content of H2O2 0.62 %~ 58.36 %under aluminum stress.And the reason for the accumulation of AOS, such as
was enhanced 44.49 %~ 443.48%, and the content of H2O2 0.62 %~ 58.36 %under aluminum stress.And the reason for the accumulation of AOS, such as  , H2O2, was that aluminum stress damaged the harmony of cell' s protective enzyme and antioxidational substances.In addition, the activities of SOD, POD, and GR were enhanced as the concentration of aluminum increased, and they reached to the maximum when the concentration of aluminum was 0.370mmol·L-1.However, they decreased as the concentration of aluminum increased continually.The study also indicated that the activity of CAT decreased and the AsA-POD increased gradually under aluminum stress.Aluminum stress also reduced the content of AsA.The content of GSH increased as the concentration of aluminum was enhanced.And it reached to the maximum as the concentration of aluminum was 0.740 mmol·L-1, then it decreased when the concentration was enhanced continually.
, H2O2, was that aluminum stress damaged the harmony of cell' s protective enzyme and antioxidational substances.In addition, the activities of SOD, POD, and GR were enhanced as the concentration of aluminum increased, and they reached to the maximum when the concentration of aluminum was 0.370mmol·L-1.However, they decreased as the concentration of aluminum increased continually.The study also indicated that the activity of CAT decreased and the AsA-POD increased gradually under aluminum stress.Aluminum stress also reduced the content of AsA.The content of GSH increased as the concentration of aluminum was enhanced.And it reached to the maximum as the concentration of aluminum was 0.740 mmol·L-1, then it decreased when the concentration was enhanced continually.植物细胞能通过多种途径, 如分子氧单电子还原过程、某些酶催化过程和某些低分子化合物的自动氧化, 不断地产生
供试材料为福建龙眼主栽品种乌龙岭7个月苗龄的实生苗, 苗木从圃地取出移入培养液中经过2个月恢复培养后于2001年7月开始进行铝胁迫, 水培试验营养液采用李延1)的配方, 用1/4浓度进行培养, 容器采用外壁漆黑的塑料桶, 每桶3株, 每桶装培养液5 L, 每14 d更换1次培养液, 更换培养液时调节pH至4.2, 每天定时通气3次, 每次20 min。采用随机区组设计, 铝(Al3+)浓度设0(CK)、0.185、0.370、0.740、1.110、1.850 mmol·L-16个处理, 重复5次, 每个处理共15株。铝胁迫采用营养液中加铝的方法进行, 铝源用AlCl3·6H2O。胁迫5个月后采集叶样供活性氧代谢中相关酶类和相关物质含量的测定。
1) 李延.龙眼缺镁胁迫生理及调控技术研究.福建农业大学博士学位论文, 1999
1.2 方法 1.2.1 采样方法采样在早晨7:30—8:30之间进行。叶样均取自小苗顶端向下第2至第4片复叶。
1.2.2 细胞膜透性称取0.25 g左右直径为1.0 cm的龙眼叶圆片(20片), 置于20 mL去离子水中, 抽气20 min, 使叶圆片浸没于水中, 在25 ℃培养箱中振荡培养4 h后, 用HITACHI Z-6100原子吸收光谱仪测定K含量, 用HITACHI-3210分光光度计测定OD254, 得到大分子总渗漏值。
1.2.3 酶液提取称取叶样1.0 g, 分次加入5.0 mL 62.5 mmol·L-1pH 7.8 PBS(含1 %PVP), 于冰浴上匀浆, 15 000×g、4 ℃下离心20 min, 上清液用于酶活性及MDA含量的测定。酶液中蛋白质含量用Bradford(1976)方法测定, 以牛血清蛋白作标准曲线。
1.2.4 MDA含量的测定参照刘祖祺等(1994)的方法进行。取酶液2.0 mL, 加入2.0 mL 10 %TCA(含0.5 %TBA)混匀, 沸水浴15 min后快速冷却, 4 000 ×r·min-1离心20 min, 以10 %TCA(含TBA)为参比, 上清液在532和600 nm处测定OD值。
1.2.5 H2O2、
H2O2参照Patterson等(1984)的方法测定, 
SOD按Giannopolitis等(1977)的方法、CAT参照Klapheck等(1990)的方法、AsA-POD参照Nakano等(1981)的方法、GR参照Dhindsa(1991)的方法、POD参照刘祖祺等(1994)的方法测定。
1.2.7 AsA和GSH含量的测定1 g样品加入适量预冷的5 %TCA溶液, 在冰浴中研磨成匀浆, 15 000 × g下离心15 min。AsA含量测定:参照Arakawa等(1981)的方法进行, 取上清液1 mL加入1 mL 5 %TCA、1 mL EtOH(乙醇)、0.5 mL 0.4 %H3PO4-EtOH、1 mL 0.5 %邻菲啰啉-EtOH和0.5 mL 0.03 %FeCl3-EtOH, 在30 ℃下反应90 min, 在534 nm下测定OD534, 根据AsA标准曲线计算AsA含量。GSH含量测定:取上清液0.5 mL, 加入PBS(pH 8.0)2 mL, 蒸馏水1.5 mL, 以DTNB(2, 2 -硝基-5, 5 -二巯基苯甲酸)显色, 测定OD412, 根据GSH标准曲线, 计算GSH含量(Ellman, 1959)。
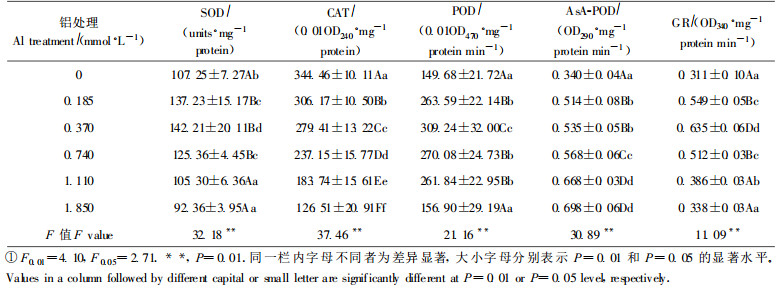
2 结果与分析 2.1 铝胁迫对龙眼叶片细胞膜透性的影响植物组织在受到逆境伤害时, 膜透性增加, 细胞内物质大量渗出(图 1、2)。铝胁迫下, K+和大分子渗漏值随铝胁迫浓度的增加而增加, K+渗漏值单位叶面积增加了1.3 ~ 13.9 μg, 增加幅度达到12.16 % ~ 132.35 %; 大分子渗漏值增加了10.43 %~ 100.08 %。可见随着铝胁迫浓度的增加, 细胞膜受到的伤害也越严重, 从而使膜透性不断增加。
|
图 1 铝对龙眼叶片K+渗漏值的影响 Fig. 1 Effect of Al on relative leakage value of K+ in leaves of Longan |

|
图 2 铝对龙眼叶片大分子渗漏值的影响 Fig. 2 Effect of Al on relative leakage value of macromolecules in leaves of Longan |
MDA含量是反映膜脂过氧化强弱的重要指标。铝胁迫下, MDA含量显著提高(图 3), 与对照相比较, MDA增加了5.85 %~ 89.54 %, 且随铝胁迫浓度的提高, 增加幅度不断提高。可见, 铝胁迫导致膜脂过氧化, 破坏了质膜的完整性, 导致K+和大分子物质大量外渗(图 1、2), 铝浓度越高, 膜脂过氧化程度越高, 质膜破坏越严重。MDA含量与K+、大分子渗漏值之间呈极显著正相关, 相关关系为:y(MDA)= 2.320 3x(K+渗漏值)+12.261 (R =0.97**), y(MDA)=43.334x(大分子渗漏值)+4.324 6(R = 0.98**)。

|
图 3 铝对龙眼叶片MDA含量的影响 Fig. 3 Effect of Al on content of MDA in leaves of Longan |

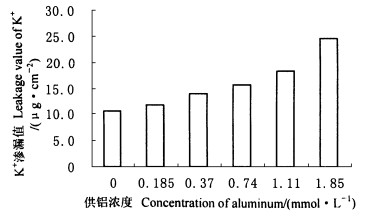
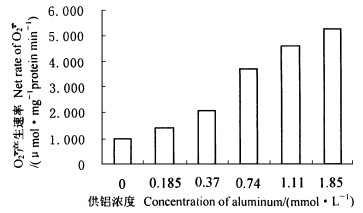
铝胁迫下, 龙眼叶片超氧自由基







|
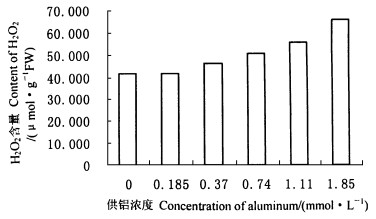
图 4 铝对龙眼叶片H2O2含量的影响 Fig. 4 Effect of Al on content of H2O2 in leaves of Longan |
|
图 5 铝对龙眼叶片  |
表 1可见, 铝胁迫下, SOD、POD、GR的活性随铝胁迫浓度的增加而增加, 至0.370 mmol·L-1铝处理时达最大值, 当铝浓度>0.370 mmol·L-1时, 则不断下降。0.185、0.370、0.740 mmol·L-1铝处理使得SOD活性分别比对照增加29.95 %、32.60 %、16.89 %, 而1.110、1.850 mmol·L-1铝处理则使得SOD活性分别比对照下降1.82 %、13.88 %。但铝胁迫各处理POD、GR的活性比对照都有所增加, SOD增加2.9 %~ 32.60 %, POD增加4.82 %~ 106.6 %, GR增加8.68 %~ 104.18 %。CAT活性在铝胁迫下呈不断下降的趋势, 与对照比, 下降11.12 %~ 63.27 %。相反, AsA-POD活性则呈不断增加的趋势, 各处理比对照增加51.24 %~ 105.29 %。
|
|
AsA和GSH是植物体内普遍存在的抗氧化物质。铝胁迫下, AsA含量呈不断下降的趋势, 与对照相比较, 下降了13.95 %~ 40.47 %, 铝胁迫浓度越高下降幅度越大(图 6)。而GSH含量随铝胁迫浓度的提高而增加(图 6), 至0.740 mmol·L-1铝处理时达最大值, 铝浓度大于0.740 mmol·L-1时GSH含量不断下降。但与对照比, 铝胁迫除1.85 mmol·L-1铝处理比对照降低2.60 %外, 其余各处理均比对照增加, GSH含量增加了17.75 %~ 58.01 %。

|
图 6 铝对龙眼叶片AsA和GSH含量的影响 Fig. 6 Effect of Al on the content of AsA and GSH in leaves of Longan |
铝胁迫导致植物细胞最直接最明显的伤害是:细胞膜结构和功能遭到破坏, 透性增大, 膜的稳定性降低, 细胞内的离子、糖类、氨基酸等被动外渗, 影响植物代谢, 这已在马尾松(Pinus massoniana)(曹洪法等, 1992; 高吉喜等, 1992)、小麦(胡红青等, 1995; 黄巧云等, 1994)、水稻(王建林, 1991)等植物上得到证实。铝胁迫下龙眼叶片细胞膜脂过氧化加剧, 膜脂过氧化的产物MDA显著增加, 铝胁迫浓度越大, 增加幅度越大, 可见铝胁迫浓度越大, 膜脂过氧化越严重。膜脂过氧化导致膜伤害, 膜透性明显提高, K+、大分子渗漏值增加。导致膜脂过氧化的原因是超氧自由基




导致龙眼幼苗叶片
SOD的作用是将


CAT和POD是植物体内担负清除H2O2的主要酶类, 它们可把H2O2变为H2O。通过SOD、CAT、POD三者协调一致的作用, 可使AOS维持在一个较低的水平。铝胁迫下龙眼幼苗叶片CAT活性不断下降, 比对照下降11.12 %~ 63.27 %; 低浓度铝胁迫时POD活性增加, 至0.370 mmol·L-1铝处理时达最大值, 当铝浓度>0.370 mmol·L-1时, 则逐渐下降, 但其活性在铝胁迫各处理中均比对照增加。CAT、POD的这种变化规律与Subrahmanyam等(1998)对四季豆的研究结果相似。相关分析表明, 龙眼叶片细胞H2O2的累积与CAT活性呈显著的负相关, 相关关系为y(H2O2)=-0.113 x(CAT)+77.94(R =-0.98**), 因此至少可以看出H2O2与CAT活性的下降密切相关。
AsA-POD和GR均为叶绿体中清除H2O2的重要酶。AsA-POD是叶绿体中专一地清除H2O2的关键酶(蒋明义等, 1996a)。GR则与AsA-POD、DHAR(脱氢抗坏血酸还原酶)等酶一起通过抗坏血酸-谷胱苷肽循环(又称Foyer-Halliwell-Asada循环)移去叶绿体中的H2O2, 同时可使植物体内的2种重要的氧化物质AsA和GSH得以再生(蒋明义等, 1996a; 秦小琼等, 1997)。铝胁迫下, 龙眼叶片AsA-POD活性则呈不断增加的趋势, 各处理比对照增加51.24 %~ 105.29 %, GR活性随铝胁迫浓度的变化规律与POD相似, 铝胁迫各处理GR的活性比对照均有所提高, 这可能是叶绿体系统对铝胁迫的一种适应。AsA和GSH均为植物体内有效的抗氧化剂。本试验结果表明, 铝胁迫导致AsA含量不断下降, 铝胁迫浓度越大下降幅度越大, 本结果与陈立松等(1998a;1998b)研究结果相似。这与AsA还原


曹洪法, 高吉喜, 舒俭民. 1992. 铝对马尾松幼苗影响的研究. 生态学报, 12(3): 239-246. |
陈立松, 刘星辉. 1998a. 渗透胁迫下Ca2+对龙眼叶片光合色素及膜脂过氧化的影响. 园艺学报, 25(1): 87-88. |
陈立松, 刘星辉. 1998b. 水分胁迫对荔枝叶片活性氧代谢的影响. 园艺学报, 25(3): 241-246. |
陈少裕, 刘杰. 1991. 水分胁迫对甘蔗叶片线粒体膜流动性的影响及其与膜脂过氧化的关系. 植物生理学报, 17(3): 285-289. DOI:10.3321/j.issn:1671-3877.1991.03.002 |
高吉喜, 曹洪法, 孙德玲, 等. 1992. 铝对马尾松生长状况影响的研究. 中国环境科学, 12(2): 118-121. |
胡红青, 黄巧云, 李学垣. 1995. 不同铝浓度对小麦根系分泌氨基酸和糖类的影响. 土壤通报, 26(1): 15-17. |
黄巧云, 李学垣, 徐凤琳. 1994. 铝对小麦幼苗生长和根的某些生理特性的影响. 植物生理学通讯, 30(2): 97-100. |
蒋明义, 郭绍川. 1996a. 渗透胁迫下稻苗中铁催化的膜脂过氧化作用. 植物生理学报, 22(1): 6-12. |
蒋明义, 郭绍川. 1996b. 水分亏缺诱导的氧化胁迫和植物的抗氧化作用. 植物生理学通讯, 32(2): 144-150. |
蒋明义, 荆家海. 1993. 植物羟自由基的产生与其脂质过氧化作用启动的关系. 植物生理学通讯, 29(4): 300-305. |
李晓玲, 杨进, 骆炳山. 1999. 活性氧代谢与植物的抗逆性. 荆门职业技术学院学报, 14(3): 30-35. |
刘祖祺, 张石城. 1994. 植物抗性生理学. 北京: 中国农业出版社, 369-385.
|
秦小琼, 贾士荣. 1997. 植物抗氧化逆境的基因工程(综述). 农业生物技术学报, (5): 14-24. |
王爱国, 罗广华. 1990. 植物的超氧化物自由基与羟胺反应. 植物生理学通讯, (6): 55-57. |
王爱国, 叶发辉, 罗广华. 1993. 活性氧对花生叶片大分子量DNA的损伤. 植物生理学通讯, 29(4): 260-262. |
王建林. 1991. 土壤中铝的胁迫与水稻生长. 土壤, 23(6): 302-306. |
晏斌, 戴秋杰, 刘晓忠. 1995. 玉米叶片涝渍伤害过程中超氧自由基的积累. 植物学报, 37(9): 738-744. |
姚允聪, 曲泽洲, 李树仁. 1993. 土壤干旱与柿树叶片膜脂及膜脂过氧化的关系. 林业科学, 29(6): 485-491. |
Arakawa N, Tsustsumi K, Sanceda N G , et al. 1981. A rapid and sensitive method for the determination of ascorbic acid using 4, 7-diphenyl-1, 10-phenanthroline. Agric Biol Chem, 45: 1289-1290. |
Bowler C, Van Montagu M, Inze D. 1992. Superoxide dismutase and stress tolerance. Annu Rev Plant Mol Biol, 43: 83-116. DOI:10.1146/annurev.pp.43.060192.000503 |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Dhindsa RS. 1991. Drought stress, enzymes of glutathione metabolism, oxidation injury, and protein synthesis in Tortula ruralis. Plant Physiol, 95: 648-651. DOI:10.1104/pp.95.2.648 |
Ellman G L. 1959. Tissue sulfhydryl groups. Arch Biochem Biophys, 82: 70-77. DOI:10.1016/0003-9861(59)90090-6 |
Giannopolitis C N, Rice S K. 1977. Superoxide dimutase purification and quantitative relationship with water-solule protein in seedlings. Plant Physiol, 59: 315-318. DOI:10.1104/pp.59.2.315 |
Klapheck S, Ina Zimmer, Heinz Cosse. 1990. Scavenging of hydrogen peroxide in the endosperm of Ricinus communis ascorbate peroxidase. Plant Cell Physiol, 11: 1005-1013. |
Nakano Y, Asada K. 1981. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts. Plant Cell Physiol, 22: 867-880. |
Patterson B D, Mackae E A, Fergusen I B. 1984. Estimation of hydrogen peroxide in plant extracts using Titanium(Ⅳ). Anal Biochem, 139: 487-492. DOI:10.1016/0003-2697(84)90039-3 |
Subrahmanyam, Desiraju. 1998. Effect of aluminium on growth lipid peroxidation superoxide dismutase and peroxidase actiyities in rice bean and French bean seedlings. Indian Journal of Plant Physiology, 3(3): 240-242. |
 2003, Vol. 39
2003, Vol. 39