文章信息
- 薛永常, 李金花, 卢孟柱, 张绮纹.
- Xue Yongchang, Li Jinhua, Lu Mengzhu, Zhang Qiwen.
- 木质素单体生物合成途径及其修订
- THE LIGNIN SUBUNITS BIOSYNTHESIS PATHWAY AND ITS REWRITING
- 林业科学, 2003, 39(6): 146-153.
- Scientia Silvae Sinicae, 2003, 39(6): 146-153.
-
文章历史
- 收稿日期:2002-11-19
-
作者相关文章
2. 中国林业科学研究院林业研究所 北京 100091
2. The Research Institute of Forestry, Chinese Academy of Forestry Beijing 100091
木质素(lignin)是一种由肉桂醇等单体聚合而成的酚类多聚体,是植物中一种主要的天然产物,广泛存在于维管植物中,在植物体的机械支持、水分运输及其防御中起重要的作用(Whetten et al., 1995; Campbell et al., 1996; Douglas, 1996)。通常沉积于木质部和厚壁组织的导管分子次生加厚的壁上。木本植物木质素含量较高,占干重的15%~36%。木质素和纤维素、几丁质为世界上最丰富的天然多聚物之一。
我国是少林缺材的国家,目前木材年缺口量已达4 000万m3,严重制约了国民经济的发展。如何根据不同用材的需要,改善木材品质,提高人工用材林资源质量是林木育种的目标。而木质素的含量与木材利用关系密切,如纸浆材需要木质素含量低、纤维素含量高和纤维长度长的木材,而建筑材、装饰材及大口径材等则需要增加木质素含量,以提高木材力学性质。但常规育种手段很难迅速改变木材性状。定向培育适合不同工业用材需要的树木品系已经成为国家所需。木质素是在一系列酶的催化下聚合而成的,近年来,木质素生物合成酶基因的研究已成为植物分子生物学的热点之一。本文综述了近些年在木质素单体生物合成途径方面的研究进展。
1 木质素的组成木质素多聚体由不同量的p-羟苯基(H亚基)、邻甲氧苯基(G亚基)和芥子基(S亚基)单体组成。这些单体均来源于香豆酸羟基化和甲基化的衍生物——肉桂醇。木质素单体运输到细胞壁,随后进行自由基诱导的聚合作用,从而沉积成为较高交联度的木质素多聚体。木质素在不同高等植物体中是不同的,主要有2种类型:(a)裸子植物木质素,主要包括G亚基,及由松柏醇和少数由p-肉桂醇聚合而成的H亚基;(b)被子植物木质素,既包括由芥子醇聚合成的S亚基,也包括G亚基及少量的H亚基。在双子叶植物中,以S亚基和G亚基为主;在针叶植物中,木质素几乎不包括S单体。但是裸子植物的某些种中也含有一定量的S亚基,如麻黄(Ephedra trifured)就含有和被子植物相似的1:1的S:G的木质素;刺桐(Erythrina cristagalli)是一种被子植物,但却含有与裸子植物性质一样的G木质素,少数被子植物类群——主要包括被认为是“原始”被子植物的木兰科植物能产生少量S亚基。植物体存在多种类型的木质素以及多种木质素单体组成,充分表明植物体在进化和发育上具有不同的适应性或功能特性(Whetten et al., 1998)。
2 木质素的生物合成途径木质素的生物合成是在一系列酶催化下使苯丙氨酸或酪氨酸逐步转化为木质素单体,最终聚合成木质素的过程。此途径包括三部分:苯丙烷途径、木质素合成特异途径和木质素单体糖基化运输及聚合为木质素。木质素单体的含量、组成及总木质素含量随植物种类不同而不同。所涉及酶的种类、活性及比例的不同决定了不同单体产生和合成的速率及在木质素中不同木质素单体的比例,从而决定了特定木质素的产生。木质素单体生物合成途径即是将苯丙氨酸或酪氨酸转化为3种木质素单体中的一种的过程。本文以此途径中所涉及到的酶类分别介绍。
2.1 苯丙烷(phenypropanoid)途径苯丙烷途径已在近年间多次综述(Boudet et al., 1995;Baucher et al., 1998;Douglas,1996)。它是植物体次生代谢中的一个通用途径。
2.1.1 苯丙氨酸氨基裂解酶/酪氨酸氨基裂解酶(PAL/TAL)催化的苯丙氨酸或酪氨酸的脱氨基作用TAL只在草本植物中有报道。苯丙氨酸经PAL作用,其直接产物为对羟基苯丙烯酸。玉米PAL具有TAL活性,苯丙氨酸和酪氨酸的去氨基反应是由相同的酶完成的(Rosler et al., 1997)。PAL基因在不同植物中表达不同。在杨树正在发育的木质部、嫩茎和嫩叶中PAL活性最高(Subramaniam et al., 1993)。在刺槐(Robinia pseudoacacia)树干中,显著的PAL活性表现在边材的较嫩部分(与木质化有关)和边材-心材的分界处(与类黄酮生物合成有关)(Magel et al., 1997)。已通过免疫化学方法将PAL定位在胞质里、与高尔基体衍生的小泡、原生质膜和分化的导管次生壁加厚部分(Nakashima et al., 1997)。PAL活性的改变可影响S:G的比率,多基因复合物可能参与了G-亚基或S-亚基特异途径的代谢过程。
2.1.2 苯乙烯酸4-脱氢酶(C4H)催化苯乙烯酸羟基化为p-对羟基苯乙烯酸(pCA)C4H是一种属于CYP73亚家族、与细胞色素P450有关的单氧化酶。在杨树中,C4H活性与木质素和厚壁组织相联系,可被真菌处理、真菌感染、受伤及化学诱导剂所诱导。拟南芥(Arabidopsis thaliana)C4H启动子保留在PAL和4CL基因中的顺式作用组分,控制着对光、紫外照射等处理反应的表达(Schuler, 1996)。
2.1.3 对羟基苯乙烯酸3-脱氢酶(C3H)催化pCA在C3位的羟基化形成咖啡酸(CA)C3H是一种酚酶,迄今尚未从任何一种植物中纯化出。在栎属(Quercus)幼苗的根部,已看到从苯丙氨酸向CA的转化定位在微粒体中,认为PAL、C4H和C3H作为一种多酶复合体可能结合于原生质膜上或编码于细胞器中。但它们在木质素合成途径中的作用尚不清楚(Whetten et al., 1995)。
2.1.4 对羟基苯乙烯酰CoA-3-脱氢酶(CCoA3H)可能涉及到另一种羟化途径木质素单体的生物合成途径在pCA处分为2分支:一支通过p-对羟基苯乙烯酰CoA到咖啡酰-CoA;另一条为通过CA和阿魏酸(FA)形成阿魏酰-CoA。现在尚不知道在木质素单体的生物合成中CoA硫酯的形成是在羟基化和甲基化的前面还是后面。2个途径在某种程度上可能都很活跃,在不同程度上依赖于它们发生的组织或细胞类型,在CCoA3H的克隆方面尚无报道。
2.1.5 双重咖啡酸/5-羟阿魏酸O-甲基转移酶(COMT)以S-腺苷-L-蛋氨酸作为甲基基团的供体催化CA甲基化为FA和使5-OH-FA为SA(芥子酸)不同种的COMT具有不同的底物特异性,在杨树中已看到COMT对CA和5OHFA的活性,COMT在木质部高度表达,但在叶中不表达(Bugos et al., 1991; 1992)。在生长季出现2个COMT的活性高峰,明显反映出从早材到晚材木质部的转变。在百日草(Zinnia elegans)中,COMT的表达是与韧皮部和木质部纤维相一致,但与体外导管分子不一致(Ye et al., 1994;1995)。在花旗松(Pseudotsuga menziesii)愈伤组织中COMT的活性是与细胞壁相联系的(Zhong et al., 1998)。
2.1.6 咖啡酰CoA-O-甲基转移酶(CCoAOMT)O-甲基化也可以发生在HCA-CoA酯水平。普遍认为咖啡酰CoA是从p-对羟基苯乙烯酰CoA衍生的(Ye et al., 1994), CCoAOMT催化咖啡酰CoA甲基化为阿魏酰CoA。开始认为CCoAOMT是双子叶植物对病虫害反应的一种酶, 随后发现它也可明显地诱导百日草分化的导管分子的木质化(Ye et al., 1994)。组织印迹杂交表明COMT主要在百日草的嫩节的韧皮部纤维中表达,而CCoAOMT主要在发育的木质部中存在,在较老的茎节中,COMT和CCoAOMT在韧皮部纤维和分化的木质部中都存在(Ye et al., 1995)。Ye等(1994)提出,在百日草中,这种甲基化旁路在木质素的生物合成中占主导作用。因为COMT活性的降低结果导致S亚基含量的戏剧性降低, 而G亚基无变化(Atanassova et al., 1995)或增加了(Van Doorsselaere et al., 1995), 认为G亚基的产生不是由COMT控制,而可能是CCoAOMT控制。在不同种植物木质部提取物中测到比COMT高得多的CCoAOMT活性(Ye et al., 1994)。在百日草中,咖啡酰CoA和5-羟阿魏酰CoA在体外能被甲基化,但不知道是否CCoAOMT催化这2个反应(Ye et al.,1994)。
2.1.7 阿魏酸5-脱氢酶(F5H)催化FA在C5位羟基化为5OHFAF5H是与C4H截然不同的与细胞色素P450相连的单氧酶,属于定名为CYP84的一种新的P450亚族(Schuler, 1996)。F5H是在杨树中发现的,定位于茎的微粒体部分, 在木质部特别是主要包括S亚基的厚壁组织中活性最高(Grand, 1984)。Meyer等(1996)克隆了拟南芥F5H cDNA。Meyer等(1998)证明F5H是决定木质素单体组成的一个潜在的调节步骤, F5H表达上的改变可以改变木质素单体的组成。因为假设F5H在裸子植物中不存在,就为通过将5-羟基基团介入木质素单体而达到改变木质素质量的遗传过程提供了一个控制点。
2.1.8 4-肉桂酰CoA连接酶(4CL)催化羟基香豆酸为羟基肉桂酰CoA4CL在针叶树种中催化对羟基苯丙烯酸、CA或FA的激活作用。已从大豆和大麦、连翘属(Forsythia)、杨树、玉米(Zea mays)及海岸松(Pinus pinaster)纯化或部分纯化出4CL,其cDNA序列也已在大麦、马铃薯(Solanum tuberosum)、大豆、海岸松、拟南芥、山杨(Populus davidiana)和烟草中报道(Voo et al., 1995)。4CL同工酶具有不同底物特异性和生物化学特性,4CL同工酶的不同表达可调节3种木质素单体的相对丰度,从而聚合成不同类型的木质素。
4CL基因主要在木质部中表达,而且在拟南芥幼苗发育早期就已发生,这和萌发2~3?d后子叶和根开始沉淀木质素是一致的,4CL的表达是与维管系统分化中的木质素沉积相一致,可以看作拟南芥维管系统中木质素分化的一个非常有用的标记(Lee et al., 1996)。Hu等(1998)在颤杨(Populus tremuloides)中发现2种功能和结构上不同的4CL基因——Pt4CL1和Pt4CL2。Pt4CL1和G-S木质素的生物合成相关,在木质化的木质部组织中表达,而Pt4CL2和其它的苯丙酮酸的形成有关,在茎的表皮层和叶片中特异表达。Pt4CL1和Pt4CL2基因表达被区域化以调节不同的苯丙烷类物质的形成。同时注意到在木质素组成上顶端前4节与第5节及以下节中的木质素组成不同,认为在颤杨茎从初生生长到次生生长的转化中涉及到木质素合成酶基因的发育调节的不同表达。
从PAL到4CL的苯丙烷代谢的调节可发生在代谢水平和基因表达水平。4CL可为松柏苷抑制,而松柏苷又是松柏醇的贮藏或运输形式,在春季正在分化的木质部中积累相当高的水平(占组织鲜重的4.5%)。因此可能存在一个由松柏苷调节的反馈抑制。
2.2 木质素合成中特异的途径 2.2.1 肉桂酰CoA还原酶(CCR)催化羟基肉桂酰CoA硫酯还原为其相应的醛已从蚕豆、云杉细胞培养物、杨树茎形成层汁液、桉树木质部纯化出CCR(Baucher et al., 1998)。在云杉中CCR特异利用阿魏酰CoA不用芥子酰CoA, 而蚕豆、杨树和桉树CCR利用p-肉桂酰、阿魏酰、芥子酰CoA作为它们的底物,但对阿魏酰CoA亲和力最高(Goffner et al., 1994)。CCR活性一般在植物中较低,预示着此步骤可能代表着调节木质素单体生物合成的一个重要的控制点(Grima-Pettenati et al., 1999;Lacombe et al., 1997)。Douglas等(1997)发现如果CCR活性降低最大,植物体中木质素含量降低最多,表明CCR是木质素生物合成的限速步骤。
2.2.2 肉桂醇脱氢酶(CAD)催化木质素前体生物合成的最后一步,即肉桂醛还原为肉桂醇CAD已从欧美杨(Populus × canadensis)、大豆、小麦、烟草、云杉、蚕豆中纯化(Baucher et al., 1998)。据报道在桉树木质部(Goffner et al., 1992)中有2种同工酶CAD1和CAD2, 它们具不同的底物特异性(Boudet et al.,1995)。CAD1活性较低,只有总CAD活性的4%,不使用芥子醛作为其底物(Goffner et al., 1992)。CAD2在被子植物中使用3种醛为其底物,在裸子植物中不用芥子醛作为其底物;在百日草中,CAD2最好的底物为芥子醇,随后为松柏醇和p-肉桂醇(Sato et al., 1997)。CAD2主要存在于木质部中,也存在于其它组织(Feuillet et al., 1995)。总CAD活性已定位在发育的木质部和韧皮纤维的胞质中及根的表皮和亚表皮细胞(Nakashima et al., 1997)。杨树中CAD活性定位在茎木质部和木质化的区域,实验发现4CL、CCR和CAD可能以一个多酶复合体的形式发挥作用(Roth et al., 1997)。
2.3 木质素单体糖基化(glycosylation)运输及氧化聚合为木质素 2.3.1 木质素单体糖基化运输3种木质素单体——p-羟基肉桂醇、松柏醇及芥子醇对植物体有毒且不稳定,其苯环羟基基团在UDPG/松柏醇葡萄糖转移酶作用下进行糖基化作用,分别形成3种木质素单体糖苷——p-羟基肉桂醇糖苷、松柏苷和丁香苷。这些糖苷在许多植物(大多数为针叶植物)中累积。松柏苷贮藏在导管中。而丁香苷在分化的木质部和内层韧皮部中累积,其量约为鲜重的1% (Baucher et al., 1998)。单体糖苷在分化的松科植物木质部导管细胞及木质部细胞壁存在,表明单体糖苷是在木质部分化的特定时期从维管运输到细胞壁中的,其机理尚不清楚。被子植物不积累单体糖苷,它们可能有其它的运输机理。
2.3.2 酶的氧化聚合作用至少有2种酶——过氧化物酶和漆酶参与木质素的聚合作用。许多年来,一直认为过氧化物酶在木质素聚合中起的作用要比漆酶大,现在尚不知道木质素聚合体是由过氧化物酶、漆酶还是另一种酚氧化酶或者这些酶的复合体催化的。如果一种氧化酶与木质化有关,那么它必须:(1)在空间上与木质化相一致,如定位在分化的木质部的细胞壁上等;(2)纯化的酶在体内能氧化木质素单体形成脱氢化的聚合体;(3)剔除这些基因将对木质素生物合成有影响。但在所有研究中这3点尚未同时出现(Ranocha et al., 1999)。Christensen等(1998)已从杨树木质部纯化出5种与木质化有关的过氧化物酶,其中2种同工酶(PXP3-4和PXP5)能氧化木质素单体类似物syringaldazine, 认为这2种同工酶可能和杨树中的木质化有关,它们在木质部特异表达,因此认为参与了木质素的聚合反应。
至今涉及木质素单体聚合的酶的性质还不清楚,Davin等(1997)认为过氧化物酶和漆酶在木质素合成中是协调一致而起作用的。Sterjiades等(1993)认为漆酶在木质化早期即从木质素单体向oligo-木质素的过程中起作用,而过氧化物酶则是在木质部发育的后期产生H2O2时才发挥作用。因为不依赖H2O2的酚氧化酶只存在于发育的木质部细胞内,而过氧化物酶活性则定位在整个木质部(Ranocha et al., 1999)。
3 对木质素单体生物合成途径的修订木质素单体的生物合成途径研究已经历了40多a,但是直到现在仍没有得到一个完全令人信服的结果。在近20 a中,随着研究手段的不断完善,对木质素单体合成途径也进行了不断的修订。
3.1 S-单体形成的新途径在被子植物中G-木质素和S-木质素的前体分别是松柏醇和芥子醇。F-5-H是S-单体生物合成所必须的。许多年来它在木质素生物合成中的作用被认为是将FA转化为5-OHFA,后者为SA和S-木质素的前体。最近研究证明F5H在S-木质素生物合成中的作用可能不同。第一,分析F5H超度表达的拟南芥、烟草和杨树,发现沉积的木质素几乎完全是由单一的S-木质素组成的(Meyer et al., 1996;Franke et al., 2000)。在F5H之外,CCoAOMT的发现提供了另一条不经过F5H而形成G-单体的途径。如果F5H在体内的底物确实是FA,那么很难理解为何F5H超度表达得到这样一种戏剧性的表型效应。第二,玉兰的同位素示踪实验表明了在芥子醇的生物合成中松柏醇的存在。拟南芥F5H的动力学分析表明虽然F5H催化FA的5-OH化,但它对松柏醛和松柏醇的亲和力要比对FA高1 000倍,松柏醛对阿魏酸的5-OH化有抑制作用。因此在木质素的生物合成中,F5H可能是对松柏醇和松柏醛起作用。在苯丙烷途径中它的位置发生了变化,位于原来认为的它的底物——阿魏酸的下游位置。
F5H的新的活性的鉴定导致了对O-甲基化酶的研究。它能够将“新”的F5H产物转化为S-单体,从拟南芥、杨树、苜蓿中已证明COMT对新的F5H产物具有活性。另外重组杨树COMT对5-OH松柏醛的Km要比对5-OHFA盐低5倍,几乎比对CA低30倍。同样,对重组苜蓿COMT的进一步研究发现,当5-OH松柏醛饱和时COMT表现出最高的Vmax/Km值,而对咖啡酸最低。表明COMT能在F5H后的松柏醛和松柏醇转化为芥子醛和芥子醇中起作用。COMT在木质素生物合成途径的位置也发生了重新定位,这和从前的转基因烟草COMT降低表达、杨树S-木质素的明显降低,而总木质素含量没有变化相一致。同时注意到,在这种新的木质素生物合成模型中,COMT已不再只对CCoAOMT起辅助作用,而成为木质素单体生物合成的一个主要酶类。
据认为木质素生物合成的第一个有关的步骤是对羟基苯乙烯酸或它的衍生物盐的羟基化。长期坚持的木质素生物合成模型认为此步是发生在自由酸水平,是由C3H催化的(Humphreys et al., 2002)。尽管在过去的30 a内进行了大量的尝试,直到今日C3H酶仍是最后几个尚未完全明了的传统苯丙烷酶类和基因之一。最近的研究使我们对此深奥莫测的酶有了些了解。
Schoch等(2001)使用功能基因组方法鉴定了一种可能是C3H的蛋白——CYP98A3。它是一种P450。曾报道一种P450能够使用莽草酸和对羟基苯乙烯酸的奎宁酸酯作为底物,当时它们并未被认为是木质素生物合成的中间物(Heller et al., 1985),尽管如此,CYP98A3的生化和动力学特性表明它能有效地将5-O-莽草酸和对羟基苯乙烯酸的5-O-D-奎宁酸酯转化为它们相应的咖啡酸结合物。对于奎宁酸酯,CYP98A3的产率为10·s-1。Franke等(2002)证明CYP98A3在木质素合成中的作用。他们在拟南芥中鉴定了一种降低表皮荧光8(reduced epidermal fluorescence 8)(ref8)的突变体,能在野生型植物中有芥子酸盐的条件下累积对羟基苯乙烯酸酯。ref8突变体具极低的木质素水平,其木质素不是由野生型的G-和S-单体组成,而是主要由p-肉桂醇组成。REF8基因的原位克隆表明它是CYP98A3。实验证明CYP98A3就是C3H。p-肉桂酰莽草酸和/或p-肉桂酰奎宁酸可能是木质素生物合成的重要中间物。C3H是拟南芥正常木质素合成和次生代谢所必须的。进一步研究证明,苯丙烷酯及其异酯在木质素合成的许多步骤中起着重要的作用,而这些原来认为是发生在游离酸水平上的。
3.2 木质素单体生物合成的控制点反义调节CCR、CAD研究使人们对木质素生物合成有了新的认识。CCR的降低调节能使烟草的Klason木质素降低50%,同时出现矮生长、顶端优势降低、不正常的叶形和枯黄病(Piquemal et al., 1998);但CAD降低调节表达的转基因烟草,Klason木质素只有少量降低,木质素组织颜色变浅,具有野生型表型(Halpin et al., 1994)。对这些看上去相互矛盾的结果的可能解释是,木质素化过程并未表现出充分可塑性而使CAD降低调节的植物直接从肉桂醛形成木质素,同时当CCR表达降低时没有充足的木质素沉积以支持其正常的发育。在只具有野生型32%CCR活性和12%CAD活性的转基因烟草中木质素降低了近50%,木质素颜色丧失,阿魏酸和芥子酸增加,就象只有CCR降低调节的植物一样。然而CCR/CAD双转基因植物的表型和野生型一致。核磁共振(NMR)分析CCR/CAD双转的木质素具有和正常木质素更相似的NMR图谱,和CAD缺陷或CCR缺陷植物的木质素不同,对其原因还不清楚。
Li等(2001)提出了一种不同的解释,传统的苯丙烷途径模型认为,CAD是一种催化G-和S-单体形成的多功能酶。他们从杨树分离出一种芥子酸脱氢酶(SAD),它和F5H和COMT共表达,和S-木质素的形成共同定位在一起。这暗示可能是SAD而不是CAD负责S-木质素单体生物合成的最后一步,CAD的降低调节只对植物的形态建成具有有限的作用。
图 1显示近20 a的木质素合成途径发展,从中可以看到对木质素合成途径的修订进程。
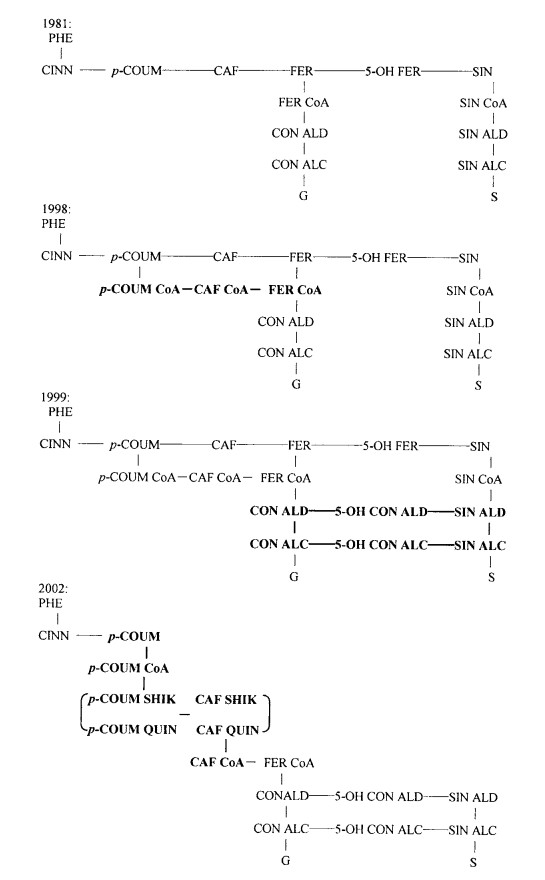
|
图 1 木质素生物合成途径发展简图(引自Humphreys and Chapple, 2002) Fig. 1 Outline of the development of lignin biosynthesis pathway(Cited from Humphreys and Chapple, 2002) (图中黑体字表示在此年代的重大发现。The boldfaces in fig. 1 imply the important findings in this period.)Phe:苯丙氨酸Phenylalanine;CINN:苯乙烯酸Cinnamic acid;p-COUM:p-香豆酸p-coumaroyl;CAF:咖啡酸Caffeoyl;FER:阿魏酸Feruloyl acid;SIN:芥子酸Sinapic acid;CON ALD:松柏醛Coniferaldehyde;SIN ALD:芥子醛Sinapaldehyde;CON ALC:松柏醇Coniferyl alcohol;SIN ALD:芥子醇Sinapyl alcohol;p-COUM SHIK:p-香豆酰莽草酸p-coumaroyl shikimate;p-COUM QUIN:p-香豆酰奎宁酸p-coumaroyl quinate;CAF SHIK:咖啡酰莽草酸Caffeoyl shikimic acid;CAF QUIN:咖啡酰奎宁酸Caffeoyl quinic acid;CAF CoA:咖啡酰CoA Caffeoyl CoA;FER CoA:阿魏酰CoA Feruloyl CoA;G:邻甲氧苯基Guaiacyl;S:芥子基Syringyl. |
在国内,木质素研究才刚刚起步(魏建华等,2001)。中国科学院植物研究所、北京市农科院农业生物技术中心已从毛白杨中克隆了4CL、COMT、CCoAOMT的cDNA,进行了功能鉴定与表达分析,得到了批量转基因植株,已筛选到木质素含量下调的杂交杨株系(Wei et al., 2001a; 2001b; 赵华燕等,2002)。中国林科院已从欧美杨107中克隆出控制木质素生物合成的PAL和CCR基因,并已经进行了载体的构建工作1),另还和加拿大哥伦比亚大学合作已将控制木质素生物合成的4CL基因转入杨树,得到转基因植株(李金花,内部交流)。此外,已从落叶松中克隆出控制木质素生物合成的4CL、COMT、CCoAOMT基因,现正向其它树种转化(卢孟柱,内部交流)。
1) 薛永常,李金花,卢孟柱等.欧美杨107PAL基因的RT-PCR扩增及其鉴定.林业科学,待发表
我们认为,今后我国木质素研究将主要集中在改良木材的材性和改善草类的消化性方面,通过调节木质素合成中关键酶基因的表达,以改变木质素的含量或单体组成,以满足工业不同用材的需要及畜牧用草的需要。
魏建华, 宋艳茹. 2001. 木质素生物合成途径及其调控的研究进展. 植物学报, 43(8): 771-779. DOI:10.3321/j.issn:1672-9072.2001.08.001 |
赵华燕, 魏建华, 张景昱, 等. 2002. 抑制COMT与CCoAOMT调控植物木质素的生物合成. 科学通报, 47(8): 604-607. DOI:10.3321/j.issn:0023-074X.2002.08.011 |
Atanassova R, Favet N, Martz F, et al. 1995. Altered lignin composition in transgenic tobacco expression O-methyltransferase sequences in sense and antisense orientation. Plant J, 8: 465-477. DOI:10.1046/j.1365-313X.1995.8040465.x |
Baucher M, Monties B, Montagu M V, et al. 1998. Biosynthesis and genetic engineering of lignin. Critical Reviews in Plant Sciences, 17(2): 125-197. DOI:10.1080/07352689891304203 |
Boudet A M, Lapierre C, Grima-Pettenati. 1995. Tansley review No.80 biochemistry and molecular biology of lignification. New Phytol, 129: 203-236. DOI:10.1111/j.1469-8137.1995.tb04292.x |
Bugos R C, Chiang V L C, Campbell W H. 1991. cDNA cloning, sequence analysis and seasonal expression of lignin-bispecific caffeic acid/5-hydroxyferulic acid O-methyltransferase of aspen. Plant Mol Biol, 17: 1203-1215. DOI:10.1007/BF00028736 |
Bugos R C, Chiang V L C, Campbell W H. 1992. Characterization of bispecific caffeic acid/5-hydroxyferulic acid O-methyltransferase from aspen. Phytochemistry, 31: 1495-1498. DOI:10.1016/0031-9422(92)83093-E |
Campbell M M, Sederoff R R. 1996. Variation in lignin content and composition. Plant Physiology, 110: 3-13. DOI:10.1104/pp.110.1.3 |
Christensen J H, Bauw G, Welinder K G, et al. 1998. Purification and characterization of peroxidases correlated with lignification in poplar xylem. Plant Physiol, 118: 125-135. DOI:10.1104/pp.118.1.125 |
Davin L B, Wang H B, Crowell A L, et al. 1997. Stereoselective biomolecular phenoxy radical coupling by an auxiliary (dirigent) protein without an active center. Science, 275: 362-366. DOI:10.1126/science.275.5298.362 |
Douglas C J. 1996. Phenylpropaniod metabolism and lignin biosynthesis: from weeds to trees. Trends in Plant Sci, (1): 171-178. |
Feuillet C, Lauvergeat V, Deswarte C, et al. 1995. Tissue- and cell-specific expression of a cinnamyl alcohol dehydrogenase promoter in transgenic poplar plants. Plant MolBiol, 27: 651-667. |
Frank R, McMichael C M, Meyer K, et al. 2000. Modified lignin in tobacco and poplar plants overexpressing the Arabidopsis gene encoding ferulate-5-hydroxylase. Plant J, 22: 223-234. DOI:10.1046/j.1365-313x.2000.00727.x |
Franke R, Hemm M R, Denault J W, et al. 2002. Changes in secondary metabolites and deposition of an unusual lignin in the ref8 mutant of Arabidopsis. Plant J, 30(1): 47-59. DOI:10.1046/j.1365-313X.2002.01267.x |
Franke R, Humphreys J M, Hemm M, et al. 2002. The Arabidopsis REF8 Gene encordes the 3-hydroxylase of phenylpropanoid metabolism. Plant J, 30(1): 33-45. DOI:10.1046/j.1365-313X.2002.01266.x |
Goffner D, Campbell M M, Campargue C, et al. 1994. Purification and characterization of cinnamoyl-coenzyme A:NADP oxidoreductase in Eucalyptus gunnii. Plant Physiol, 106: 625-632. DOI:10.1104/pp.106.2.625 |
Goffner D, Joffroy I, Grima-Pettenati J, et al. 1992. Purification and characterization of isoforms of cinnamyl alcohol dehydrogenase from Eucalyptus xylem. Planta, 198: 48-53. |
Grand C. 1984. Furulic acid 5-hydroxylase: a new cytochrome P450—dependent enzyme from higher microsomes involved in lignin synthesis. FEBS Lett, 169: 7-11. DOI:10.1016/0014-5793(84)80278-1 |
Grima-Pettenati J, Goffner D. 1999. Lignin genetic engineering revisited. Plant Science, 145: 51-65. DOI:10.1016/S0168-9452(99)00051-5 |
Halpin C, Knight M E, Foxon G A, et al. 1994. Manipulation of lignin quality by downregulation of cinnamyl alcohol dehydrogenasae. Plant J, 6: 339-350. DOI:10.1046/j.1365-313X.1994.06030339.x |
Heller W, Kuhnl T. 1985. Elicitor induction of microsomal 5-O-(4-coumaroyl) shikimate 3'-hydroxylase in parsley cell suspension cultures. Arch Biochem Biophys, 241: 453-460. DOI:10.1016/0003-9861(85)90570-3 |
Hu W J, Harding S A, Lung J, et al. 1999. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees. Nature Biotechnology, 17: 808-812. DOI:10.1038/11758 |
Hu W J, Kawaoka A, Tsa C J, et al. 1998. Compartmentalized expression of two structurally and functionally distinct 4-coumarate:CoA ligase genes in aspen (populus tremuloides). Proc Natl Acad Sci USA, 95: 5407-5412. DOI:10.1073/pnas.95.9.5407 |
Humphreys J M, Chapple C. 2002. Rewriting the lignin roadmap. Current Opinion in Plant Biology, 5: 224-229. DOI:10.1016/S1369-5266(02)00257-1 |
Lacombe E, Hawkins S, Van Doorsselaere J, et al. 1997. Cinnamoyl CoA reductase, the first committed enzyme of the lignin branch biosynthetic pathway: Cloning, expression and phylogenetic relationships. Plant J, 11: 429-441. DOI:10.1046/j.1365-313X.1997.11030429.x |
Lee D, Douglas C J. 1996. Two divergent members of a tobacco 4-coumarate:coenzyme A ligase (4CL) gene family. Plant Physiol, 112: 193-205. DOI:10.1104/pp.112.1.193 |
Lee D, Meyer K, Chapple C, et al. 1997. Antisense suppression of 4-Coumarate: Coenzyme A ligase activity in Arabidopsis leads to altered lignin subunit composition. Plant Cell, 9: 1985-1998. |
Li L, Cheng X F, Leshkevich J, et al. 2001. The last step of syringyl monolignol biosynthesis in angiosperms is regulated by a novel gene encoding sinapyl alcoho dehydrogenase. Plant Cell, 13: 1576-1585. |
Magel E, Hubner B. 1997. Distribution of phenylalanine ammonia-lyase and synthase within trunks of Robinia pseudoacacia L. Bot Acta, 110: 314-322. DOI:10.1111/j.1438-8677.1997.tb00646.x |
Meyer K, Cusumano J C, Somerville C, et al. 1996. Ferulate-5-hydroxylase from Arabidopsis thaliana defines a new family of cytochrome P450-dependent monooxygenases. Proc Natl Acad Sci USA, 93: 6869-6874. DOI:10.1073/pnas.93.14.6869 |
Meyer K, Shirley A M, Cusumano J C, et al. 1998. Lignin monomer composition is determined by the expression of a cytochrome P450-dependent monooxygenase in Arabidopsis. Proc Natl Acad Sci USA, 95: 6619-6623. DOI:10.1073/pnas.95.12.6619 |
Nakashima J, Awano T, Takabe K, et al. 1997. Immunocytochemical localization of phenylalanine ammonia-lyase and cinnamyl alcohol dehydrogenase in differentiating tracheary elements derived from Zinnia mesophyll cells. Plant Cell Physiol, 38: 113-123. DOI:10.1093/oxfordjournals.pcp.a029140 |
Piquemal J, Lapierre C, Myton K, et al. 1998. Dowm-regulation in cinnamoyl-CoA reductase induces significant changes of lignins profiles in transgenic tobacco plants. Plant J, 13: 71-83. |
Ranocha P, McDougall G, Hawkins, et al. 1999. Biochemical characterization, molecular cloning and expression of laccases-a divergent gene family-in poplar. Eur J Biochem, 259: 485-495. DOI:10.1046/j.1432-1327.1999.00061.x |
Rosler J, Krekel F, Amrhein N, et al. 1997. Maize phenylalanine ammonia-lyase has tyrosine ammonia-lyase activity. Plant Physiol, 113: 175-179. DOI:10.1104/pp.113.1.175 |
Roth R, Boudet A M, Pont-Lezica R. 1997. Lignification and cinnamyl alcohol dehydrogenase activity in developing stems of tomato and poplar: a spatial and kinetic study through tissue printing. J Exp Bot, 48: 247-254. DOI:10.1093/jxb/48.2.247 |
Sato Y, Watanabe T, Komamine A, et al. 1997. Changes in the activity and mRNA of cinnamyl alcohol dehydrogenase during tracheary element differentiation in Zinnia. Plant Physiol, 113: 425-430. DOI:10.1104/pp.113.2.425 |
Schoch G, Goepfert S, Morant M, et al. 2001. Cyp98A3 from Arabidopsis thaliana is a 3'-hydroxylase of phenolic esters, a missing link in the phenylpropanoid pathway. J Biol Chem, 276: 36566-36574. DOI:10.1074/jbc.M104047200 |
Schuler M A. 1996. Plant cytochrome P450 monoxygenases. Crit Rev Plant Sci, 15: 234-284. |
Sterjiades R, Dean J F D, Gamble G, et al. 1993. Extracellular laccases and peroxidases from sycamore maple (Acer pseuplatanus) cell suspension cultures: Reactions with monolignols and lignin model compounds. Planta, 190: 75-87. |
Subramaniam R, Reinold S, Molitor E, et al. 1993. Structure, inheritance, and expression of hybrid poplar (Populus trichocarpa×Populus deltoids) phenylalanine ammonia-lyase genes. Plant Physiol, 102: 71-83. DOI:10.1104/pp.102.1.71 |
Van Doorsselaere J, Baucher M, Chognot E, et al. 1995. A novel lignin in poplar trees with a reduced caffeic acid/5-hydroxyferulic acid O-methyltransferase activity. Plant J, 8: 855-864. DOI:10.1046/j.1365-313X.1995.8060855.x |
Voo K S, Whetten R W, O'Malley D M, et al. 1995. 4-Coumarate: coenzyme A ligase from loblolly pine xylem-Isolation, characterization, and complementary DNA cloning. Plant Physiology, 108: 85-97. DOI:10.1104/pp.108.1.85 |
Wei J H, Zhao H Y, Lu S F, et al. 2001a. Cloning of cDNA encoding COMT from Chinese white poplar(Populus tomentosa Carr), sequence analysis and specific expression. Acta Botannica Sinica, 43(3): 326-328. |
Wei J H, Zhao H Y, Zhang J Y, et al. 2001b. Cloning of cDNA encoding CCoAOMT from Populus tomentosa and study on down-regulation of lignin content. Acta Botannica Sinica, 43(11): 1179-1183. |
Whetten R, Sederoff RR. 1995. Lignin biosynthesis. The Plant Cell, 7: 1001-1013. DOI:10.2307/3870053 |
Whetten R, Sederoff R R. 1992. Phenylalanine ammonia-lyase from loblolly pine: Purification of the enzyme and isolation of complementary DNA clones. Plant Physiol, 98: 380-386. DOI:10.1104/pp.98.1.380 |
Whetten R S, Mackay J, Sederoff R R. 1998. Recent advances in understanding lignin biosynthesis. Ann Rev Plant Physiol Plant Mol Biol, 49: 585-609. DOI:10.1146/annurev.arplant.49.1.585 |
Ye Z H, Varner J E. 1995. Differential expression of two O-methyltransferase in lignin biosynthesis in Zinnia elegans. Plant Physiol, 108: 459-467. DOI:10.1104/pp.108.2.459 |
Ye ZH, Kneusel R E, Matern U, et al. 1994. An alternative methylation pathway in lignin biosynthesis in Zinnia. Plant Cell, 6: 1427-1439. |
Zhang X H, Chiang V L. 1997. Molecular cloning of 4-coumarate: coenzyme A ligase in loblolly pine and the roles of enzyme in the biosynthesis of lignin in compression wood. Plant Physiology, 113: 65-74. DOI:10.1104/pp.113.1.65 |
Zhong R, Morrisom H Ⅲ, Negrel J, et al. 1998. Dual methylation pathways in lignin biosynthesis. The Plant Cell, 10: 2033-2045. DOI:10.1105/tpc.10.12.2033 |
 2003, Vol. 39
2003, Vol. 39
