文章信息
- 裴东, 袁丽钗, 谷瑞升, 蒋湘宁.
- Pei Dong, Yuan Lichai, Gu Ruisheng, Jiang Xiangning.
- 核桃子叶不定根发生调控的研究
- REGULATION OF JUGLANS REGIA COTYLEDON RHIZOGENESIS
- 林业科学, 2003, 39(6): 33-39.
- Scientia Silvae Sinicae, 2003, 39(6): 33-39.
-
文章历史
- 收稿日期:2003-06-11
-
作者相关文章
2. 葡萄牙里斯本大学理学院 里斯本 1749-016;
3. 北京林业大学 北京 100083
2. Faculty of Science, Lisbon University, Portugal Lisbon 1749-016;
3. Beijing Forestry University Beijing 100083
核桃(Juglans regia)是难以诱导发生不定根的树种之一(郗荣庭等,1996;刘淑兰等, 1986;裴东等,2002)。不定根发生既是重要的理论问题,也是生产上面临的突出难题。在理论上,它的调控属植物发育理论的重要内容,涉及根器官的发生和树木复幼等基础理论;在实践上,核桃属重要的经济树种,而实现良种集约栽培,是发展农村经济的必经之路。因此深入研究核桃不定根发生机制、认识根原基调控规律和提高诱导频率,从理论到实践都显得尤为重要和迫切。
外源生长素可诱导不定根产生,如吲哚丁酸(IBA)和萘乙酸(NAA)等已成功地诱导和促进了多种木本植物产生不定根(黄学林等,1995)。然而在核桃及其它难以诱导生根的树木上,这种途径仍难奏效。不定根诱导的实质,是改变组织现有的基因表达模式,使之向着利于根原基发生的模式发展。然而目前对于这种模式转换的认识还十分有限,特别是对于核桃等难生根树种,转换的机制知之甚少。研究发现应用高浓度IBA可以改变核桃嫩茎内源IAA水平进而诱导生根,不定根的发生可能依赖IBA的刺激,但其生长并不一定需要高水平的IAA来维持(Heloir et al., 1996; Gatineau et al., 1997)。
树木不定根的发生表现出明显的组织年龄阶段性,成熟态组织难以诱导不定根, 而幼龄态组织如子叶容易产生不定根(Bonga, 1988; Berros et al., 1993)。由于核桃子叶具有良好的发生不定根潜力和诱导的规律性,加之取材容易,诱导方法简单和重复性好,因此成为研究难生根木本植物不定根发生较好的模式材料。
本研究对核桃子叶不定根发生模式进行了细致的探索,通过内源生长素和特异蛋白的变化,寻找二者与不定根发生的关系,以期从生理和生化水平上认识其调控规律,为从分子水平上阐述核桃不定根发生机理奠定基础。同时对其它难生根木本植物也具重要的借鉴意义。
1 材料和方法 1.1 材料及处理成熟或近成熟的核桃种实(盛花后130 d左右),采自中国林科院和军事科学院20龄自然授粉的树体,采集后将种实保存于4℃条件下备用。
种实经过仔细的流水清洗后,用75%乙醇浸泡2 min作为表面消毒,然后将种实沿缝合线一分为二,去胚,并将子叶横切为3部分:顶部、中部和基部(图版Ⅰ-1)。顶部为近胚端约0~0.7 cm, 中部为距近胚端约0.7~1.2 cm,其余为基部。3部分外植体分别在试管内进行不定根诱导。
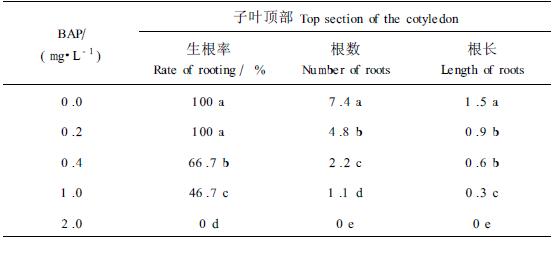
|
图版Ⅰ 1.右侧示核桃坚果纵切面图,左侧示将子叶横切后,自上而下切分成3部分:顶部、中部和基部;2.核桃子叶顶部在1/4 DKW上生根情况;3.核桃子叶的顶部、中部和基部在IBA为0.5~2 mg·L-1处理条件下生根状况;4.核桃子叶的顶部、中部和基部在IBA为2 mg·L-1处理条件下生根状况. a:顶部,b:中部,c:基部。 1. The right shows the vertical section of J.regia nut. The left shows the cut sections of J.regia cotyledon. From top to bottom: top section, middle section and basal section; 2. Rooting occured from J.regia cotyledon top section cultured on 1/4 DKW medium: 3. Rooting induced from middle and basal sedions of J.regia cotyledon cultured on the DKW medium containing 0.5~2 mg·L-1 IBA; 4. Rooting induced from the top, middle and basal sections of J.regia cotyledon cultured on the DKW medium with 2 mg·L-1 IBA; a: top section, b: middle section, c: basal section. |
基本培养基为1/4DKW(Driver et al., 1984)。诱导生根分别在1/4DKW,1/4DKW附加0.5~10 mg·L-1 IBA和1/4DKW附加0.05~2 mg·L-1 6-苄氨基腺嘌呤(BAP)的培养基上进行。每个处理采用约30个外植体,试验重复至少3次。培养过程中观察记录不定根发生的时间,并在诱导10 d后调查生根率、根生长状况和外植体愈伤化程度。培养采用:将子叶平放于内盛40 mL固体培养基的150 mL三角瓶中,每瓶接种3个外植体。培养条件为(25±3)℃,光强为1 800 lx,光/暗为16/8 h或完全黑暗。
不同部位的子叶接种在基本培养基和附加2 mg·L-1 IBA培养基上进行不定根诱导,并于培养的0,1,2,3,4,5,6,7,8 d分别取20个外植体, 在近胚端的子叶伤口处切取3~5 mm组织,加入约6% PVPP后在液氮中将其研碎,试验重复5次,将所有同一时间的样品在液氮中研磨混合,并保存于-70℃低温冰箱中用于内源IAA和蛋白分析。
1.3 内源吲哚乙酸(IAA)的提取及测定提取和测定按照裴东等(2002)的方法进行。1~3 g研碎样品用于IAA分析。
1.4 蛋白提取及SDS-PAGE电泳蛋白提取及SDS-PAGE(十二烷基磺酸纳-聚丙烯凝胶电泳)按照谷瑞升等(1999a)方法,并在去脂上进行了改进。约2 g研碎的样品悬浮于10 mL蛋白提取液中,4℃条件下充分溶解蛋白,悬浮液在4℃下15 000 g离心20 min,离心后将离心管放入-70℃冰箱中进行冻融去脂,待上层油脂冻结后,吸取中层的蛋白条带液,用3倍体积的冷丙酮(内含2%β-巯基乙醇)沉降蛋白条带,经过离心和丙酮真空挥发后,蛋白条带沉淀溶解于上样缓冲液中。缓冲液用量为每g样品(鲜重FW)300~400 μL, 沉淀充分溶解后,在4℃条件下15 000 × g离心5 min,离心后再于-70℃冰箱中冻融去脂,并重复2次。获得的水溶液即为待测蛋白条带溶液。蛋白条带定量按照Bradford (1976)方法。SDS-PAGE的浓缩胶浓度为3.9%, 分离胶浓度14%。电泳恒流36 mA。蛋白条带分子量根据标准分子量蛋白条带的Rf值确定。
1.5 统计分析生根率采用百分数差异显著性比较,其他均采用最小显著差数法(LSD)进行多重比较。
2 结果 2.1 子叶不定根的发生 2.1.1 子叶不同部位不定根发生能力的差异去胚子叶的顶部在1/4DKW基本培养基上经过5 d培养,有根出现,根多发生于靠近胚的部位,7 d后可以明显地看到粗而长的根,每个外植体一般发根5~12条(图版Ⅰ-2)。10 d后的统计结果显示其生根率为100%。而子叶的中部和基部经过10 d的培养没有不定根的发生;带胚的子叶顶部,经过10 d的培养,胚萌发长出茎和主根,近胚轴部的子叶没有不定根发生。
2.1.2 外源IBA对核桃子叶不定根发生的影响培养基中附加适量IBA (0.5~2 mg·L-1)对子叶发生不定根具有促进作用。对于子叶顶部, 随着附加IBA水平的提高,产生不定根的数量显著增多(图版Ⅰ-4),当IBA水平高于2 mg·L-1后,切口出现明显的愈伤化,不定根的发生和生长受到抑制。附加0.5~10 mg·L-1 IBA还明显地诱导了子叶中、基部发生不定根(图版Ⅰ-3、4,表 1);中部不定根的发生从两端切口开始,逐渐向周缘和中间扩展;基部多从切口的一端发生(图版Ⅰ-4)。IBA诱导下,中、基部不定根的出现时间较顶部在基本培养基上的发生时间晚,约为诱导后8 d。
|
|
培养基中附加BAP(0, 0.2, 0.4,1.0,2.0 mg·L-1)会不同程度地抑制子叶顶部发生不定根。表现为生根率下降,发根数和根长减少,根系变细。当BAP水平为2 mg·L-1,不定根的发生受到了完全抑制。
|
|
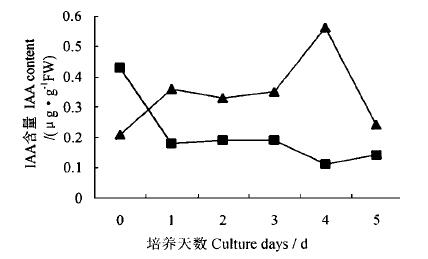
内源IAA分析显示,子叶顶部与中、基部间存在差异,顶部水平较低, 为0.21 μg·g-1 FW,而中、基部水平较高,为0.43 μg·g-1 FW,约是顶部的1倍多。
在基本培养基上,具有发根能力的顶部,其内源IAA在培养初期(0~1 d)IAA由0.21 μg· g-1 FW增加至0.36 μg·g-1 FW, 上升了近2/3倍,在随后的1~3 d,IAA维持在一定的水平。徒手切片观测发现此时正值根原基分化时期。诱导后4 d在根原基开始生长时IAA急剧上升,之后迅速下降,形成一个高峰(图 1)。而不具生根能力的子叶中部,其内源IAA水平表现为培养初期急剧下降,培养1 d后其水平由0.43降至0.18 μg·g- 1 FW, 下降了1半以上。在随后的培养中其水平相对稳定并略有下降(图 1)。
|
图 1 子叶顶部和中、基部在DKW上培养其内源IAA的变化 Fig. 1 Endogenous IAA changes in the top, middle and basal sections of J.regia cotyledon cultured on the DKW medium —▲—顶部Top section —■—中、基部Middle and basal secions |
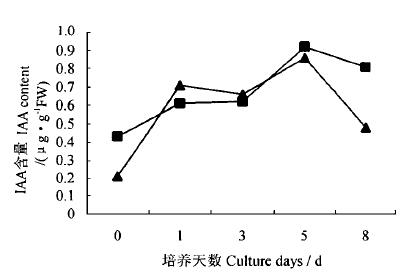
培养基中附加2 mg·L-1 IBA诱导了子叶中、基部发生不定根,并调节其内源IAA发生与顶部生根过程中相似的变化。表现为培养初期迅速上升,经过一个相对稳定期后出现一个高峰(图 2)。但IAA峰值发生时间推后了1 d, 在诱导的第5天出现。
|
图 2 外源IBA对子叶顶部和中、基部内源IAA的影响 Fig. 2 Effects of exogenous IBA on the endogenous IAA in the top, middle and basal sections of J.regia cotyledon —▲—顶部Top section —■—中、基部Middle and basal secions |
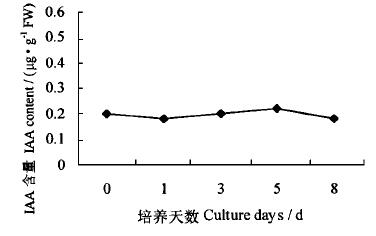
培养基中附加2 mg·L-1 BAP,子叶顶部在培养中其内源IAA维持在极为稳定的水平,变化幅度0.172~0.222 μg·g-1FW之间。
|
图 3 外源BAP对子叶顶部内源IAA的影响 Fig. 3 The effect of exogenous BAP on the endogenous IAA level in the top section of J.regia cotyledon |
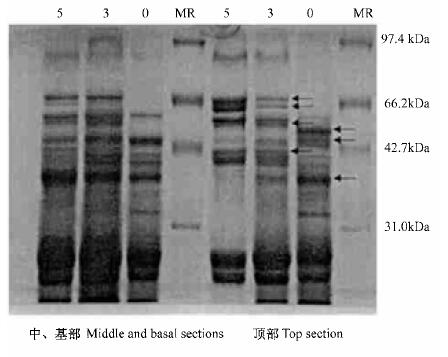
蛋白凝胶电泳结果显示,子叶顶部与中、基部本身在蛋白表达上存在差异,顶部具有特异的54.2 kDa蛋白条带,而中、基部表达较高的43.0 kDa蛋白条带(图 4)。
|
图 4 子叶顶部和中、基部在基本培养基上培养过程中的蛋白表达 Fig. 4 Protein profile in the top, middle and basal sections of J.regia cotyledon cultured on the DKW medium 上边数字为培养天数。MR:标准分子量蛋白。图中箭头从上向下示66.8,62.8,56.4,54.2,43.0,41.9,38.4 kDa蛋白条带。Top numbers show the culture days. MR: Protein marker. The arrows from top to bottom indicate 66.8,62.8,56.4,54.2,43.0,41.9,38.4 kDa protein bands. |
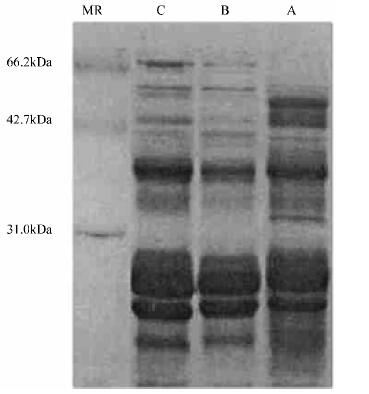
在不定根诱导过程中子叶的蛋白表达发生明显的改变。在基本培养基上培养3 d,能够生根的子叶顶部明显地增强62.8 kDa蛋白条带的表达和抑制38.4 kDa蛋白条带的表达;而不能生根的子叶中、基部主要表现为66.8、56.4和41.9 kDa蛋白条带表达增强和54.2 kDa蛋白条带的抑制(图 4)。培养基中附加2 mg·L-1 IBA可以诱导子叶中、基部产生不定根,同时诱导产生了62.8 kDa特异蛋白条带并抑制38.4 kDa蛋白条带的表达(图 5)。培养基中附加2 mg·L-1 BAP可以完全抑制子叶顶部发生不定根,其蛋白的表达也与在基本培养基上培养的不能生根的子叶中、基部相似(图 6)。

|
图 5 在诱导生根过程中IBA对子叶中部蛋白表达的影响 Fig. 5 Effect of exogenous IBA on the protein expression in the middle section of J. regia cotyledon 上边数字为培养天数。MR:标准分子量蛋白。图中箭头从上向下示62.8, 54.2和38.4 kDa蛋白。Top numbers show the culture days. MR: Protein marker. The arrows from top to bottom indicate 62.8, 54.2和38.4 kDa protein bands. |
|
图 6 在抑制生根过程中BAP对子叶顶部蛋白表达的影响 Fig. 6 Effect of exogenous BAP on the protein expression in the top section of J. regia cotyledon MR:标准分子量蛋白;A:培养前的子叶顶部;B:在附加2 mg·L-1 BAP的DKW上培养8 d的子叶顶部;C:在DKW基本培养基上培养5 d的子叶中、基部。MR: Protein marker;A: The cotyledon top sections before cultured; B: The cotyledon top sections cultured on DKW medium containing 2 mg·L-1 BAP; C: The cotyledon middle and basal sections cultured on basal DKW medium. |
核桃子叶在基本培养基上培养,不同部位表现出不同的生根能力。子叶顶部生根能力强,中、基部生根能力弱。对内源IAA和蛋白表达分析发现,子叶顶部IAA水平低并且有特异的54.2 kDa蛋白条带表达,而中、基部有43.0 kDa蛋白条带高水平表达,表明二者在生理生化上存在差异。从阶段发育看,子叶近胚端的顶部较中、基部发育程度高。66.8, 56.4, 41.9 kDa蛋白条带表达增强可能与子叶组织化程度和发育程度提高有关。生理生化上的差异或许解释了子叶不同部位生根能力不同的内在原因。
胚的存在会抑制子叶顶部发生不定根。其原因可能有二:一是带有胚,子叶顶部没有切伤的刺激;二是在培养过程中,胚的萌发和生长会形成一个强大的代谢库以汲取大量的营养物质,因而抑制了不定根的发生。
3.2 子叶不定根发生与内源IAA和蛋白表达的关系外源生长素促进内源IAA积累进而诱导生根的现象在苹果(Malus pumila)和大豆(Glycine max)上也已获得相似的结果。植物器官在离体培养过程中,由于切伤刺激和伤口释放诱导物质(Debergh et al., 1991;Centeno et al., 1996),生长素具有向受伤部位运输和积累的特点(Smulder et al., 1988),由此导致了其体内分布的改变。这一变化与器官发生密切相关。在猕猴桃(Actinidia deliciosa)研究中发现:叶柄在不含生长调节物质的基本培养基上培养,端部生长素IAA水平上升,表现出两端高中间低的新的分布特征(Centeno et al., 1996)。这一分布特点可能是叶柄基部易产生愈伤组织而在顶部易产生不定芽的重要原因之一。在基本培养基上,具有发根能力的核桃子叶顶部也表现出迅速积累IAA,IAA水平迅速提高的现象;而没有生根能力的子叶中、基部,其内源IAA水平迅速下降。内源IAA下降可能与体内活跃的氧化分解有关(Christine et al., 1991)。离体子叶组织内可能同时存在着IAA积累和氧化分解2个途径,二者间的动态平衡决定了组织内IAA水平,进而影响组织的根器官发生。
外源IBA可以提高核桃子叶中、基部组织内源IAA的水平进而诱导和促进发生不定根。在促进核桃嫩茎生根的研究中,Heloir等(1996)和Gatineau等(1997)也发现了外源IBA可以提高组织内源IAA水平进而诱导生根的现象。结合核桃子叶顶部和中、基部在基本培养基上培养期间IAA变化规律和生根结果,可以初步推断培养或诱导初期组织内源IAA水平的提高在启动根源基分化中发挥重要的作用。
核桃子叶发生不定根伴随有特异蛋白的变化。无论是经过IBA诱导还是未经IBA诱导,核桃子叶在根原基分化期都会特异地表达62.8 kDa蛋白条带和抑制表达38.4 kDa蛋白条带,因此这是两条与核桃子叶生根相关的蛋白条带。在生根相关蛋白研究方面,罗松1)在绿豆(Phaseolus radiatus)下胚轴不定根分化过程发现一个在生根诱导阶段特异表达的蛋白条带,分子量为34 kDa。PCR扩增产物表明这一蛋白是在生长素诱导条件下cdc2基因表达的产物。cdc2基因是调控细胞分裂周期的关键基因,在绿豆下胚轴各部位的细胞中都表达,尤以中柱鞘和内皮层细胞表达强烈。在烟草(Niocotiana tabaccum)原生质体培养中,发现了生长素诱导产生的2个特异蛋白,其对应cDNA克隆为Part A和B,这2个克隆都出现在细胞分裂由Go到S期转变中(Takahashi et al., 1989)。对核桃子叶生根相关蛋白的深入研究,有助于深入认识木本植物不定根发生机制。
1) 罗松.绿豆下胚轴不定根分化及cdc2基因表达.中国农业大学,博士学位论文,1996
3.3 子叶不定根发生的调控外源生长素可以诱导和促进多种木本植物产生不定根。一般认为,外源生长素是通过改变内源激素水平来发挥作用的(谷瑞升等,1999b)。外源IBA可以提高核桃子叶中、基部培养初期的内源IAA水平,成功地诱导二者生根。在培养烟草花枝外植体中发现:施用IAA可以迅速提高内源IAA水平,1 d后即可达到最高峰。外源生长调节物质通过影响内源激素水平而调节植物形态发生还表现在对转生长素基因植物的研究中。iaaH和iaaM是与生长素产生有关的基因。如果将转iaaH和iaaM基因的烟草叶柄培养在不含生长调节物质培养基上,2周后可以形成根;如果培养基上含有1 mg·L-1 BA和0.1 mg·L-1 NAA,则会先形成愈伤组织而后产生芽。在本研究中,外源BAP(2 mg·L-1)可抑制核桃子叶顶部发生不定根。目前细胞分裂素与生长素比值在调节植物离体器官发生中的作用已被广泛接受,二者比值高利于不定芽的发生,而比值低则利于不定根的发生(黄学林等,1995)。
外源IBA在诱导核桃子叶生根时还初步表现出内源IAA升高在前(0~1 d),特异蛋白的改变在后(3 d)。外源BAP对子叶生根具有抑制作用,也抑制了与生根相关的IAA变化和蛋白表达。因此在核桃子叶不定根发生的调控上,外源IBA和BA通过改变内源激素水平进而启动或抑制特异基因的表达而调节不定根发生,这一结果和良好的试验体系为进一步从分子水平上探讨木本植物根器官分化的机理,克隆生根相关基因奠定了良好的基础。
谷瑞升, 刘群录, 陈雪梅, 等. 1999a. 木本植物蛋白提取和SDS-PAGE分析方法的比较和优化. 植物学通报, 16(2): 171-177. |
谷瑞升, 蒋湘宁, 郭仲琛. 1999b. 植物离体培养中器官发生机制的研究进展. 植物学通报, 16(3): 171-177. |
黄学林, 李筱菊. 1995. 高等植物组织离体培养的形成建成和调控. 北京: 科学出版社, 101-143.
|
刘淑兰, 韩碧文. 1986. 核桃(Juglans regia L.)的离体繁殖. 北京农业大学学报, 12(2): 113-117. |
裴东, 袁丽钗, 奚声珂. 2002. 核桃品种试管幼茎生根的研究. 林业科学, 38(2): 32-37. DOI:10.3321/j.issn:1001-7488.2002.02.007 |
裴东, 郑均宝, 凌艳荣, 等. 1997. 红富士苹果试管培养中器官分化及其部分生理指标的研究. 园艺学报, 24(3): 229-234. DOI:10.3321/j.issn:0513-353X.1997.03.005 |
郗荣庭, 张毅萍主编.中国果树志核桃卷.北京:中国林业出版社, 1996:20-27
|
Bonga J M.阙国宁等译.树木组织培养.北京: 中国林业出版社, 1988: 21
|
Berros B, Astorga R, Rey M, et al. 1993. Rooting studies on "in vitro" walnut tissues : Aging effect. Acta Horticulture, 311: 105-116. DOI:10.17660/ActaHortic.1993.311.15 |
Bradford M M. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Centeno M L, Rodriguez A, Feito I, et al. 1996. Relationship between endogenous auxin and cytokinin levels and morphogenic responses in Actinidia deliciosa tissue cultures. Plant Cell Reports, 16: 58-62. DOI:10.1007/BF01275450 |
Christine H, Vendrig J C, Onckelen H V. 1991. The accumulation and metabolism on plant growth regulators during organogenesis in cultures of thin cell layers of Niocotiana tabaccum. Physiol Plant, 83: 578-584. DOI:10.1111/j.1399-3054.1991.tb02471.x |
Debergh P G, Zimmerman R H. 1991. Micropropagation: Technology and Application. London: Kluwer Academic Publisher, 1-13.
|
Driver J A, Kuniyukoi A H. 1984. In vitro propagation of Paradox walnut rootstock. HortScience, 19(4): 507-509. |
Gatineau F, Fouche J G, Kevers C, et al. 1997. Quantitative variations of indolyl compounds including IAA, IAA-aspartate and serotonin in walnut microcuttings during root induction. Biol Plant, 39: 131-137. DOI:10.1023/A:1000377511120 |
Heloir M C, Kevers C, Hausman J F, et al. 1996. Changes in the concentrations of auxins and polyamines during rooting of in-vitro-propagated walnut shoots. Tree-Physiology, 16(5): 515-519. DOI:10.1093/treephys/16.5.515 |
Smulder M J M, Croes A F, Wallems G J. 1988. Polar transport of 1 Naphthaleneacetic acid determines the distribution of flower buds on explants of tobacco. Plant Physiol, 88: 752-756. DOI:10.1104/pp.88.3.752 |
Takahashi Y, Niwa Y, Nacguda Y, et al. 1989. Isolation of an auxin-regulated gene cDNA expressed during the transition from G0 to S phase in tobacco mesophyll protoplasts. Proc Natl Acad Sci USA, 86: 9279-9283. DOI:10.1073/pnas.86.23.9279 |
 2003, Vol. 39
2003, Vol. 39