文章信息
- 谭毅, 周祖基, 黄琼, 杨伟.
- Tan Yi, Zhou Zuji, Huang Qiong, Yang Wei.
- 替代寄主被川硬皮肿腿蜂寄生后主要糖类含量及水解酶系活力的变化
- CONTENT OF SUGAR AND ACTIVITY OF α-AMYLASE & TREHALASE CHANGES OF SUBSTITUTE HOST PARASITIZED BY SCLERODERMA SICHUANENSIS XIAO(HYMENOPTERA:BETHYLIDAE)
- 林业科学, 2003, 39(4): 73-77.
- Scientia Silvae Sinicae, 2003, 39(4): 73-77.
-
文章历史
- 收稿日期:2001-09-11
-
作者相关文章
昆虫被寄生蜂寄生后生理生化方面的变化研究报道颇多,主要集中在寄生蜂蜂毒对寄主的作用(Beckage, 1987; David et al., 1994)、寄生蜂和寄主在激素水平的相互关系(Thompson, 1985)和寄生蜂对寄主生长发育的调控(Beckage, 1985; Grenier et al., 1986; Lawrence, 1986)、以及被寄生后寄主血淋巴和血细胞免疫机制(杭三保等,1991;陈志辅等,1992~1993)的改变等方面,并且这些研究主要是针对内寄生昆虫进行的,而对于外寄生蜂寄生后寄主机体组织结构及生理生化变化研究报道较少。川硬皮肿腿蜂(Scleroderma sichuanensis Xiao)是在四川发现的一个肿腿蜂新种(周祖基等,1997),是杉棕天牛(Callidium villosulum Fairmaire)和松墨天牛(Monochamus alternatus Hope)等钻蛀性害虫的优势天敌,但该蜂的自然种群数量小,难于在生产中大面积推广应用。本研究以替代寄主为川硬皮肿腿蜂的室内中间寄主,对替代寄主被川硬皮肿腿蜂寄生后主要生理生化及组织结构的变化进行了研究,以便为进一步研究川硬皮肿腿蜂的寄生生理、离体培养及大量繁殖提供科学基础。下面报道了替代寄主被寄生后机体主要糖类含量及相应水解酶活力变化方面的研究结果。
1 材料与方法 1.1 试验材料 1.1.1 供试寄生蜂室内繁殖的川硬皮肿腿蜂。
1.1.2 供试寄主室内繁殖的替代寄主(本替代寄主为一种鞘翅目(Coleoptera)昆虫,现处于技术保密阶段)。
1.2 试验方法 1.2.1 接蜂与培养替代寄主用2#处理液(本实验室自主开发的消毒液)消毒后置于指形管中,然后接入川硬皮肿腿蜂,寄生蜂与寄主比例为2:1,培养的温度(26.5±0.5)℃、相对湿度70%~85%。
1.2.2 检查与取样接蜂后,逐日观察记录替代寄主和川硬皮肿腿蜂的行为、形态变化,据二者在形态和行为方面的变化,划分川硬皮肿腿蜂寄生替代寄主的阶段进程;取寄生当天(第1天)、寄生后第3天、第6天、第10天分别进行生化分析,每阶段重复3次,取平均值。
1.2.3 糖原、海藻糖及还原糖含量的测定样品前处理:取替代寄主虫体1 g,加0.5 mol·L-1 PCA 4 mL研磨匀浆,然后用6 mL 0.5 mol·L-1 PCA洗匀浆器4次,一并转入离心管4 000 r·min-1离心20 min,收集上清液,再加5 mL 0.5 mol·L-1 PCA剧烈振荡5 min,4 000 r·min-1离心15 min,合并上清液,中速过滤入25 mL容量瓶中,蒸馏水定容,则为糖提取液。
样品测定:①取1 mL上述提取液加0.075 mol·L-1 H2SO4 2 mL水浴10 min,冷却后加300 g·L-1KOH 2 mL煮沸20 min,以破坏还原糖,取此液1.0 mL供蒽酮法测海藻糖(宁正祥, 1998)。②取上述提取液2.0 mL加6 mL 95%乙醇和2~3滴饱和Na2SO4溶液,在4℃温度下静置3 d,4 000 r·min-1离心15 min,弃上清液,70℃短时加热去乙醇得沉淀。将沉淀用蒸馏水溶解定容到一定体积供蒽酮法测糖原含量(宁正祥, 1998)。③取上述提取液1.0 mL,供3,5-二硝基水杨酸比色法测还原糖的含量1)。
1) 四川农业大学茶叶生化组.茶叶生化实验指导, 1988.
1.2.4 海藻糖酶的提取及活力测定海藻糖酶的制备:取替代寄主虫体1.0 g,加1 mL预冷的1/15 mol·L-1 pH 5.4的磷酸盐缓冲液冰浴匀浆,并用5 mL缓冲液洗涤匀浆器,一并转入离心管,4℃,4 000 r·min-1离心15 min,取上清液用缓冲液定容至10 mL即为海藻糖酶粗酶制剂,贮于4℃冰箱中备用。
酶活力测定:3,5-二硝基水杨酸比色法(同前)。
海藻糖酶活力X按下式计算:
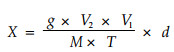
|
式中:X:海藻糖酶活力,μg·g-1min-1;g:标准曲线查得值,μg·mL-2;V1:粗酶液体积,mL;V2:反应液体积,mL;M:样品干重,g;T:反应时间,min;d:稀释倍数。
1.2.5 α-淀粉酶的提取及活力测定α-淀粉酶的制备:取替代寄主虫体1.0 g,加预冷的pH 6.9、0.004 mol·L-1的磷酸盐缓冲液1.0 mL冰浴匀浆,另用2.0 mL磷酸盐缓冲液洗涤匀浆器,一并转入离心管,5 600 r·min-1,2℃离心15 min,取上清液定容到10 mL即为粗酶制剂,0℃保存备测。
酶活力测定-Bernfeld法(施特尔马赫,1992)。
α-淀粉酶活力按下式计算:
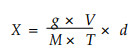
|
式中:X:淀粉酶活力,μmol·g-1min-1;g:标准曲线查得值,μmol·mL-1;V:粗酶液体积,mL;M:样品干重,g;T:反应时间,min;d:稀释倍数。
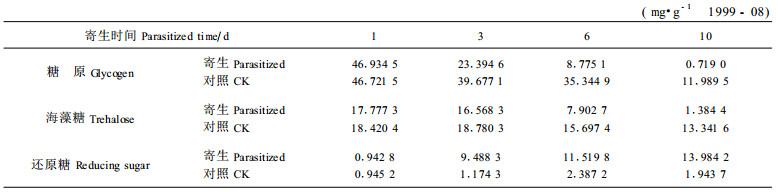
2 结果与分析 2.1 糖原含量的变化替代寄主被川硬皮肿腿蜂寄生后,糖原的含量发生急剧变化(表 1)。被寄生后的第1~3天,糖原含量迅速下降,第3天比寄生的当天下降23.539 9 mg·g-1,下降了50.15%;随后第3~6天持续下降,至被寄生后第10天几乎为0,仅含0.719 0 mg·g-1,比寄生当天下降了98.47%;对照变化也较剧烈,第1~10天几乎呈直线下降,但幅度相对较小,第10天比第1天下降了74.34%。
|
|
川硬皮肿腿蜂寄生替代寄主后,机体组织中海藻糖的含量发生了显著变化(表 1)。被寄生后的第1~3天变化相对较小,仅降低了6.80%,随后第3~10天持续下降,第10天比寄生当天降低16.392 9 mg·g-1,降低了92.21%;而对照海藻糖含量的变化却很小,几乎保持水平直线且维持在较高水平,这是因为对照均为正常生活的替代寄主。
2.3 还原糖含量的变化替代寄主被寄生后的第1~3天还原糖含量迅速上升,第3天比第1天增加8.545 5 mg·g-1(约9.1倍),第3~10天继续上升,第10天达13.984 2 mg·g-1,是寄生当天的14.8倍。对照还原糖含量第1~6天略有上升,第6~10天又稍有下降,整个时期保持相对稳定,说明对照机体维持着正常的糖代谢(表 1)。
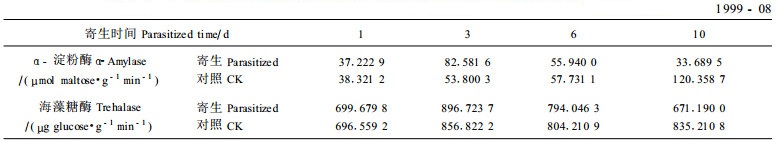
2.4 α-淀粉酶和海藻糖酶活力的变化替代寄主被川硬皮肿腿蜂寄生后,α-淀粉酶和海藻糖酶的活力均发生了明显的变化(表 2)。寄生后第1~3天,α-淀粉酶活力迅速上升达第3天的33.689 5 μmol·g-1min-1,82.581 6 μmol·g-1min-1,比第1天增加2.2倍,第3~6天维持在较高水平,第6~10天下降至低于被寄生当天的水平;而对照从第1天和寄生寄主相当的水平持续上升,第6~10天急剧升高至120.358 7 μmol·g-1min-1,因为此期是替代寄主的蛹期,而第6~10天又是其即将羽化的前期,体内发生极其复杂的生化变化,α-淀粉酶活力增强作用于贮备糖原,水解产生葡萄糖,为其提供急需的大量能源。
|
|
海藻糖酶活力的变化趋势与α-淀粉酶很类似。寄生后的第3天达到最大值896.723 7 μg·g-1min-1,比第1天增加了28.16%。然后逐渐下降,到第10天为671.190 0 μg·g-1min-1,比第1天低28.489 8 μg·g-1min-1,降低了4.07%;对照也在第3 d达最大值,但其最高值比寄生寄主低39.901 5 μg·g-1min-1(4.45%),然后一直维持在较高水平。
2.5 糖原、海藻糖和还原糖含量的变化与α-淀粉酶和海藻糖酶活力变化的关系替代寄主被川硬皮肿腿蜂寄生后第3天出现了α-淀粉酶和海藻糖酶的活力高峰,随后缓慢下降,保持较高的活力水平;相应地,糖原在寄生后的第1~6天、海藻糖在第3~6天含量迅速下降,然后缓慢降至寄生后的第10天接近零,而以葡萄糖为主的还原糖在寄生后的第1~3天含量急剧增加,随后第3~10天几乎呈直线持续上升(图 1)。由此可知,由于川硬皮肿腿蜂的寄生导致替代寄主体内α-淀粉酶和海藻糖酶活力的增强,二者分别作用于其底物糖原和海藻糖,从而引起其产物葡萄糖含量的上升。
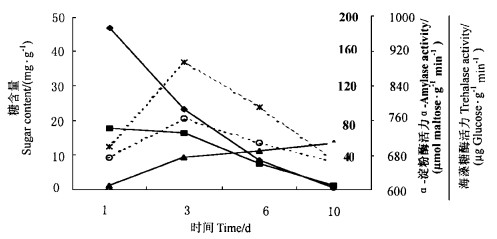
|
图 1 替代寄主被川硬皮肿腿蜂寄生后糖原、海藻糖及还原糖含量的变化与α-淀粉酶和海藻糖酶活力变化的关系 Fig. 1 Relationship between the activity of α-amylase & trehalase and the content of glycogen、trehalose & reducing sugar in substitute host parasitized by S.sichuanensis 
|
糖类是昆虫骨架结构的重要组成部分和一切生命活动所需能量的直接来源,其中最主要的是糖原、海藻糖和葡萄糖。糖原是由α-D-吡喃糖残基组成的支链多聚糖,是昆虫体内主要的贮备糖(罗克斯坦, 1988)。海藻糖是昆虫血糖的主要成份,作为糖的一种贮存形式和主要的运输形式存在于血淋巴中,正常生活的昆虫体中海藻糖的含量常维持在一个较为恒定的水平(王荫长, 1998)。大多数昆虫体的还原糖以葡萄糖为主,正常生活的昆虫体内葡萄糖的含量较低,它作为直接的能源物质靠海藻糖维持其相对平衡。当昆虫摄入的葡萄糖对于其生命活动所需能量有盈余时,葡萄糖转化为糖原和(或)海藻糖贮藏在昆虫体内;反之若出现亏缺,则体内先期贮备的海藻糖和(或)糖原分解成葡萄糖,为昆虫的生命活动提供能源,并在昆虫体内维持在一个较为恒定的水平。这三者之间的代谢是通过酶促反应实现的,其中α-淀粉酶和海藻糖酶是两个重要的水解酶。
α-淀粉酶广泛地存在于昆虫的血淋巴、脂肪体、肌肉和生殖系统中,在正常生活的昆虫体内,α-淀粉酶主要作用于贮备的糖原,促使其水解生成葡萄糖,为昆虫的生命活动提供能源(罗克斯坦, 1988)。海藻糖酶存在于昆虫的绝大多数组织,是昆虫体内一种极其重要的代谢酶类,它直接作用于昆虫的血糖——海藻糖,生成葡萄糖为昆虫的各种代谢活动提供直接的能源(罗克斯坦, 1988;王荫长, 1998)。
川硬皮肿腿蜂寄生替代寄主的第1~3天,α-淀粉酶和海藻糖酶的活力迅速上升,两种酶均在寄生后的第3天达到各自的最大值,随后维持在一个较高的水平;与此同时,机体内海藻糖的含量在被寄生后的3~6天、糖原含量在被寄生后的1~6天发生急剧下降,第10天均达到最低点;而机体内还原糖(主要为葡萄糖)的含量迅速上升,均在第10天达到最高值,此时川硬皮肿腿蜂幼虫开始孵化取食。这与丽蝇蛹集金小蜂(Nasonia vitripennis)寄生于Sarcophaga bullata的未滞育蛹后,由于蜂毒的注入,导致寄主O2呼吸量的急剧下降和寄主体内草酰乙酸、海藻糖及糖原含量的持续降低的变化规律相类似(David et al., 1994)。
对照替代寄主为正常生活的昆虫,此期不进行取食, 必须靠体内的贮备物质为其生命活动提供能量。所以在1~10天内,机体内糖原含量也持续下降(但下降幅度比寄生寄主小),但海藻糖和以葡萄糖为主的还原糖却维持在一个恒定的水平。这是因为在此期间海藻糖在海藻糖酶的作用下水解为葡萄糖以维持葡萄糖的相对恒定水平并为各种代谢反应提供能源,同时α-淀粉酶不断作用于糖原,使其水解为葡萄糖以补充海藻糖和葡萄糖的消耗。在第6~10天,α-淀粉酶和海藻糖酶均出现了一个活力高峰,这是因为此时替代寄主即将羽化,体内进行着复杂的生理生化变化为即将发生的变态做准备、需要消耗大量能量的缘故。
3.2 蜂毒的作用寄生蜂在产卵于寄主时,常注入毒液和产卵管萼液,从而导致寄主的生理生化起变化(Vinson et al., 1980)。替代寄主被川硬皮肿腿蜂寄生后的第1~3天α-淀粉酶和海藻糖酶的活力迅速上升,第3天均达最大值,酶活力的增加恰好发生在替代寄主被麻醉的这段时间内,这很可能是由于蜂毒的注入,激活了机体内α-淀粉酶和海藻糖酶的活力;但从本研究的结果可知,被寄生寄主的α-淀粉酶和海藻糖酶活力的最大值均明显地高于对照的最大值,这可能由于蜂毒中某种组份的刺激作用,导致了替代寄主体内新的水解酶的合成。天蛾绒茧蜂(Cotesia congregata)产卵寄生于烟草天蛾(Manduca sexta)幼虫后几小时内合成了一种分子量为33 kD的寄生专化性多肽,并证明这种多肽是由于雌性茧蜂的产卵管毒液和萼液诱导而产生的(Beckage, 1987),这从一定程度上证实了上面的推测。但替代寄主体内是否有新的酶蛋白合成、烟草天蛾体内的寄生转化性多肽是否具有酶活性均有待进一步研究证实。
在本试验过程中,极少发现被寄生后的寄主再被病菌感染的现象,这可能与蜂毒的抑菌作用有关。已有研究表明,蜜蜂蜂毒具有较强的抗菌作用,它对革兰氏阳性菌的抑菌浓度为1.25~25 μg·mL-1,对革兰氏阴性菌为1~10 mg·mL-1,同时对链球菌、枯草杆菌等也有一定的抑制作用(张豁中等,1995)。显然,搞清川硬皮肿腿蜂蜂毒抑菌的关键成份对于川硬皮肿腿蜂离体培养时选择合适的人工饲料杀菌剂有重要的意义。
陈志辅, 丁德诚. 1992. 昆虫寄生对寄主内分泌的影响. 昆虫学研究集刊第十一集(1992~1993): 153-158. |
杭三保, 陆自强. 1991. 二化螟幼虫被二化螟绒茧蜂寄生后血淋巴的生理生化变化. 昆虫学报, 34(4): 427-432. |
罗克斯坦M.李绍文等译.昆虫生物化学.北京: 科学出版社, 1988
|
宁正祥. 1998. 食品化学分析手册. 北京: 中国轻工业出版社.
|
施特尔马赫B.钱嘉渊译.酶的测定方法.北京: 中国轻工业出版社, 1992
|
王荫长主编.昆虫生理生化学.北京: 中国农业出版社(第二版), 1998
|
张豁中, 温宝麟. 1995. 动物活性成份化学. 天津: 天津科技出版社.
|
周祖基, 曾垂惠, 杨伟, 等. 1997. 川硬皮肿腿蜂生物学特性的研究. 林业科学, 33(5): 475-479. |
Beckage N E. 1987. Parasitism-induced hemolymph polypeptides in Manduce sexta (L.) larvae parasitized by the braconid wasp Cotesia congregata (Say). Insect Biochem, 17(3): 439-455. |
Beckage N E. 1985. Endocrine interactions between endoparasitic insect and their hosts. Ann Rev Entomol, 10: 371-413. |
David B R, David L D. 1994. Redirection of metabolism in the flesh fly, Sarcophaga bullata, following envenomation by the ectoparasitoid Nasonia vitripennis and corrcelation of metabolic effects with the diapause status of the host. J Insect Physiol, 40(3): 207-215. DOI:10.1016/0022-1910(94)90044-2 |
Grenier S, Delobel B, Bonnot G. 1986. Physiological considerations of importance to the success of in vitro culture:an overview. J Insect Physiol, 32(4): 403-408. DOI:10.1016/0022-1910(86)90053-3 |
Lawrence P O. 1986. Host-parasite hormonal interactions and overview. J Insect Physiol, 32(4): 295-298. DOI:10.1016/0022-1910(86)90042-9 |
Thompson S N. 1985. Metabolic integration during the host associations of multicellular animal endoparasites. Comp Biochemi Physiol, 81B: 21-42. |
Vinson S B, Iwantsch G F. 1980. Host regulation by parasitoids. Quart Rev Biol, 55: 143-165. DOI:10.1086/411731 |
 2003, Vol. 39
2003, Vol. 39